走马胎活性组分对肝癌HepG2 细胞DUSPs/MAPK 信号通路的影响
2021-03-09廖长秀莹黄桂坤潘勇韦建开
贺 珊 廖长秀 罗 莹黄桂坤潘 勇韦建开
(1.右江民族医学院药学院,广西百色 533000;2.广西肝胆疾病临床医学研究中心,广西百色 533000;3.右江民族医学院基础医学院,广西百色 533000)
走马胎Ardisia gigantifolia Stapf 为紫金牛科紫金牛属植物走马胎的干燥根茎,是广西民间应用较多的药物。有祛风湿、壮筋骨、活血祛瘀的功效,主治风湿筋骨疼痛、跌打损伤、产后血瘀和痈疽溃疡等[1-2]。研究发现走马胎主要成分有三萜皂苷类、没食子酸等[3],其中三萜皂苷类成分对多种肿瘤细胞均具有较强的抗肿瘤作用[4-6]。课题组前期研究发现走马胎水提液和醇提液及活性组分群均可明显抑制肝癌细胞增殖、侵袭和转移,并诱导其凋亡[7-8],但其抗肝癌机制尚不清楚。课题组前期采用基因表达谱芯片筛查发现走马胎水提液可显著升高肝癌细胞双特异性磷酸酶(dual specificity protein phosphatase,DUSPs)家族DUSP1、 DUSP4 和DUSP5 mRNA 表达水平(分别为8.5 倍、6.5 倍和19 倍)。DUSPs 家族中大部分成员为丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的负向调节剂,参与肿瘤细胞的增殖、凋亡、侵袭转移和耐药等过程[9-10]。本研究观察走马胎活性组分对肝癌细胞DUSP1/4/5 mRNA 和蛋白表达及其下游ERK/JNK/p38-MAPK信号通路的影响,以期明确走马胎活性组分抗肝癌的可能分子机制。
1 材料
1.1 细胞株 人肝癌HepG2细胞购于中国科学院细胞库。
1.2 试剂 走马胎购于广西玉林中药材市场,由右江民族医学院覃道光副教授鉴定为走马胎根茎。胎牛血清(乌拉圭Lonsera 公司,批号MI09331);DMEM 高糖培养基(美国 Gibco 公司,批号8117208);索拉非尼(美国MedChemExpress 公司,批号 10003);胰蛋白酶-EDTA 消化液(0.25%,不含酚红)、青链霉素混合液和MTT(北京索莱宝科技有限公司,批号分别为20160422、20160525、822A054)。RNA 提取试剂盒(美国 ZYMO RESEARCH 公司,批号ZRC00362);FastKing 一步法除基因组cDNA 第一链合成预混试剂和荧光定量PCR 试剂盒[天根生化科技(北京)有限公司,批号分别为S7614、S7717];PCR 引物由生工生物工程(上海)股份有限公司合成。BCA 蛋白定量试剂盒(增强型,批号为080919191105)及Western blot 常规试剂购于上海碧云天生物技术有限公司;兔抗DUSP1/4/5 单抗(英国Abcam 公司,批号分别为GR201669-3、GR266778-1 和GR201795-8);兔抗ERK、p-ERK、JNK、p-JNK,p38、p-p38(美国 Cell Signaling Technology 公司,批号分别为04、07、4、4、20、10);鼠抗GADPH 单抗、山羊抗鼠二抗、山羊抗兔二抗(北京中杉金桥生物技术有限公司,批号分别为TA-08、ZB-2305、ZB-2301)。
2 方法
2.1 分组及给药 走马胎活性组分的提取分离和总三萜皂苷含量测定参照文献[8]。走马胎药材粉碎后加入6 倍量60%乙醇回流提取3 次,每次2 h,合并3 次提取液,减压回收乙醇,并冷冻干燥为干粉,为制得的走马胎乙醇提取物。经水饱和正丁醇后上D101 大孔树脂,分别用蒸馏水、30%乙醇、50% 乙醇、70% 乙醇、95% 乙醇进行洗脱,各部分洗脱液经减压回收乙醇和真空冷冻干燥处理后得到干粉。经MTT 实验发现70%乙醇洗脱部位抗肝癌活性最强。70% 乙醇洗脱组分加甲醇溶解后,加于小孔树脂凝胶柱,分别用蒸馏水、30%甲醇、50%甲醇、70% 甲醇、100% 甲醇进行洗脱,各部分洗脱液经减压回收得到干粉。再经MTT 实验发现小孔树脂凝胶柱70%甲醇洗脱组分抗肝癌活性最强,硅胶薄层分析证明小孔树脂凝胶柱70%甲醇洗脱成分主要成分为三萜皂苷类,以齐墩果酸为对照品,紫外分光光度计检测其总三萜皂苷含量为39.50%。小孔树脂凝胶柱70%甲醇洗脱组分即为本研究采用的走马胎活性组分,和索拉非尼用DMSO 分别制备成4、8 mg/mL 和5 mmol/L,临用前以完全培养基(含10%胎牛血清、1%青链霉素混合液的DMEM 培养基)按1 ∶1 000 稀释为终浓度4 μg/mL、8 μg/mL、5 μmol/L 的培养液(0.1% DMSO)。实验分为4 组,空白对照组、索拉非尼组、走马胎活性组分(4、8 μg/mL)。取对数生长的HepG2 细胞以每孔3×105个细胞铺于6孔板,贴壁培养24 h 后加药处理,分别加入含不同质量浓度走马胎活性组分(4、8 μg/mL)或5 μmol/L的索拉非尼的完全培养基,空白对照组加入等体积的含0.1% DMSO 完全培养基。继续培养24、72 h,分别提取HepG2 细胞RNA 和蛋白进行后续实验。
2.2 RT-PCR 检测DUSPs 家族mRNA 表达 按RNA 提取试剂盒说明提取总RNA,用紫外分光光度法检测总RNA 纯度和浓度,取1 μg RNA 按试剂盒说明进行逆转录,取合成的cDNA 进行实时荧光定量PCR,以GAPDH 为内参,引物由Primer Premier 5.0 软件设计,引物序列、产物大小见表1。反应体系按试剂盒说明,反应条件均为,预变性95 ℃15 min,变性95 ℃10 s,退火/延伸60 ℃30 s,共40 个循环(Roche LightCycler96 实时荧光定量PCR 仪扩增)。根据相对定量计算公式=(E1为目的基因的扩增效率,E2为内参的扩增效率,ΔCt1为目的基因对照组平均Ct与样本Ct差值,ΔCt2为内参基因样本Ct与对照组平均Ct差值)对每个基因标准曲线扩增效率进行校正后,分析实验结果。实验重复3次。取PCR 产物进行1.5%琼脂糖电泳判断产物的特异性。
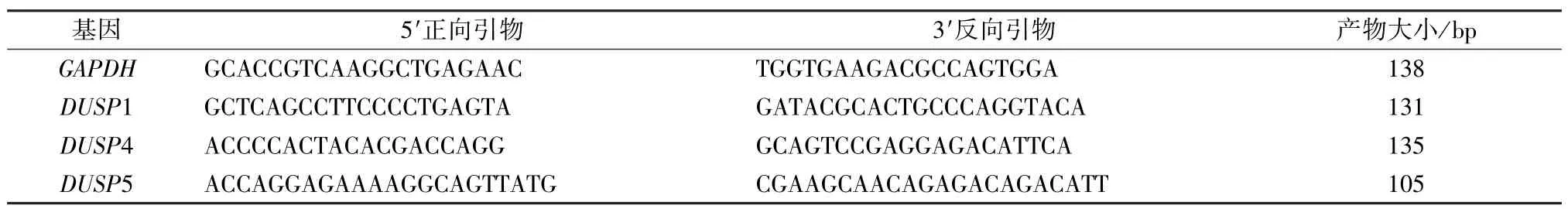
表1 实时定量PCR 引物序列及产物大小Tab.1 Primer sequences and product sizes of real-time quantitative PCR
2.3 Western blot 检测蛋白表达 提取细胞总蛋白,用BCA 法测蛋白浓度。各组样品加入5×上样缓冲液,震荡混匀后,加热煮沸5 min 使蛋白充分变性。SDS-PAGE 垂直电泳后,转膜。转膜后BSA封闭液室温封闭1 h。然后孵育一抗(内参抗体为小鼠抗GADPH 单抗,目的抗体为兔抗DUSP1、DUSP4、DUSP5、ERK、p-ERK、JNK、p-JNK、p38、p-p38 单抗,稀释比均为1 ∶1 000),4 ℃摇床过夜。TBST 洗3 次,每次10 min。进一步室温孵育二抗(内参蛋白二抗为山羊抗小鼠IgG 辣根酶标记,目的蛋白二抗为山羊抗兔IgG 辣根酶标记,稀释比均为1 ∶5 000),室温孵育2 h。TBST 洗脱二抗(5 min/次,大于5 次),然后暗室曝光。蛋白相对表达量=(目的蛋白灰度值给药组/相对应的内参蛋白灰度值)/(目的蛋白灰度值空白组/相对应的内参蛋白灰度值)。
2.4 统计学分析 采用SPSS 20.0 软件进行数据分析,数据以()表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD 检验,方差不齐采用Dunnett’s T3 检验。以P<0.05 为差异有统计学意义。
3 结果
3.1 走马胎活性组分对肝癌HepG2 细胞DUSP1/4/5 mRNA 和蛋白表达的影响 与空白对照组比较,走马胎活性组分低质量浓度组(4 μg/mL)作用24 h 后可升高HepG2 细胞DUSP1 mRNA,作用72 h HepG2 细胞后使DUSP1/4/5 mRNA 表达均明显升高(P<0.05 或P<0.01);走马胎活性组分高质量浓度组(8 μg/mL)作用24、72 h 可使HepG2 细胞DUSP 1/4/5 mRNA 表达水平均明显升高(P<0.01)。且随作用时间和走马胎活性组分浓度增加,HepG2 细胞DUSP1、 DUSP4 mRNA 增加更为明显。走马胎活性组分低和高质量浓度组不论作用24 h 还是72 h 均能显著升高DUSP1/4/5 蛋白表达,与空白对照组比较,差异有统计学意义(P<0.01)。
与空白对照组比较,5 μmol/L 索拉非尼处理HepG2 细胞24 h DUSP1 mRNA 表达升高(P <0.05),作用72 h 则可升高DUSP4、 DUSP5 mRNA表达(P <0.01)。处理24、72 h 均可明显升高DUSP1/4/5 蛋白表达,与空白对照组比较,差异有统计学意义(P<0.01)。见图1~2。
3.2 走马胎活性组分对肝癌HepG2 细胞MAPK 信号通路蛋白表达的影响 与空白对照组比较,走马胎活性组分(4、8 μg/mL)作用24、72 h 的HepG2 细胞ERK、JNK 和p38 磷酸化蛋白表达均明显降低,差异性有统计学意义(P<0.01)。且随走马胎活性组分浓度和作用时间增加,HepG2 细胞ERK 磷酸化蛋白表达降低更为明显,见图3。5 μmol/L索拉非尼处理HepG2 细胞24、72 h 对ERK、JNK 和p38 磷酸化水平均有所降低,与空白对照组比较,差异有统计学意义(P<0.01)。
4 讨论
MAPK 是细胞内一类丝氨酸/苏氨酸蛋白激酶,MAPKs 信号转导通路存在于大多数细胞内,可将细胞内的信号转导到细胞外,参与细胞的生长和分化、调节细胞周期和凋亡以及血管的生成等[11]。目前已经确定有4 条并行的MAPK 相关信号转导通路ERK1/2、JNK、p38 和ERK5 通路,通过调节肝癌细胞的增殖、凋亡和侵袭转移[12-15],在肝癌发生过程中起着重要的调控作用,成为肝癌防治的重要作用靶点。本研究发现随着走马胎活性组分浓度增加和作用时间延长,MAPK 信号通路中ERK、JNK/MAPK 和p38 磷酸化蛋白表达明显降低。提示走马胎活性组分可能通过调控ERK/JNK/p-38 蛋白的磷酸化水平从而达到抑制肝癌发生发展的作用。
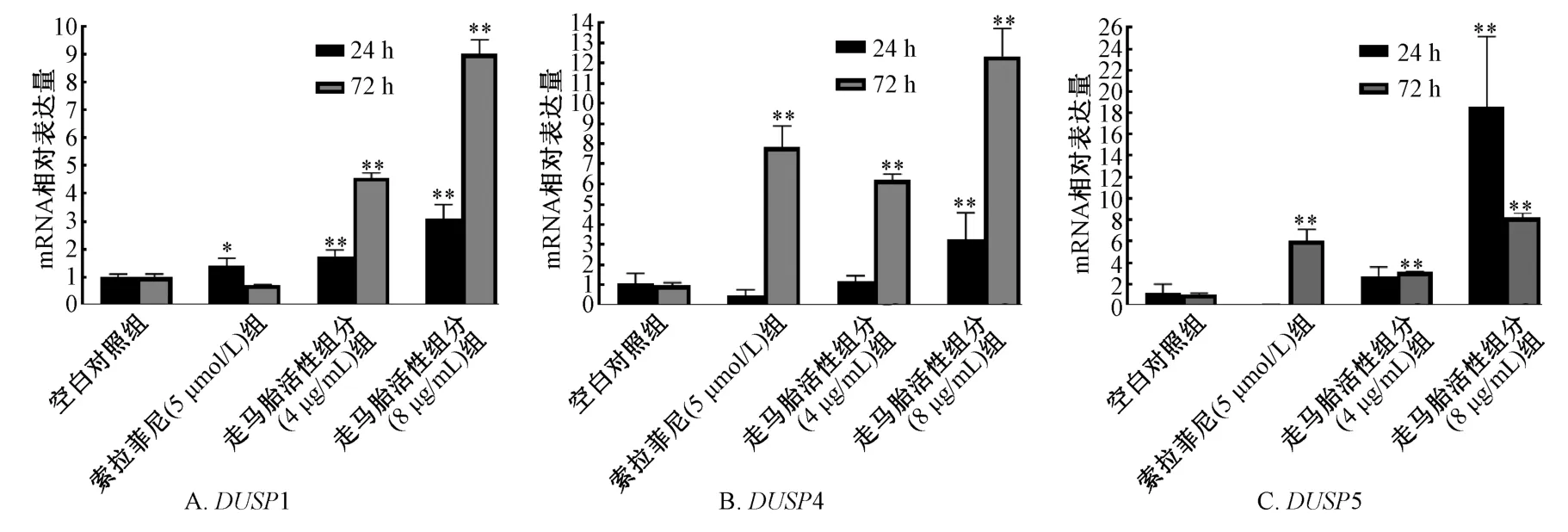
图1 走马胎活性组分对HepG2 细胞DUSP1/4/5 mRNA 表达的影响Fig.1 Effects of active components of A.gigantifolia on the expression of DUSP1/4/5 mRNA in HepG2 cells
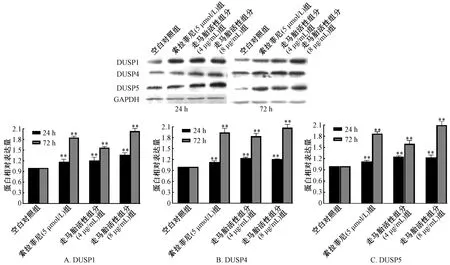
图2 走马胎活性组分对HepG2 细胞DUSP1/4/5 蛋白表达的影响Fig.2 Effects of active components of A.gigantifolia on the expression of DUSP1/4/5 protein in HepG2 cells
DUSP1/4/5 是蛋白质酪氨酸磷酸酶(protein tyrosine phosphatases,PTPs)超家族的成员,其在氨基酸一级结构上有PTP 保守序列,在一个底物内可同时使磷酸酪氨酸残基、磷酸丝氨酸/苏氨酸残基去磷酸化,使MAPK 通路失活,调控肿瘤细胞的增殖、凋亡、侵袭和转移等[16]。有研究报道DUSP1 低表达与低分化和肝细胞癌进展相关,而DUSP1 高表达则可抑制肝癌,延长肝癌病人生存期,机制可能与抑制p38 MAPK 磷酸化和促进p53磷酸化有关[17]。另有研究表明DUSP4 基因组的缺失可增加胰腺上皮内肿瘤的侵袭性,提示DUSP4可能抑制胰腺癌的侵袭[18]。Staege 等[19]发现霍奇金淋巴瘤细胞株中DUSP5 高表达进而调控促凋亡因子BCL2L11 而达到抗肿瘤的作用[19]。本实验研究发现,随着走马胎活性组分浓度和作用时间的增加,DUSP1/4/5 的mRNA 和蛋白表达与对照组比较,都有不同程度的升高,呈现剂量-时间依赖性。结合文献报道和本实验对MAPK 信号通路关键蛋白的研究,提示走马胎活性组分可能是通过升高DUSP1/4/5 的表达,使MAPK 信号通路失活,从而抑制肝癌的发生发展。
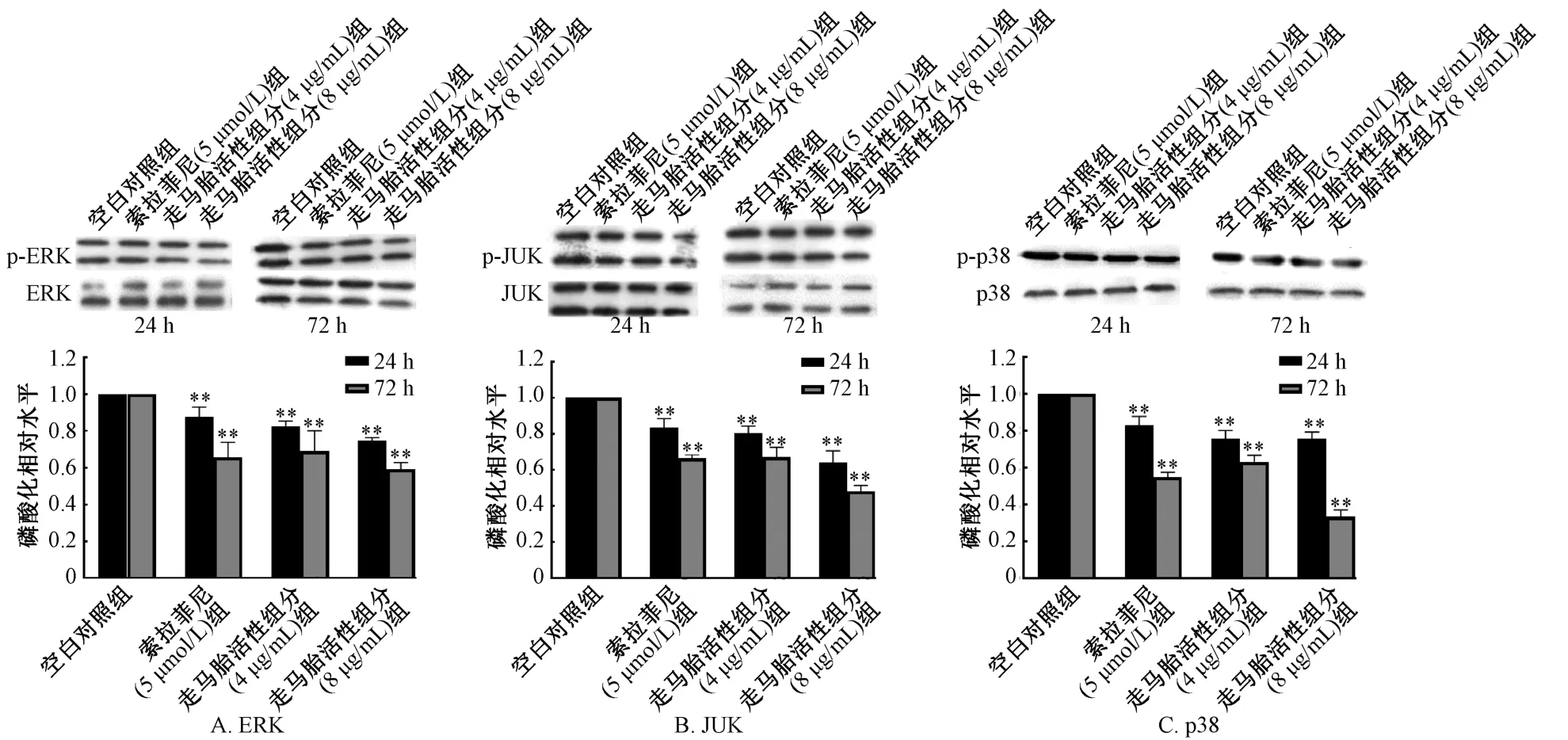
图3 走马胎活性组分对HepG2 细胞MAPK 信号通路磷酸化蛋白的影响Fig.3 Effects of active components of A.gigantifolia on the expression of phosphorylation protein of MAPK signal pathway in HepG2 cells
由以上可知,走马胎抗肿瘤活性组分的抗肝癌作用可能是通过影响DUSPs 家族成员(DUSP1、DUSP4 和DUSP5)mRNA 和蛋白的表达水平,进而影响下游的ERK/JNK/p38-MAPK 信号通路实现的,但具体的相互作用机制,有待下一步通过DUSP1/4/5 激动剂和抑制剂或通过siRNA 和过表达质粒慢病毒转染调控DUSP1/4/5 表达等实验进行验证。
