生物炭与炭基肥对大豆根际土壤细菌和真菌群落的影响
2021-03-09高文慧郭宗昊高科薛晨昌梦园刘远王光利
高文慧,郭宗昊,高科,薛晨,昌梦园,刘远,王光利
淮北师范大学生命科学学院,安徽 淮北 235000
土壤微生物是土壤环境中的一个主要成分,是土壤生态平衡和养分物质循环的主要调控者,土壤微生物群落在农田土壤生态系统中起着重要作用(荣涵等,2020;严君等,2019)。生物炭,是由农作物秸秆等生物质在无氧或限氧的条件下经过热裂解产生的一种固体颗粒物质,其具有较高的pH值、疏松多孔、含碳量较高、有机官能团丰富,稳定性强等特性,且随原料和制作工艺的变化而有所差异(蔡晓青,2019;邵慧芸等,2019;Chen et al.,2018;Sun et al.,2016)。由于热解炭化后的生物炭为粉末状,在运输、施用以及储存上都有一定的困难,且自身矿质养分含量低,生产上常将生物炭作为主要原料与一定比例的有机或无机肥料混合后造粒制成炭基肥(康日峰等,2014;魏春辉等,2016)。研究秸秆生物炭和炭基肥施用对土壤细菌和真菌群落的影响,评估其施用后对土壤质量的改良效果,可为秸秆资源合理利用和土壤培肥提供理论依据。
生物炭对农田土壤微生物群落的影响已受到人们的广泛关注(陈坤等,2018;王颖等,2019)。大量研究表明,生物炭添加通过直接或间接作用影响土壤微生物的生长和代谢,进而改变微生物群落结构与丰度(陈懿等,2020;殷全玉等,2020)。与非根际相比,根际区域内营养较为丰富,植物细胞脱落物与根系分泌物为根际微生物提供丰富碳源等营养物质,此外,在外界环境的刺激下,可能会引起根际效应进而刺激微生物活动,导致土壤酶活性较高且微生物活动较为频繁(程扬等,2018;刘京伟等,2020)。目前,相关研究更关注于非根际土,而且关于生物炭施加对根际土壤细菌和真菌群落的影响结果不一致。殷全玉等(2020)研究连续4年施用生物炭对非根际土微生物群落结构的影响,结果表明连续施用生物炭对细菌、真菌OTU数量和α-多样性指数没有显著影响,但改变了土壤细菌、真菌的群落结构。邵慧芸等(2019)关于小麦秸秆炭和烟杆炭两种生物炭对烤烟根际微生物群落结构影响的研究结果显示,与不添加生物炭处理相比,这两种生物炭处理显著降低了细菌和真菌的多样性,同时也改变了细菌和真菌优势种群的相对丰度。程扬等(2018)研究发现,与不施用生物炭相比,施加生物炭显著提高了非根际土壤微生物群落多样性,但对根际土壤微生物多样性没有影响。对竹子、水稻秸秆和粪便生物炭与化肥的配施研究表明,生物炭增加了玉米土壤细菌的多样性,但是与仅施用生物炭处理相比,生物炭-肥料的相互作用降低了细菌多样性,同时也改变了根际微生物的群落结构(Ibrahim et al.,2020)。以上研究表明,由于土壤类型、作物种类、种植方式和生物质炭原料不同,生物炭对土壤细菌和真菌群落影响结果的不尽一致(魏春辉等,2016;陈懿等,2020)。生物炭应用于作物生产,应该因作物类型、土壤类型和具体条件而异。
目前,有关生物炭添加对砂姜黑土微生物多样性影响的研究较少,还需要开展更多试验来探究生物炭添加对砂姜黑土细菌和真菌多样性的短期效应及长期效应。本研究通过黄淮海平原豆-麦轮作田间定位试验,采用生物炭不同施入量和增加生物炭缓施的施入方式,同时增加炭基肥处理,探究生物炭输入下砂姜黑土大豆根际细菌和真菌群落丰度和群落结构的变化,以期为生物炭在农业生产上的合理应用提供科学依据。
1 材料与方法
1.1 试验地概况与试验设计
试验地位于安徽省淮北市杜集区徐暨村(34°04′N,116°93′E),属于典型的温带季风气候,年平均温度14.8 ℃,年平均降水量830 mm,年无霜期202 d。供试土壤为砂姜黑土,试验开始前土壤pH值为 8.05,土壤有机碳为 11.35 g·kg−1,总氮为 0.98 g·kg−1,速效磷为 14.61 mg·kg−1,速效钾为 120.29 mg·kg−1。生物炭和炭基肥购自南京勤丰秸秆科技有限公司,水稻秸秆炭的pH为10.07,有机碳为470.70 g·kg−1,总氮为 9.19 g·kg−1,全磷为 6.01 g·kg−1,全钾为 19.12 g·kg−1,电导率为 139.75 μs·cm−1。
本试验设 5个处理,分别是:单施化肥对照(CK),750 kg·hm−2复合肥;秸秆还田配施化肥(CS),秸秆全量还田+750 kg·hm−2复合肥处理;炭基肥处理(BCF),单施 750 kg·hm−2炭基肥;低量生物炭配施化肥处理(LB),5 t·hm−2生物炭缓施+750 kg·hm−2复合肥处理;高量生物炭配施化肥处理(HB),20 t·hm−2生物炭+750 kg·hm−2复合肥。每个小区面积为20 m2(4 m×5 m),每个处理3次重复,采用完全随机区组设计。其中,施用复合肥中含有15% N、15% P2O5和15% K2O;炭基肥中含有15% N、15% P2O5、10% K2O和40%的有机养分。另外,炭基肥处理(BCF)在施肥时补充3.75 t·hm−2K2O,以使所有处理的氮磷钾量相同。每个试验小区均采用常规管理模式进行田间管理。
1.2 土壤样品的采集
大豆的供试品种为“中黄37”,于2017年6月下旬播种,并于2017年10月在大豆成熟期进行土样采集。随机选取6—8株植株,采用抖根法收集根围0—2 mm范围内根际土壤样品,将每个小区的土样混合均匀,装入干净无菌自封袋带回实验室。将样品分为3份:一份风干,用于土壤基本理化性质测定;一份放于 4 ℃冰箱,以供土壤总 DNA的提取;另一份放于−80 ℃冰箱冷冻保存以供后续分析。
1.3 土壤理化指标的测定
土壤pH、有机碳(Soil organic carbon,SOC)、总氮(Total nitrogen,TN)、速效磷(Available phosphorus,AP)和速效钾(Available potassium,AK)的测定参照鲁如坤(2000)的方法。土壤pH采用pH计按水土比为2.5∶1测定;土壤有机碳和总氮采用元素分析仪(Vario EL,德国)测定;土壤铵态氮和硝态氮用2 mol·L−1KCl浸提,用连续流动化学分析仪(AA3,德国)测定;土壤速效磷采用0.5 mol·L−1NaHCO3浸提-分光光度计法测定;速效钾采用NH4OAc浸提-火焰光度计测定。
1.4 土壤总DNA的提取、扩增与高通量测序
使用土壤基因组 DNA试剂盒(PowerSoil™DNA Isolation Kit,MoBio Laboratories Inc.,CA)提取0.5 g土壤样品的总DNA,利用琼脂糖凝胶电泳和超微量紫外分光光度计(ND-1000,NanoDrop Technologies,USA)检测DNA质量。
土壤细菌和真菌丰度采用实时荧光定量 PCR(qPCR)技术进行测定。细菌16S rRNA和真菌ITS区分别采用引物对 F338/R518和 5.8s/ITS1F进行qPCR扩增。qPCR扩增采用20 μL反应体系:10 μL 2X Universal SYBR Green Fast qPCR Mix,10 μM 正反向引物各 0.5 μL,DNA 模板 1 μL,8 μL无菌超纯水。每次扩增 qPCR产物通过 1%琼脂糖凝胶电泳验证qPCR产物的片段大小是否正确。本试验的标准曲线质粒稀释范围从 10−1—10−8,r2值大于0.98。结果以每克干土含有的基因拷贝数表示。
土壤细菌和真菌的群落组成分析通过高通量测序进行,该测定由上海天昊生物科技有限公司完成。利用细菌 16S rRNA V4—V5区特征性引物515F/907R和真菌ITS1区引物ITSI/ITS2分别进行扩增,扩增产物用纯化试剂盒进行纯化并用琼脂糖凝胶电泳检测PCR产物的质量,并构建文库。使用QIIME软件进行序列拆分和质量控制,将有效序列按照 97%相似性进行操作分类单元(Operational Taxonomic Units,OTU)聚类分析,将得到的OTU代表序列比对分类。采用 Mothur软件计算细菌和真菌的α-多样性指数,包括Chao1指数、ACE指数和Shannon指数。
1.5 数据处理与分析
运用SPSS 20.0软件进行单因素方差分析,用Duncan法进行显著性检验(P<0.05);利用 Excel 2010软件进行基础数据的整理并用Origin 8.5软件作图;用Canoco 4.5软件对土壤细菌、真菌群落相对丰度和基本理化性质作冗余分析(Redundancy analysis,RDA),分析相关关系。
2 结果与分析
2.1 施用生物炭和炭基肥对土壤理化性质的影响
由表1可知,与对照CK相比,BCF、LB和HB处理的pH、铵态氮和硝态氮含量无显著变化。不同处理下土壤有机碳和速效磷含量均呈现增加趋势。BCF、LB和HB处理的有机碳和速效磷含量显著高于对照 CK,且随着生物炭添加量的增加而增加;BCF、LB和HB处理的速效磷含量无显著差异。总氮含量在CS、BCF和LB处理下没有显著变化,而在HB处理中比对照显著提高,增幅达到8.9%。
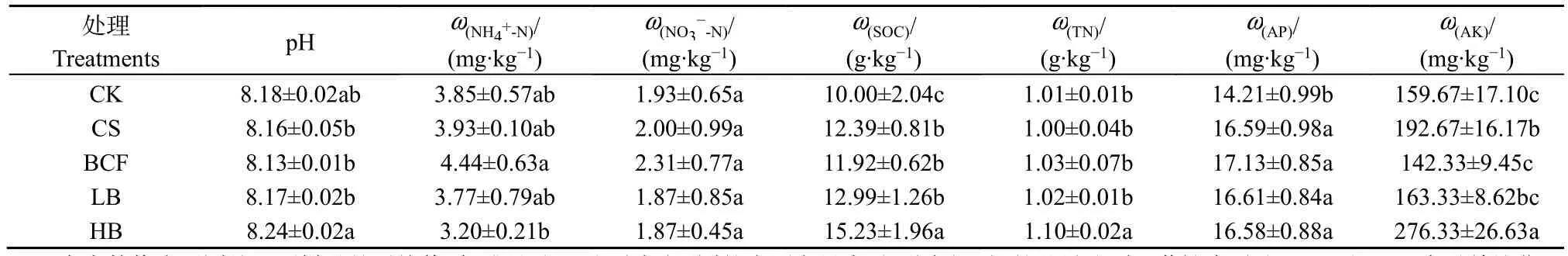
表1 施用生物炭和炭基肥对土壤理化性质的影响Table 1 Effects of biochar and biochar compound fertilizer application on soil physiochemical properties
2.2 施用生物炭和炭基肥对土壤细菌和真菌丰度的影响
从图1A可以看出,不同处理的细菌16S rRNA基因拷贝数为 3.01×1010—3.63×1010copies·g−1,不同处理间没有显著差异。从图1B可以看出,不同处理的真菌 ITS基因拷贝数位于 2.72×108—5.07×108copies·g−1,HB 处理下真菌拷贝数显著高于其他处理,CS、BCF、LB处理的真菌拷贝数与对照相比分别增加了30.5%、27.9%、25.0%,但均未达到显著性差异水平。

图1 不同处理细菌(A)和真菌(B)基因丰度Fig.1 Copy number of bacterial (A) and fungal (B) gene under different treatments
2.3 施用生物炭和炭基肥对土壤细菌和真菌多样性的影响
通过高通量测序,细菌和真菌群落分析分别获得1518197和2334861条有效序列,在相似水平为97%条件下,细菌和真菌 OTU数分别为 4455—4535和1142—1224,不同处理间没有显著差异(表2)。通过微生物群落α-多样性指数,比较不同处理下土壤细菌和真菌群落物种均匀度和丰富度变化。如表2所示,细菌群落的Chao1指数、ACE指数和Shannon指数在不同处理间没有显著差异。真菌群落的Chao1指数和ACE指数随着生物炭添加量的增加而增加,HB处理的真菌群落 Chao1指数和ACE指数显著高于对照CK;而与对照CK相比,真菌群落的Shannon指数在BCF、LB和HB处理下没有显著差异。说明生物炭与炭基肥施用对土壤细菌均匀度和丰富度没有影响,但是提高了真菌均匀度指数。

表2 不同处理细菌和真菌操作分类单元数(OTUs)和α-多样性指数Table 2 Operational taxonomic units and alpha diversity index of bacterial and fungal community under different treatments
2.4 施用生物炭和炭基肥对土壤细菌和真菌群落组成的影响
如图2A所示,大豆根际土壤细菌群落的优势类群依次是变形菌门(Proteobacteria)31.57%—34.01%、拟杆菌门(Bacteroidetes)10.99%—16.11%、酸杆菌门(Acidobacteria)11.37%—13.15%、放线菌门(Actinobacteria)7.58%—8.92%和绿弯菌门(Chloroflexi)7.17%—7.82%。与CK相比,HB处理显著降低了变形菌门的相对丰度,拟杆菌门、酸杆菌门、放线菌门和绿弯菌门相对丰度在不同处理间差异不显著。
大豆根际土壤真菌群落的优势类群依次是子囊菌门(Ascomycota)42.58%—56.25%、接合菌门(Zygomycota)13.18%—16.94%和担子菌门(Basidiomycota)5.73%—16.26%(图 2B)。与 CK相比,子囊菌门、接合菌门和担子菌门相对丰度在不同处理间没有显著差异。

图2 细菌(A)和真菌(B)在门水平上的组成分布Fig.2 Community composition of bacterial (A) and fungal (B) relative abundance at the phylum level
2.5 不同处理下微生物群落结构与土壤环境因子的关系分析
通过对不同处理土壤群落结构与土壤理化性质关系进行冗余分析,第一主轴和第二主轴解释了细菌总变异量的68.3%(图3A)。不同处理的样品点没有明显分开,其中LB和HB处理与CK的样品点在RDA2轴方向上分开一定距离,说明不同生物炭处理对细菌群落结构有一定程度的影响。另外,在所选的土壤环境因子中,与细菌群落结构相关性较大的因子为有机碳和总氮。
如图3B所示,第一主轴和第二主轴分别解释了真菌总变异量的37.8%、17.7%。CS处理与对照CK聚在一起,不同生物炭和炭基肥处理与CK在RDA1轴方向上明显分开,而HB处理的样本点单独聚在一起,与CK处理距离更大,说明添加生物炭和炭基肥改变了真菌群落结构,且添加高量生物炭对真菌群落结构的影响更为显著。此外,有机碳、总氮和速效钾对真菌群落结构具有显著影响(P<0.05)。

图3 细菌(A)和真菌(B)群落结构与土壤性质间的冗余分析Fig.3 RDA analysis of bacterial (A) and fungal (B) community structure and soil physiochemical properties
3 讨论
3.1 施用生物炭和炭基肥对大豆根际细菌群落的影响
生物炭和炭基肥添加到农田土壤后,可以通过改变土壤理化性质或者改变其他微生物种群的活性间接影响细菌群落(刘师豆等,2020)。Yao et al.(2017a)探究施用3年不同用量生物炭对东北黑土细菌群落组成的影响,结果表明生物炭处理显著增加了细菌丰度和α-多样性,尤其是在高剂量施加水平(8%)下,推测可能与土壤环境的变化有关,土壤pH作为影响细菌丰度的主要因素,试验中土壤pH随生物炭的添加显著上升。Zheng et al.(2016)研究表明,生物炭施用4年后显著提高了稻田土壤细菌的多样性(Chao1、ACE和Shannon),其变化与土壤 pH、有机碳和总氮呈正相关。此外,侯建伟等(2018)通过室内培养试验探究玉米、水稻和油菜秸秆生物炭对黄壤细菌群落的影响,结果指出不同来源秸秆生物炭的添加提高了细菌的丰度和多样性,且提升幅度与生物炭的类型有关,表明生物炭可以通过影响土壤化学性质和微生物细胞间信号物质的传递等方式间接改变细菌群落。本研究结果表明,不同处理的细菌16S rRNA基因拷贝数较对照CK提高了7.3%—20.6%,但未达到显著性差异水平(图1A)。同时,与对照相比,生物炭的施用对细菌群落的OTU数量和α-多样性(Chao1、ACE和Shannon)没有显著性影响(表2),这主要是与试验年限和土壤pH有关,生物炭自身结构比较稳定,含有大量不易被分解利用的芳香烃类物质,对土壤细菌的影响是一个漫长的过程(Dong et al.,2017;Hammes et al.,2009);此外,土壤 pH是调控细菌丰度和多样性的关键因子,本试验供试土壤呈碱性,添加生物炭对土壤pH没有显著影响(表1),这与Yao et al.(2017a)报道的土壤pH是影响细菌丰度主要因素的结果一致。
大量研究结果表明,不同微生物类别对生物炭处理所产生的响应存在差异(Yao et al.,2017a;陈泽斌等,2018)。土壤细菌群落组成(门水平)的分析显示,大豆根际土壤优势细菌为变形菌门、拟杆菌门、酸杆菌门、放线菌门和绿弯菌门(图2A),这与黄土高原以及东北地区关于土壤细菌群落组成的研究结果相吻合(王颖等,2019)。进一步分析处理间的差异,结果表明,高量生物炭处理较对照显著降低了变形菌门的相对丰度,这与陈泽斌等(2018)的研究结果类似,生物炭处理使烟草根际土壤变形菌门的相对丰度相较于不施用生物炭处理降低了0.7%—4.1%。变形菌门是细菌中最大的门类,包括大肠杆菌、沙门氏菌以及霍乱弧菌等多种病原菌,变形菌门是土壤中与pH相关性最高的细菌(黄家庆等,2020),而本研究供试土壤呈碱性,添加生物炭对土壤pH没有显著影响,故低量生物炭处理对变形菌门相对丰度没有显著影响。卢晓蓉等(2019)在研究中指出,在 3%的生物炭添加量下革兰氏阴性细菌的含量最高,而4%和5%的生物炭添加量下土壤各类磷脂脂肪酸含量呈下降趋势。这说明生物炭对土壤细菌群落的影响存在阈值,并不存在土壤细菌含量随生物炭添加量的增加而无限制升高的情况。本研究结果亦表明,高量生物炭较低量生物炭处理,变形菌门降低了5.87%,可能是高量生物炭处理土壤中多环芳烃等有害物质增加的缘故(Spokas et al.,2011;Hale et al.,2012)。与本研究结果不同,殷全玉等(2020)探究连续 4年施用生物炭对褐土土壤细菌多样性以及群落结构的影响,结果显示与仅施用30 kg·hm−2的纯氮相比,用量15 t·hm−2生物炭处理显著提高了变形菌门的相对丰度,可能是由于所取土样在烟草移栽前,避免了根系分泌物的影响。以上研究结果表明,生物炭对细菌群落组成的影响会因试验年限、取样部位以及生物炭用量等条件的不同而存在差异。本研究中细菌群落结构与土壤理化性质的冗余分析显示,生物炭处理对细菌群落结构有一定程度的影响,与细菌群落相关性较大的土壤性质为有机碳和总氮(程扬等,2018;李明等,2015)。土壤中的有机碳为土壤微生物提供了丰富的碳源,同时,氮素是微生物不可缺少的养分元素(施瑶等,2014),由于生物炭的稳定性较高,具有持续增加土壤有机碳的作用,有机碳和总氮的增加,提高了土壤中碳、氮元素的有效性和土壤中相关酶的活性,促进了土壤中微生物的新陈代谢,进而影响细菌的群落结构。
3.2 施用生物炭和炭基肥对大豆根际真菌群落的影响
与对照相比,不同处理均增加了真菌的基因拷贝数(25.0%—86.4%),其中,高量生物炭处理达到了显著水平(图1B),说明生物炭添加能提高真菌丰度且增加幅度与施碳量有关。这与Steinbeiss et al.(2009)和Jones et al.(2012)等关于生物炭的添加促进真菌生长的报道一致。Yao et al.(2017b)指出连续3年施用生物炭会促进土壤真菌的生长,尤其是在生物炭量为 8%的高碳量处理下最为显著,其原因可能是生物炭可以改善土壤的通气性和保水性,从而为土壤真菌提供更好的生存环境;另外,生物炭的添加可以间接改变土壤pH以及养分含量,进而导致真菌丰度的增加。生物炭可以通过直接或者间接的方式影响土壤真菌群落结构,一方面,大多数真菌在土壤中扮演分解者的角色,与细菌相比,对生物炭中碳利用能力较强(牛亚茹,2016;Lehmann et al.,2011);生物炭的添加在一定程度上使土壤的物理结构发生了改变,土壤孔隙度增加,养分矿化速度加快,促进了土壤真菌丰度的增加(张又弛等,2015;武玉等,2014);另一方面,通过改变土壤环境因子,如有机碳、总氮以及速效磷等养分含量,间接促进真菌的生长与繁殖。
土壤真菌群落结构与土壤理化性质的 RDA分析表明,生物炭和炭基肥的添加改变了真菌群落结构,且高量生物炭的施用对真菌群落结构的影响更为显著;并且有机碳、总氮和速效钾对真菌群落结构具有显著影响,这与吴宪等(2020)和季凌飞等(2018)的研究结果相一致。生物炭具有较强的吸附性,能够吸附土壤中的磷、钾、镁等不同存在形态的营养元素,丰富了土壤中有效性营养元素的含量,为真菌提供养分来源(Zhu et al.,2017;吴涛等,2017);同时,土壤中的碳、氮水平可以调节土壤真菌对其利用能力,增加土壤相关酶的活性,从而影响真菌群落结构(王轶等,2014;Lauber et al.,2008;Liu et al.,2015)。肖礼等(2017)在关于不同种植年限、不同种植类型下真菌群落组成影响因素的研究中发现,子囊菌门的相对丰度主要受总氮、速效钾的影响,接合菌门受土壤容重的影响较大,有机碳含量主要影响担子菌门。在本研究中,生物炭施用对真菌门水平上相对丰度没有显著影响,而真菌群落的Chao1指数和ACE指数随着生物炭添加量明显增加,同时,高量生物炭显著提高了真菌的均匀度指数(表2)。不同施用量的生物炭对真菌群落多样性影响不同,主要表现为真菌群落的丰富度和多样性的变化,其影响程度也与生物炭种类密切相关。这可能与生物炭独特的结构有关,生物炭具有较强的吸附性和疏松多孔等特点,给真菌提供了一个得天独厚的避难场所,有利于真菌的生长繁殖和多样性的增加(Meng et al.,2019;陈义轩等,2019)。
4 结论
生物炭和炭基肥的添加对大豆根际细菌丰度没有影响,但在一定程度上改变了细菌群落结构,体现在生物炭的添加显著降低了变形菌门的相对丰度。同时,高量生物炭处理显著提高了土壤真菌丰度和多样性指数,并改变了真菌群落结构。生物炭可以通过改善土壤的理化性质间接引起微生物群落结构的改变。
