腹腔镜手术联合术中放射治疗局部进展期直肠癌的回顾性研究
2021-03-05陈献则赵胜光施毅卿王常刚蒋奕玫季晓频
陈献则,程 兮,赵胜光,张 弢,施毅卿,刘 坤,王常刚,蒋奕玫,季晓频,赵 任
(上海交通大学医学院附属瑞金医院 a.外科,b.放疗科,上海 200025)
结肠直肠癌是常见的消化系统恶性肿瘤之一,发病率在男性恶性肿瘤中居第3位,在女性恶性肿瘤中居第2位,死亡率在男性和女性中分别居第4位和第3位[1]。手术始终是结肠直肠癌的首选治疗手段,然而局部进展期直肠癌(locally advanced rectal cancer,LARC)病人单纯接受手术治疗后的5年总生存率低于75%,肿瘤局部复发是影响病人生存和生活质量的主要原因之一。为改善LARC病人的生存预后,多种综合治疗手段,如辅助放化疗、靶向治疗、介入治疗等被广泛应用于多学科诊疗模式中。其中使用Mobetron移动式直线加速器进行术中高能电子束放射治疗是国内新近开展的辅助治疗手段之一。通过对手术切除后的可疑肿瘤残余区域进行一次精确的大剂量直接照射,达到改善LARC术后无局部复发率的目的。
本研究回顾性分析本院接受腹腔镜手术联合术中放射治疗(intraoperative radiotherapy,IORT)治疗的LARC病人,并通过配对标准设立对照组,分析比较腹腔镜手术联合IORT治疗LARC的术中及术后并发症、无局部复发率和总生存率。
资料和方法
一、临床资料
研究组纳入2012年1月至2016年1月笔者研究团队完成的腹腔镜手术联合IORT治疗的LARC病人22例。在同期开展的腹腔镜手术治疗563例LARC病人中,按以下配对标准选择对照组44例:①肿瘤TNM分期;②年龄、性别、体质量指数(body mass index,BMI);③手术方式。配对标准中要求肿瘤TNM分期、性别和手术方式完全一致。入组病人标准:①年龄在18~75岁;②术前内镜病理活检结果为腺癌;③中、高位直肠癌,肿瘤下缘距肛门>5 cm,不涉及保肛;④术前影像学检查评估临床分期为T3-4N0-2M0。不包括如下:①活动性出血、肿瘤穿孔或完全性结肠梗阻需急诊手术;②不可切除的肝、肺等远处转移灶;③重要脏器功能严重损害;④术前放疗或化疗等治疗。
研究组男10例,女12例,中位年龄54(29~71)岁。21例行腹腔镜直肠前切除术(L-Dixon)+IORT,其中2例合并末端回肠造瘘;另 1例行腹腔镜Hartmann术+IORT。对照组男20例,女24例,中位年龄 53(30~72)岁。42例行 L-Dixon术,其中4例合并末端回肠造瘘;2例行腹腔镜Hartmann术。两组均未行新辅助放、化疗,研究组并签署IORT知情同意书。两组根据术后病理TNM分期,按照指南推荐行辅助化疗,其中研究组14例、对照组28例接受辅助化疗。研究组术后不再行体外放射治疗,对照组术后接受 45.0~50.4 Gy的盆腔体外辅助放疗。本研究经我院伦理委员会批准。
二、手术操作
本研究手术均由笔者团队完成。病人均接受膜解剖指导下以神经为导向的腹腔镜标准全直肠系膜切除术,注意保留上腹下丛、下腹下丛、骶丛、盆内脏神经,将直肠系膜完整切除[2]。手术全程遵循肿瘤根治和无瘤操作原则:充分切除原发灶及累及的周围组织器官;保证足够的切缘并彻底清扫区域淋巴结。取出标本后行IORT。完成后,重新建立气腹。Hartmann术病人于左下腹行乙状结肠造口。Dixon术使用管状吻合器行直肠乙状结肠端端吻合,骶前留置引流管,根据吻合口的血供和张力决定追加末端回肠造瘘。
三、IORT
使用Mobetron移动式直线加速器行术中高能电子束放射治疗。经下腹部纵向切口取出肿瘤标本后,研究组根据可疑肿瘤残余区域由放疗科物理师选择合适的限光筒,并计算实施IORT的剂量。安置限光筒时,借助腹腔镜10倍放大的清晰图像来精确定位照射范围。通过支架将限光桶固定在手术床。然后移动加速器,调整仪器倾斜角度,使仪器激光轴与限光筒中心轴重合。最后,放疗科医师将电子线能量设置为6MeV,采用10~20 Gy的剂量行2 min的 IORT(见图 1)。
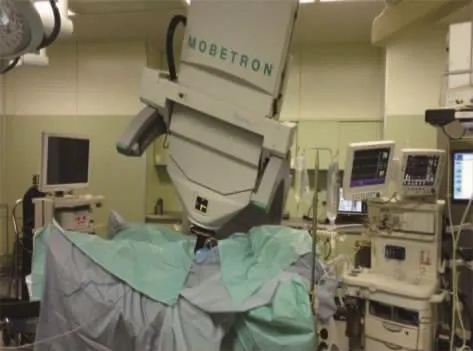
图1 定位完成后行IORT
四、记录和随访
记录住院期间病人的临床基本资料,包括性别、年龄、BMI、肿瘤距肛缘距离、美国麻醉医师协会(ASA)分级等;术中情况,包括手术时间、术中出血量、IORT照射的区域和剂量等;术后病理TNM分期和术后恢复情况(排气时间、进食流质时间、住院时间等)。出院后所有病人按照指南推荐定期随访。
五、统计学分析
采用 SPSS®(IBM®SPSS®Statistics Version22.0)统计软件进行分析。连续变量以平均值±标准差表示。对来自正态分布总体样本的均数检验,采用两独立样本t检验。非正态分布的样本,以中位数表示,并采用非参数检验,具体为Mann-Whitney U检验。率的比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
一、一般情况及术后病理TNM分期
两组病人性别、年龄、BMI、肿块与肛缘距离及术后病理TNM分期见表1。
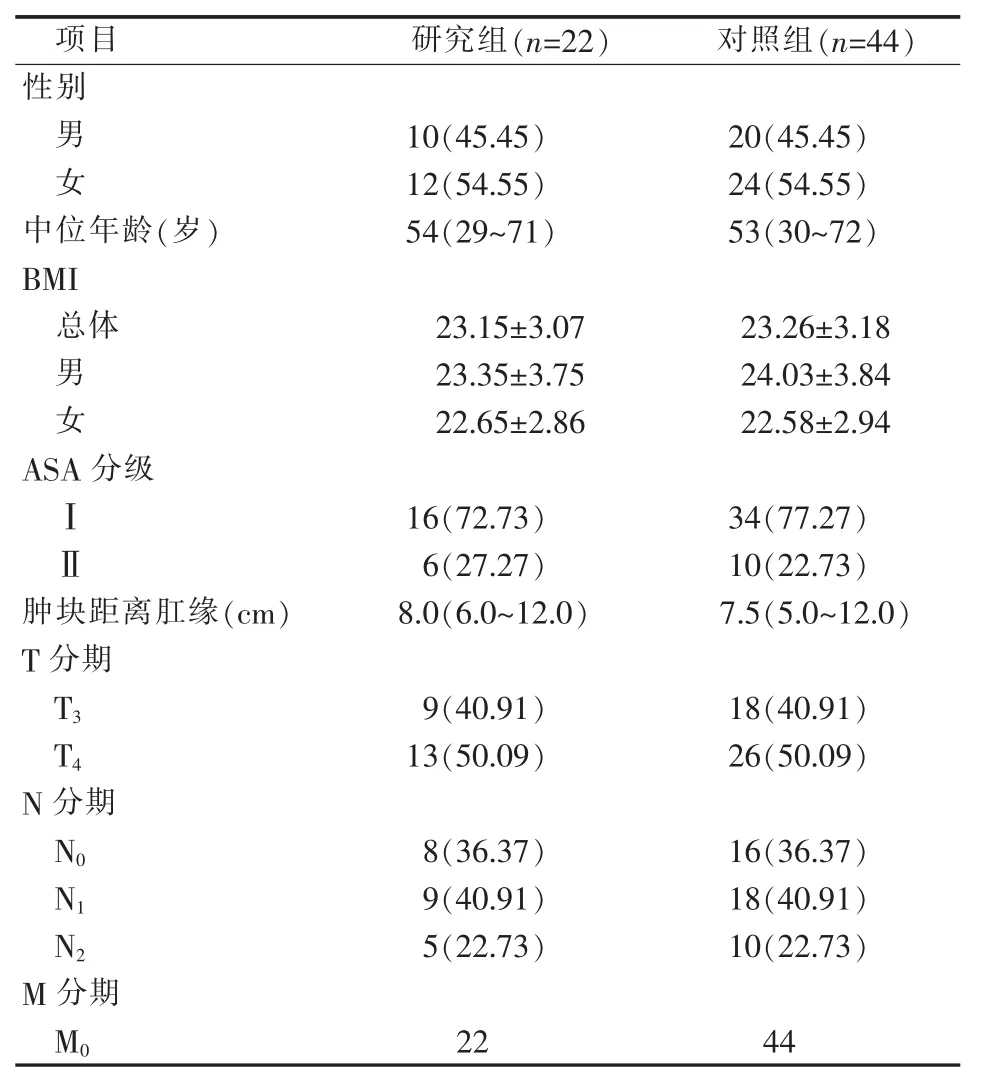
表1 一般情况及术后病理TNM分期[n(%)]
二、术中情况
两组术中出血量、淋巴结清扫数、下切缘长度差异无统计学意义。研究组手术时间明显长于对照组(P=0.024)(见表2)。

表2 术中情况
三、术后恢复情况
两组术后排气、进食流质时间及术后住院时间差异均无统计学意义(见表3)。

表3 术后恢复情况
四、术后30 d内并发症
如表4所示,研究组和对照组术后分别有2例(9.09%)和 4 例(9.09%)吻合口漏,1 例(4.55%)和3 例(6.82%)尿潴留,2 例(9.09%)和 3 例(6.82%)腹泻,2 例(9.09%)和 3 例(6.82%)例盆腔疼痛,1 例(4.55%)和 1 例(2.27%)小肠梗阻。此外,研究组另有1例(4.55%)术后小肠嵌顿疝(小肠粘连至盆腔底形成嵌顿性内疝),对照组无。研究组和对照组术后30 d内近期并发症的总发生率分别为36.36%和31.82%,差异无统计学意义(P<0.05)。

表4 术后并发症情况[n(%)]
研究组2例发生吻合口漏的病人经抗感染、骶前三腔冲洗引流和皮硝外敷等保守治疗成功。对照组4例吻合口漏的病人中有2例行二次手术(腹腔脓肿引流加末端回肠造瘘),余2例保守治疗成功。研究组有1例因小肠嵌顿疝伴绞窄性肠梗阻而行二次手术,两组二次手术发生率均为4.55%。其余近期并发症均保守治疗成功。
五、无局部复发率和总生存率
研究组和对照组分别有2例(9.09%)和3例(6.82%)在术后 1 年内局部复发,4 例(18.18%)和11例(25.00%)在术后3年内局部复发。研究组和对照组1年总生存率分别为100%和97.73%,3年总生存率分别为90.91%和84.09%。两组1、3年无局部复发率和1、3年总生存率差异均无统计学意义(见表5)。
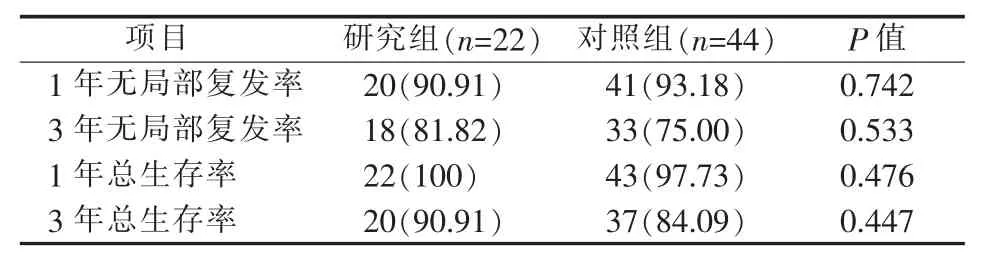
表5 1、3年无局部复发率和1、3年总生存率[n(%)]
讨 论
IORT作为一种特殊的放疗方式,在术中直接对原发肿瘤瘤床、残余肿瘤区域和淋巴引流区域等进行一次近距离的大剂量照射,但会延长手术时间[3]。IORT的应用历史已超过百年,最早应用于妇科肿瘤的治疗。1969年在日本京都首次应用于直肠癌治疗中。然而早期因手术室、仪器操作和消毒技术等限制,手术区域并发症的发生率明显高于单纯手术,高达40%的病人出现感染、腹盆腔脓肿、疼痛等[4],导致IORT未能在临床广泛使用。随着1996年投入商业化生产的Mobetron移动式直线加速器的问世,相关并发症发生明显减少,保障IORT的安全进行。作为放疗并发症密切相关的因素,低于12.5 Gy放疗剂量发生的并发症显著降低[5]。本研究通过观察手术切除后瘤床和标本切缘的冷冻病理活检结果,对肿瘤残余情况有了直观的认识。然后由放疗科医师根据照射靶区计算所需IORT的剂量,进行10~20 Gy照射,保证IORT的安全实施。
IORT的另一些并发症与体外照射治疗类似,主要不良反应包括近期的腹泻、骨髓抑制和远期的消化道反应。早期报道中,IORT后手术并发症发生率普遍较高(约35%),主要并发症是吻合口漏(11%)和切口愈合不良(4%~10%)[6]。其他并发症包括排尿障碍(2%~16%)、胃肠道功能紊乱(14%)以及周围神经炎(8%~19%)[4]。高剂量照射后的组织缺氧是出现此类并发症的主要原因。近年来,随着放疗技术日益精进,相关并发症发生率逐步降低。泌尿系统并发症,包括膀胱功能失调、尿路感染和输尿管狭窄,是较常见的近期并发症,但大多数经保守治疗后均可缓解[7]。Klink等[8]研究显示,入组52例接受IORT的直肠癌病人,仅8%排尿障碍,11%吻合口漏,二次手术率为4%,与单纯手术组相比,差异均无统计学意义。本研究中,研究组接受IORT后吻合口漏发生率为9.09%,二次手术率为4.55%,其他近期并发症发生率与对照组比较,差异均无统计学意义,并在保守对症治疗后均可缓解。结果与既往研究类似。由此可见,随着各项设施的改进和放疗技术的不断精进,IORT导致的手术区域相关并发症已得到控制。
为降低LARC病人的局部复发率,改善整体预后,近年来术前新辅助放疗起重要作用。研究发现,与单纯手术组相比,术前新辅助放疗组的总死亡率、肿瘤相关死亡率和局部复发率均显著降低[9]。然而新辅助放疗同样存在以下缺陷:①放疗疗程长,部分病人不能耐受放疗带来的直肠刺激症状和盆腔疼痛感而无法完成全程放疗;②放疗过程中肿瘤有破溃出血甚至梗阻、穿孔的风险,需急诊手术介入:③放疗后照射区域内组织炎症水肿,大大增加手术难度和术中出血的风险,并对直肠吻合口的愈合带来很大的影响;④无法保证所有病人均能从新辅助放疗中获益,达到肿瘤退缩降期或病理完全缓解的预期目标,甚至有部分病人在治疗过程中出现疾病进展,从而延误手术时机。IORT的相关研究逐渐增多,但由于仪器设备和手术室改造费用昂贵,且LARC治疗仍处于探索阶段,因此缺乏大样本的随机对照研究。
既往研究表明,IORT在降低直肠癌术后局部复发率和提高生存率上较单纯手术有显著优势。Kusters等[10]分析欧洲605例接受综合治疗的LARC病人,发现IORT组手术后的5年无局部复发率为88%,治疗效果与接受术前新辅助放疗的病人相比差异无统计学意义。Dubois等[11]的多中心研究纳入73例接受IORT和69例接受新辅助放疗的LARC病人,发现IORT组与新辅助放疗组比较,总生存时间和无病生存时间的差异无统计学意义。Potemin等[12]对92例接受IORT与80例接受新辅助放疗的LARC病人的研究发现,两组局部无病生存时间和总生存时间的差异均无统计学意义。由此可见,LARC病人合理应用IORT或许可获得与新辅助放疗相似的无局部复发率和生存时间,但仍需更大样本的研究支持。除LARC病人,IORT在其他消化系统恶性肿瘤中的应用也在逐步开展中[13]。在食管癌手术中追加IORT,与单纯手术组相比,术后10年内的局部复发率明显降低,且使术侧肺完全塌陷,可显著减少放射性肺炎的发生率[14]。相比单纯手术治疗,在局部进展期胃癌病人手术中追加IORT,同样可提高术后无局部复发率和总体生存时间[15]。需注意的是,由于胃周围存在胰腺、小肠、胆管等组织,进行IORT时需小心遮挡或避开这些组织,以减少放射性胰腺炎、空肠炎、小肠溃疡穿孔、胆管梗阻等并发症[16]。在局部晚期胰腺癌病人手术中应用IORT,同样可提高术后无局部复发率。虽然无法明显延长生存时间,但可显著缓解腰背疼痛症状,明显改善生活质量[17]。相信在不久的将来,IORT将不仅应用于乳腺癌或消化系统恶性肿瘤的综合治疗中,在各个系统的恶性肿瘤综合治疗的模式中,均可占据一席之地。
本研究表明,LARC病人接受腹腔镜手术联合IORT治疗不增加术中及术后并发症的发生率,是一种安全可行、有效、经济的手段。由于不延长治疗时间,不增加放疗相关并发症,相比体外辅助放疗,IORT更易被病人接受。且因与手术同步进行,外科医师和放疗科医师紧密配合,对于肿瘤可疑残余区域有更直观的认识,对放疗靶区的制定更精确。同时用纱布遮挡或铅布覆盖等保护小肠、神经等正常组织,对术后消化道和神经功能的影响更小。一般18~20 Gy的IORT剂量可达到50 Gy体外放疗剂量1.5~2.5倍的生物学效应。且由于放疗时间缩短,可避免治疗时间过长导致残余肿瘤的生长[18-19]。本研究和一些既往研究发现,与体外辅助照射治疗相比,IORT可使LARC病人获得相似的无局部复发率和总生存率,IORT在LARC的治疗中初见成效[20]。但本研究样本量小,对于IORT的长期临床疗效,仍需大样本临床研究进一步明确。
随着IORT设施和技术的不断改良,根据不同肿瘤分期、手术方式可摸索出更精确的IORT剂量和照射范围,相信安全、合理地开展IORT能为更多LARC病人带来获益,改善整体预后。
