胃癌腹膜转移病人腹腔化疗港并发症发生及危险因素分析
2021-03-05杨中印刘文韬吴珺玮郑亚南朱正伦华子辰倪震天朱正纲
杨中印,李 琛,刘文韬,施 敏,吴珺玮,郑亚南,朱正伦,华子辰,倪震天,陆 晟,燕 敏,严 超,朱正纲
(上海交通大学医学院附属瑞金医院a.外科,上海消化外科研究所,上海市胃肿瘤重点实验室;b.肿瘤内科,上海 200025)
胃癌是世界范围内常见的恶性肿瘤之一,其发生率和死亡率在国内居高不下[1-2]。腹膜转移是胃癌主要的转移途径和致死因素。因此,积极有效地防治胃癌腹膜转移,对进一步改善胃癌病人的预后有着极其重要的临床意义。
腹腔内灌注化疗药物使腹腔内肿瘤细胞直接暴露于高浓度的化疗药物,同时药物的全身毒性较小[3]。多项临床研究显示,通过腹腔化疗港腹腔内序贯性灌注治疗胃癌腹膜转移使病人生存获益,已被广泛接受。但埋置腹腔化疗港会发生一系列相关的并发症[4-6]。目前关于腹腔化疗港在胃癌治疗中的应用及相关并发症的报道非常少。
自2015年起本院外科开展胃癌腹膜转移新辅助腹腔内联合全身化疗(neoadjuvant intraperitoneal and systemic chemotherapy,NIPS)的临床研究[7]。目前,二期临床研究顺利完成。在此基础上开展NIPS治疗的三期多中心临床研究。腹腔灌注化疗通过腹部皮下放置腹腔化疗港,建立给药途径。本研究回顾性分析323例皮下放置腹腔化疗港的病人,从中筛选261例腹腔灌注化疗的胃癌腹膜转移病人进一步分析。其中,59例出现化疗港相关并发症,包括感染、皮下积液、港体倾斜翻转、港体局部切口裂开、导管堵塞和皮下转移。采用1~4级的分级方法定义并发症的严重程度。对化疗港埋置的流程进行优化,探索并发症发生的危险因素,为腹腔化疗港并发症的严重程度分级和处理规范的制定提供支持。
材料和方法
一、一般资料
回顾性分析我院2015年4月至2020年10月323例腹部皮下放置腹腔化疗港的病人。流程图展示筛选过程、排除和纳入的病例数(见图1)。纳入标准:①病理检查结果证实为胃腺癌;②腹膜转移肉眼可见或腹腔镜探查证实腹膜转移;③无胃流出道梗阻和肠梗阻;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分≤2分;⑤实验室检测结果提示耐受手术和化疗,生存期预计≥6个月;⑥腹腔化疗港置入和后续化疗都在我院进行,随访周期≥6个月。排除标准:①病理检查结果为非胃部肿瘤6例;②腹膜转移肉眼不可见、单纯腹腔脱落细胞阳性23例,为预防性腹腔港放置;③自置港后随访时间不足6个月或失访8例。腹膜转移程度用腹膜癌指数(peritoneal carcinomatosis index,PCI)表示[8]。本研究经本院伦理委员会批准通过,所有入组病人均签署知情同意书。
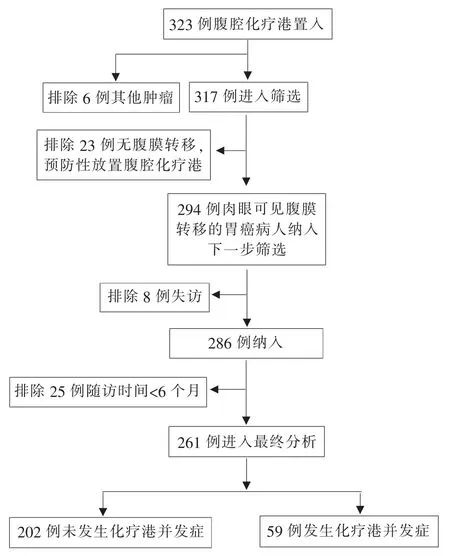
图1 筛选流程图
二、腹腔港放置过程及流程优化
病人在全身麻醉下行腹腔镜探查,对伴腹水者,吸尽腹水并计量。从双侧膈顶往盆腔仔细探查,逐一探查胃原发癌灶、转移淋巴结等。腹腔化疗港(PORT-A-CATH II植入式给药系统,美国史密斯公司)在腹腔镜辅助下放置于右下腹或左下腹皮下(见图2A、B),靠近腹直肌外侧缘,切口应避开腹壁下血管、腹腔内黏连和转移结节(见图 2C)。
腹腔化疗港放置的步骤与前期的报道相似[4],建立皮下腔隙后(见图 2D),置入化疗管和化疗港(见图2E),通常导管置于盆腔底部(见图2J)。在放置步骤优化以前,仅需固定管道进入腱膜的位置(见图2F)。优化步骤中不但固定管道进入腱膜的位置,而且将腹腔外暴露的整个管道用不可吸收线包埋固定于腱膜(见图 2G、H)。化疗港放置、检查通畅后缝合皮肤切口(见图2I)。纳入研究的261例中114例在步骤优化前放置,147例采用优化步骤放置。253例在腹腔镜辅助下放置,仅8例在开腹手术时放置。化疗港放置的专业团队成员拥有开展腹腔港放置和腹腔化疗3年以上经验。
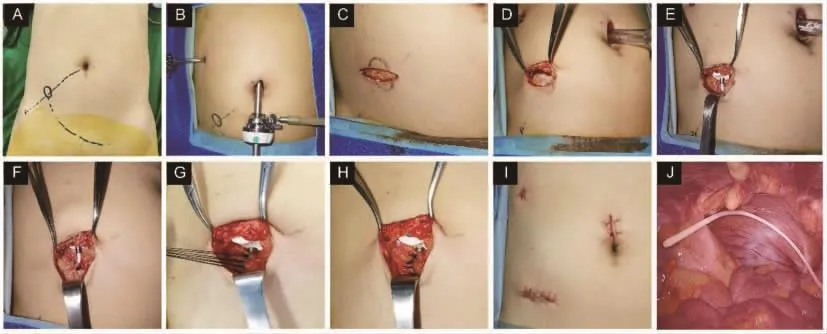
图2 腹腔化疗港放置流程(A~E,J)及优化(G~I)
三、化疗方案
化疗方案由静脉、腹腔应用紫杉醇(paclitaxel,PTX)及口服替吉奥组成[9]。第1天和第 8天经化疗港腹腔内输注PTX,20 mg/m2溶于1 000 mL生理盐水,时间>1 h,同时50 mg/m2经静脉输注PTX。连续14 d按体表面积80 mg/m2口服替吉奥,然后停药7 d。腹腔化疗通过专用穿刺针垂直穿刺入皮下化疗港,建立化疗通道,完成后拔除穿刺针。每3周重复1次,直至化疗方案更改或病人无法耐受。
四、化疗港相关并发症
化疗港出现触痛、红肿、伴波动感,发热、白细胞升高、C反应蛋白升高,可诊断为化疗港感染。化疗港出现旋转、倾斜或翻转导致置针困难。港体局部切口裂开定义为裂开<2 cm,港体未脱出。液体经化疗港无法注射入腹腔,诊断为化疗港导管堵塞。皮下积液可由腹腔内液体反流或炎性渗液引起。化疗港周围皮下出现质硬结节,穿刺细胞学检查为恶性,即皮下转移。
五、并发症分级
根据化疗港并发症的严重程度,参考Clavien-Dindo并发症分级标准,从低到高分为4级[10]。1级为轻微皮下积液(<5 mL)或港体倾斜翻转,不需用药或外科等干预,化疗港可继续应用。2级为少量皮下积液(5~10 mL)、微小的切口裂开(<1 cm)、轻度感染或港体倾斜翻转,用药等保守措施处理后化疗港可继续应用。3级为中等量皮下积液(11~30 mL)、较大的切口裂开(1~2 cm)、中度感染或港体倾斜翻转,通过药物治疗、外科或内镜处理后,化疗港可继续应用。4级为严重的并发症,需立即采取治疗措施,且化疗港无法继续应用,需弃用、取出或重新放置。
六、统计学分析
采用SPSS 26.0统计软件进行分析。卡方检验用于分析化疗港并发症和临床参数的相关性。Logistic回归分析用于并发症OR和95%CI的评估。Mann-Whitney U检验用于并发症分级检验。P<0.05为差异有统计学意义。
结 果
一、腹腔化疗港并发症及分级与临床参数的相关性分析
本研究 323例中,261例纳入分析,59例(22.6%)发生化疗港相关并发症(见表1)。临床参数中,性别、年龄、PCI评分、腹水、化疗史、同时手术、血红蛋白、血糖和置港方式与并发症的发生无显著相关性。ECOG评分、血清白蛋白、置港步骤优化及置港专业团队与并发症发生相关(见表2)。所有化疗港置入和并发症发生的中位间隔时间为3.0个月(见表3)。化疗港感染、化疗港倾斜翻转、港体切口裂开、导管堵塞、皮下积液和皮下转移发生的中位时间分别为 3.3、2.6、1.0、2.0、4.0 和 5.5 个月。皮下积液和化疗港感染是发生较多的并发症,占所有并发症的42.4%和27.1%。根据严重程度将并发症分为4个等级。59例并发症1、2、3和4级分别为21例、12例、7例和19例。在19例4级并发症中,感染占9例(见表1)。进一步行并发症发生分级与临床参数的相关性分析,发现ECOG评分是唯一与分级相关的临床指标(见表4)。
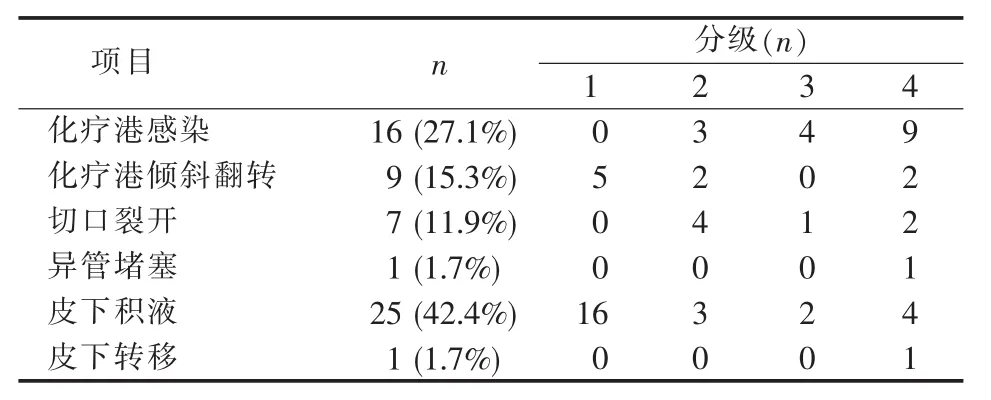
表1 化疗港并发症分布及分级

表2 化疗港并发症与临床参数的相关性(n)

表3 化疗港置入和并发症发生的时间间隔
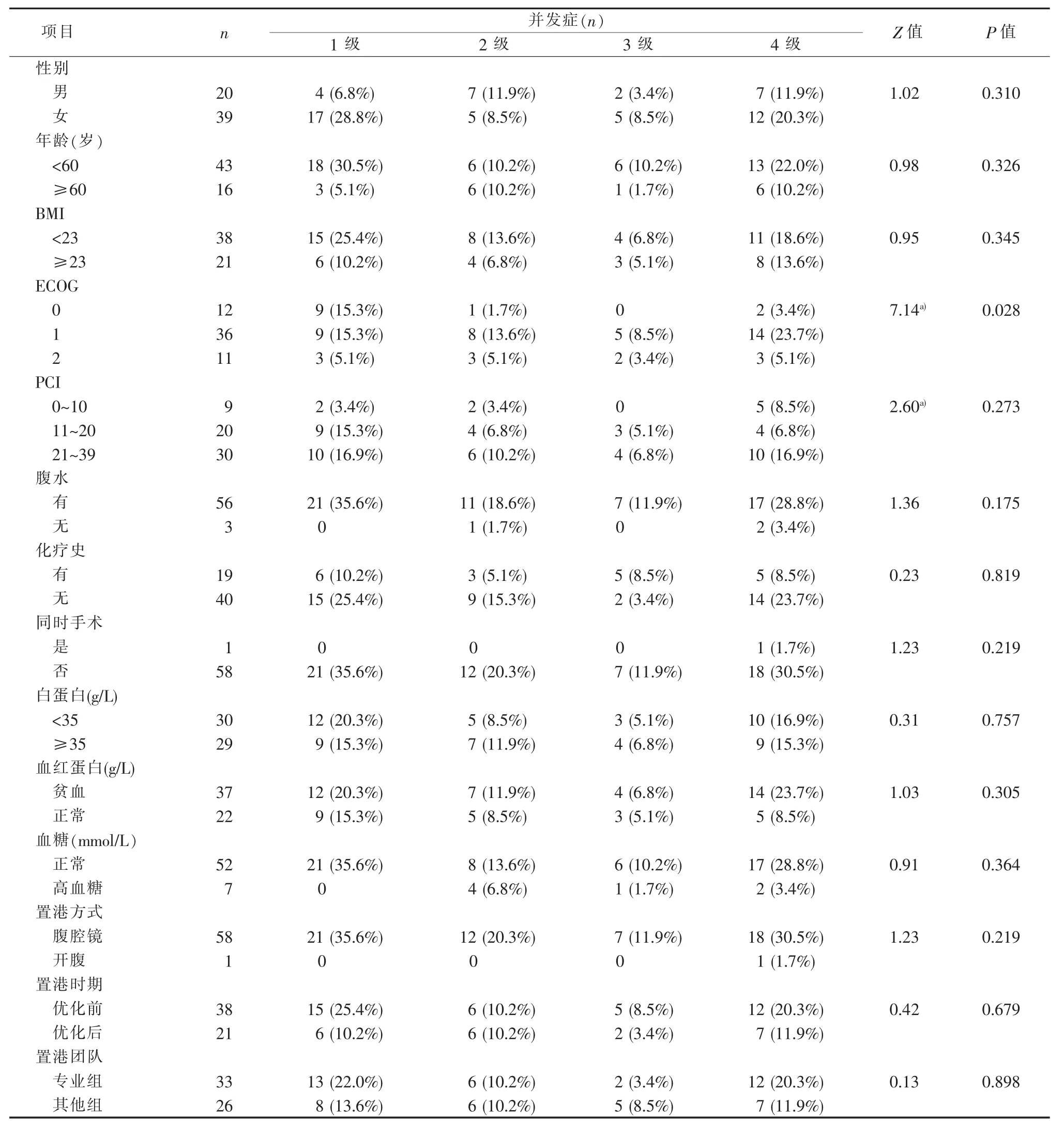
表4 腹腔化疗港并发症分级及与临床参数的相关性
二、并发症发生临床表现
当病人出现感染症状,如化疗港周围红肿或伴有波动感,或血白细胞和C反应蛋白升高,根据外科手术部位感染处理指南[11],给予局部或全身治疗。16例感染病例中,7例感染被控制,化疗港可继续应用。9例化疗港被取出,其中3例更换新化疗港,6例停用腹腔化疗。
化疗港周围皮下积液是最常见的并发症。本研究25例发生皮下积液。大部分病例症状较轻,为1~2级,腹腔化疗前用注射器抽出积液后化疗港可继续应用。4例出现4级并发症,弃用化疗港,停用腹腔化疗。
9例出现港体倾斜翻转。港体位置变动会影响穿刺置针。大部分病例是1~2级并发症,无明显不适,复位后可继续应用。2例港体翻转后无法复位,弃用化疗港,停用腹腔化疗。
7例港体局部切口裂开,其中5例为2~3级并发症。切口裂开范围较小,切口消毒后用灭菌可吸收线再次缝合。裂口逐渐愈合,腹腔化疗得以继续。另外2例为4级并发症,取出化疗港并停用腹腔化疗。
1例发生导管堵塞。应用腹腔化疗2个疗程后,液体无法注射入腹腔内。随后,腹腔镜探查发现,管道滑脱出腹腔,且缠绕在港体周围,导致堵塞。取出化疗港,并对港体周围组织清创缝合。于另一侧重新放置新的化疗港。
1例出现肿瘤皮下转移。化疗港放置5.5个月在港体部位发现1枚质硬结节,细针穿刺细胞学检查诊断肿瘤转移。为避免穿刺引起播散、转移,弃用化疗港而采用全身化疗。
所有59例发生并发症的病人中,18例取出或弃用化疗港,其中4例重新放置化疗港。出现并发症的病人待症状控制后,继续应用腹腔化疗,或改为全身化疗。
三、并发症危险发生因素分析
为了解置港流程优化可避免的并发症,本研究分析优化前、后发生的并发症。结果表明,流程优化后皮下积液发生率显著降低(见表5)。专业组皮下积液发生率也较其他组低(见表6)。
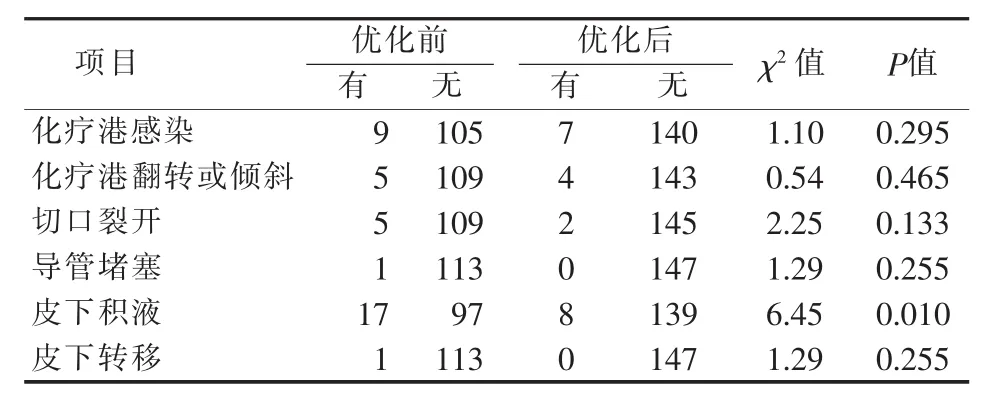
表5 置港流程优化前、后化疗港并发症发生的比较(n)
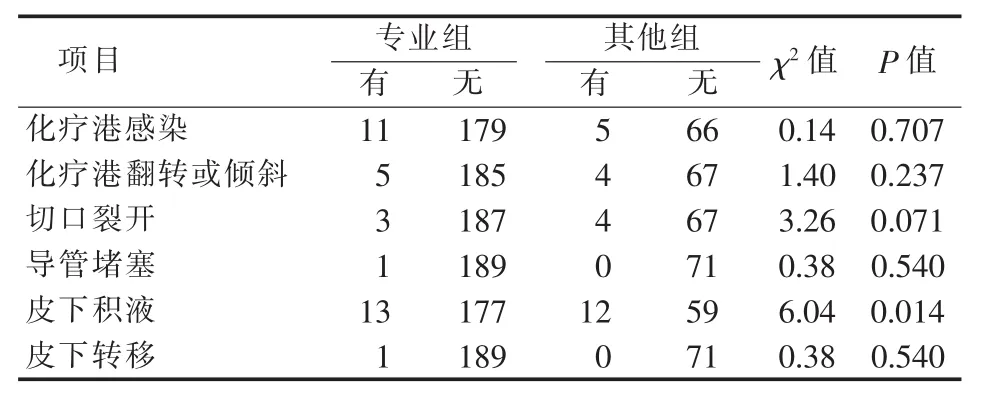
表6 化疗港并发症发生在专业组与其他组比较(n)
本研究采用Logistic回归分析化疗港并发症发生的危险因素。结果显示,ECOG评分(OR=2.19,95%CI:1.42~3.38)、 血清白蛋白水平(OR=0.27,95%CI:0.15 ~0.50)、置港流程优化(OR=0.33,95%CI:0.18~0.61) 以及专业团队放置(OR=0.36,95%CI:0.20~0.67) 为化疗港并发症发生的独立危险因素(见表7)。

表7 Logistic回归分析腹腔化疗港并发症的危险因素
讨 论
腹腔灌注化疗最早应用于卵巢癌切除术后。因此,腹腔化疗港放置相关的并发症在卵巢癌的报道最常见[12-14],而在其他肿瘤的报道较少。近期,Ishigami等对胃癌腹膜转移病人应用腹腔化疗港实施腹腔化疗,使生存获益[9,15-16]。131例接受腹腔化疗的胃癌腹膜转移病人中,24例发生化疗港相关并发症[4]。其中,导管堵塞和化疗港感染是主要的并发症,皮下积液、皮下转移和肠漏也有发生[4]。该研究提示胃癌病人放置腹腔化疗港是安全的,且并发症发生可控。
本研究初步筛选323例腹腔化疗港置入病人,最终261例胃癌腹膜转移病人纳入分析,其中59例发生化疗港相关的并发症。在这些并发症中,皮下积液(42.4%)和化疗港感染(27.1%)是常见的并发症。皮下积液可发生在腹腔化疗的各个阶段,且难以完全避免,但症状相对较轻,对腹腔化疗影响较小。与Ishigami等报道相似,本研究发现并发症的发生与同时性胃切除术并无相关性(见表2)。金黄色葡萄球菌、大肠埃希菌和肺炎克雷伯杆菌是皮肤和上呼吸道常见定植菌属,在部分化疗港感染病人的脓液中被发现。菌群易位、免疫抑制、细菌污染和腹腔积液反流可能是导致感染发生的因素。
前述报道导管堵塞和肠漏为主要发生的并发症[4],但本研究仅1例导管堵塞,无肠漏发生。可能是因为本研究应用柔软和直径较细的化疗管。本研究应用的是大型中心静脉型的化疗港,相比于传统腹腔化疗港,具有以下优势:①具有较大的聚丙烯底座(直径30.5 mm),在脂肪较厚的腹部较易触摸和穿刺。②由于导管质地柔软和直径较细(7.8F),不易肠梗阻。所以,本研究无导管所致肠梗阻病例。③柔软和较细的管道很少引起肠漏和肠穿孔。但较细的管道也有相应的缺点,如易在腹腔内移动,腹水量较少时无法做到充分外引流。
针对腹腔化疗港发生并发症,笔者首次提出对并发症发生进行分级,按严重程度分为1~4级。4级并发症中,化疗港感染比例最高(47.4%),直接导致化疗港取出或弃用。进一步分析发现,ECOG评分是唯一与发生并发症分级相关的危险因素(见表4)。ECOG评分是机体状况可靠的评价指标,评分范围0~5[17]。本研究发现ECOG评分与并发症发生密切相关,且Logistic回归分析提示ECOG评分和血清白蛋白水平是并发症发生的独立危险因素(见表7)。机体状况差的人较易发生化疗港并发症。因此,对于ECOG评分较高的病人需改善机体状况,如经中心静脉营养支持和白蛋白输注。如ECOG评分较高,通过上述处理措施无法快速调整,临床医师需调整治疗策略并采取更合适的全身治疗方案。进一步分析显示,化疗港置入流程的优化可降低并发症发生率;专业组成员有更丰富的置港经验,更注重细节处理,如对于皮下腔隙大小的控制、皮下脂肪厚度的掌握等。值得关注的是,化疗港置入流程的优化和专业组放置对皮下积液并发症发生的减少有重要意义。无论置港流程是否优化,专业组放置化疗港的并发症发生率均较其他组低(见表 8)。

表8 置港团队与化疗港并发症的相关性(n)
本研究是目前国际上最大样本量关于胃癌腹膜转移腹腔化疗港并发症分析的报道,提示腹腔化疗港置入的可行性及相关并发症的可控性。首次明确ECOG评分、血清白蛋白水平、置港流程优化及置港专业团队是化疗港并发症发生的独立危险因素。并提出针对化疗港并发症严重程度的分级方案,明确ECOG评分作为影响并发症分级的相关因素。同时,建议把腹腔化疗港置入的优化流程作为标准进行推广。置港团队成员也要进行相应的临床训练,以便更好地控制并发症发生。
