LRPPRC蛋白与人类恶性肿瘤发生发展的关系
2021-03-04李素芬敏综述伟审校
李素芬,李 彬,余 敏综述,熊 伟审校
0 引 言
三角状五肽重复(pentatricopeptide repeat,PPR)蛋白是一类广泛存在于真核生物中含有35个氨基酸的简单重复基序的RNA结合蛋白质,这类蛋白主要参与基因的转录、转录后加工、RNA稳定性、RNA编辑及翻译过程。富含亮氨酸的五肽重复序列基序蛋白(leucine-rich penticopeptide rich domain containing protein,LRPPRC)在肝癌细胞HepG2中被首次鉴定,该蛋白质的编码基因全长4.8 kb,包含39个外显子。LRPPRC蛋白共1394个氨基酸残基,相对分子质量大小为130 000[1]。研究发现,LRPPRC基因突变导致了法国-加拿大型的Leigh 综合征(Leigh syndrome,French Canadian type,LSFC),这是由LRPPRC表达水平降低和线粒体转录本的稳态水平改变引起的[2]。LSFC是一种线粒体遗传性疾病,患者可出现发育不良、发育迟缓、特有的面部表情和急性症状[3]。此外,LRPPRC在线粒体疾病的早期发作的过程中起潜在作用[4]。最近的研究发现,LRPPRC表达水平与多种人类恶性肿瘤的发生发展密切相关。
LRPPRC蛋白是一种多功能的蛋白质,能够调节能量代谢、参与核编码mRNA的成熟、调控信号转导途径,并参与多种人类疾病的发生发展。研究发现,在各种人类恶性肿瘤中检测到LRPPRC基因的过表达,并且过表达的LRPPRC基因与肿瘤患者的预后不良密切相关。LRPPRC基因沉默可显著抑制肿瘤细胞的生长和侵袭、诱导细胞凋亡、并降低其耐药性。因此,进一步阐明LRPPRC蛋白的功能有助于更好地理解肿瘤的发生发展过程,并为将其作为恶性肿瘤诊疗的潜在生物标记物和分子靶标提供理论基础。
1 LRPPRC蛋白的结构
从植物到哺乳动物的各种生物体中均鉴定出PPR蛋白包含不同数量的PPR基序,其序列特征是串联重复简并的35个氨基酸残基,表明PPR蛋白在进化过程中高度保守。LRPPRC属于人类PPR蛋白质家族的成员之一,其包含大量的PPR基序。PPR蛋白可以与RNA结合,并参与调节转录、RNA加工、剪接、稳定性、编辑和翻译等生物学过程[5-6]。LRPPRC蛋白包含23个PPR-、三四氨基酸重复序列和亨廷顿蛋白延伸的亚单位样串联重复序列。LRPPRC蛋白的N末端序列包含富含亮氨酸的核转运信号,C末端序列包含多个PPR基序,可用于RNA结合以及分泌蛋白1(secretory 1,SEC1)同源结构域的囊泡运输[7]。此外,LRPPRC蛋白包含Epsin N末端同源结构域(epsin nterminal homology,ENTH)和功能未知的DUF28(domain of unknown function,DUF)同源结构域。ENTH可用于胞吞作用、囊泡运输和细胞骨架的组织变化[8]。LRPPRC蛋白的磷酸化位点位于其C末端结构域的1026~1138个氨基酸序列中[9],LRPPRC蛋白与RNA的相互作用可能受丝氨酸或苏氨酸磷酸化作用的调节,见图1。LRPPRC蛋白能和一些参与细胞能量代谢的蛋白质发生相互作用,比如猫眼综合征的染色体候选基因2、血红素结合蛋白2、微管相关蛋白1S(microtubule-associated protein 1S,MAP1s)、过氧化物酶体增殖物激活的受体γ辅激活子1α和叉头蛋白O1[1]。
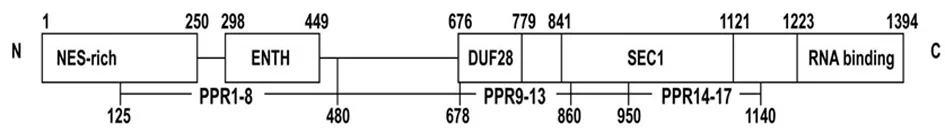
图1 LRPPRC蛋白的结构域Figure 1 The domain of LRPPRC protein
2 LRPPRC蛋白的功能
LRPPRC定位于外核膜、内核膜、核质、内质网、细胞骨架和线粒体,是一种多功能的蛋白质,通过直接或间接的蛋白质-蛋白质相互作用发挥不同的作用[10]。LRPPRC蛋白通过多种机制调节能量代谢、参与核mRNA的成熟和输出以及调控信号转导通路,最终导致恶性肿瘤的发生与发展,见图2。
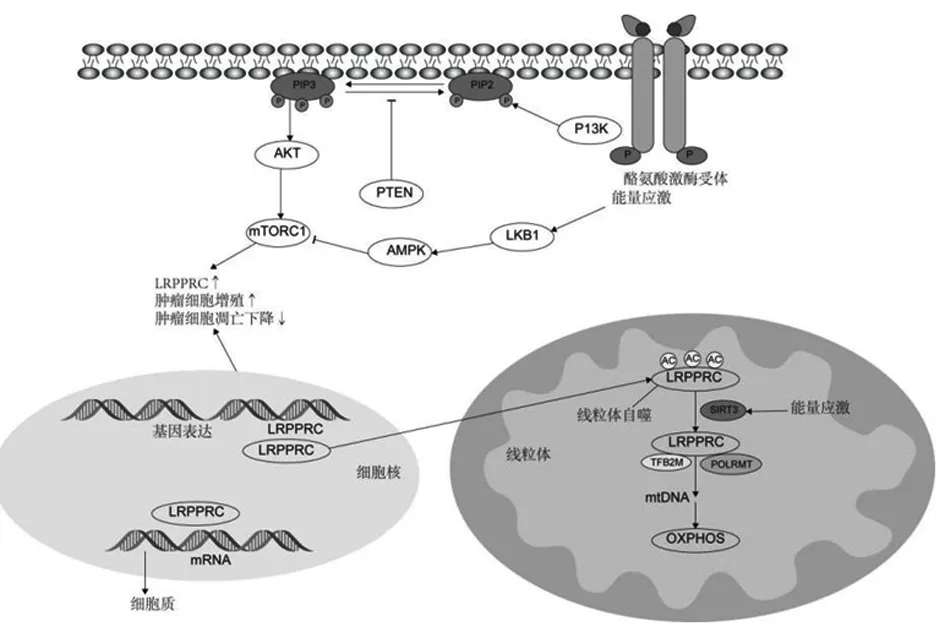
图2 LRPPRC基因过表达与恶性肿瘤发生发展的关系Figure 2 The relationship between LRPPRC gene overexpression and the occurrence and development of malignanttumors
目前研究发现,LRPPRC在调节能量代谢的机制可能与以下几个方面有关。首先,LRPPRC蛋白通过调节人类细胞线粒体DNA编码的mRNA,在能量代谢中发挥特定作用[11]。线粒体靶向序列在哺乳动物细胞中是保守的,可进入线粒体基质,并在进入线粒体基质时裂解[12]。LRPPRC可在线粒体转录和转录后调节线粒体基因的表达[13]。其次,LRPPRC通过RNA识别基序PPR蛋白与一种小的SRA结合蛋白(SLIRP蛋白)形成复合物。LRPPRC-SLIRP复合物与线粒体mRNA结合,通过调节线粒体poly(A)聚合酶的活性来稳定RNA结构,暴露出聚腺苷酸化和翻译所需的位点[14]。LRPPRC还通过调节ATP合酶的活性在能量代谢中发挥作用[15]。在炎症和营养应激条件下,维持能量稳态的能力受损,LRPPRC水平降低诱导线粒体过度融合,功能失调,瞬时补偿复合体IV活性降低,维持哺乳动物细胞中线粒体ATP的产生[16]。最后,线粒体自噬是一种选择性过程,其中受损的线粒体通过自噬降解以维持能量稳态[17]。
研究证实,LRPPRC蛋白可以参与核mRNA的成熟和输出。LRPPRC与异质核糖核蛋白A1相关的poly(A)mRNA结合,并且是参与核mRNA成熟和输出的核mRNPs复合体的一部分[18-19]。真核生物翻译起始因子4E(eukaryotic translation initiation factor 4e,eIF4E),即mRNA 5′帽结合蛋白,在翻译调控中发挥作用,可导致恶性肿瘤的发生。LRPPRC与含有eIF4E敏感性元件(eIF4E-sensitivity element,4E-SE)的mRNA结合,改变了eIF4E的mRNA功能[20]。LRPPRC直接与染色体维持蛋白1结合,并允许eIF4E-LRPPRC-4ESE RNA复合体从细胞核转运到细胞质中。此外,无帽的eIF4E可以提高mRNA输出的效率[21]。因此,LRPPRC可能通过将致癌基因表达与能量产生联系起来,在肿瘤发生中发挥重要作用。
还有研究发现,LRPPRC蛋白还可以调控信号转导通路。PI3K/AKT/mTOR信号传导是一种进化保守的转导通路,这一通路可调节细胞的增殖和生长[22]。mTOR调节线粒体基因的转录和翻译,在线粒体功能中发挥作用[23]。研究证实,PI3K/AKT/mTOR信号传导可能通过调节LRPPRC表达,在氧化磷酸化活性中发挥作用[24]。由于LRPPRC含有磷酸化位点,因此确定mTOR是否通过LRPPRC的直接磷酸化来调节氧化磷酸化活性具有科学意义[9]。另一项研究表明,SIRT3、NAD依赖性脱酰基酶和ADP核糖基转移酶,对线粒体应激反应至关重要[25]。LRPPRC在营养不足的线粒体反应机制中发挥了作用,能量应激导致mTOR复合体1(MTOR complex 1,mTORC1)抑制和LRPPRC的表达降低[26]。LRPPRC的表达降低减少了eIF4E对细胞代谢和生长的影响,并触发自噬以加速功能异常的线粒体的降解,从而保护细胞。线粒体中的LRPPRC被SIRT3脱乙酰化,从而增强LRPPRC与线粒体聚合酶相互作用以表达线粒体DNA,并增加氧化磷酸化活性以应对能量不足。进一步研究和阐明LRPRC蛋白的功能机制可能为癌症治疗提供新的思路。
3 LRPPRC蛋白与人类恶性肿瘤发生发展的关系
研究表明,LRPPRC蛋白在人体正常组织几乎不表达,而在各种恶性肿瘤组织和细胞系中呈现高表达,包括前列腺癌(prostate cancers,PCa)、胃癌、肺腺癌、食管鳞状细胞癌、结肠癌、淋巴瘤、乳腺和子宫内膜腺癌等[27-35]。
3.1LRPPRC与前列腺癌LRPPRC水平与PCa患者的肿瘤分级、肿瘤是否转移和血清前列腺特异性抗原水平(prostate specific antigen,PSA)呈正相关,与无进展生存期和总体生存期呈负相关[1]。LRPPRC若呈现高表达,则前列腺癌患者的Gleason评分高、血清PSA水平升高和转移部位为多发性转移。其中晚期前列腺癌患者LRPPRC的高表达预示着患者前列腺癌恶性程度高和多发性转移[27]。为了验证LRPPRC蛋白在人体良恶性组织中表达量的高低,Jiang等[27]研究使用112例前列腺腺癌和38例良性前列腺增生组织进行分析,前列腺癌LRPPRC的表达水平较良性前列腺增生显著增高。研究下调前列腺癌LRPPRC的表达水平后,可显著抑制前列腺癌细胞的侵袭能力并促进线粒体介导的凋亡[28]。张鸿毅等[29]研究证实,LRPPRC在前列腺癌DU145细胞和LNCaP细胞均高表达,但DU145细胞不表达雄激素受体。敲低DU145细胞LRPPRC水平后,DU145细胞存活率显著降低、ATP水平下降和Bcl2蛋白水平降低,然而细胞的凋亡增加以及活化的caspase-3蛋白水平增高。因此,敲低激素抵抗性前列腺癌DU145细胞LRPPRC可以促进细胞的凋亡。此外,LRPPRC高表达和Bcl-2高表达同时存在的前列腺癌患者无疾病进展生存期和总生存期均显著降低[29-30]。研究表明,LRPPRC可以显著增强比卡鲁胺对LNCaP细胞的增殖抑制作用,从而促进凋亡,增强casepase-3活化水平。因此,抑制激素依赖性前列腺癌细胞LRPPRC表达可以增强对比卡鲁胺的敏感性[31]。还有研究发现,高表达的LRPPRC结合低表达的MAP1s与不良预后显著相关,MAP1s将线粒体与微管连接起来进行运输,并影响自噬体的生物发生和降解,从而增加自噬并抑制肿瘤发生。LRPPRC还可能抑制自噬,以增加前列腺癌的发生[32]。LRPPRC siRNA对LRPPRC的下调通过线粒体介导的途径持续降低PCa细胞的侵袭能力并促进其凋亡[33]。还有研究通过免疫荧光染色在前列腺特异性PTEN基因敲除小鼠的PCa组织中观察到LRPPRC表达水平升高。因此,提高LRPPRC表达水平来确定PTEN/PI3K/AKT/mTOR信号通路的失调是否导致PCa的发生是值得研究的[34]。
3.2LRPPRC与胃癌LRPPRC的高表达与胃癌患者的总体生存率呈负相关,是胃癌的独立预后因素[35]。Gao等[36]研究分析了253例胃癌及其癌旁组织LRPPRC的表达,发现胃癌组织中LRPPRC的表达显著高于癌旁组织,LRPPRC高表达患者总生存率显著低于LRPPRC低表达患者总生存率[37]。此外,LRPPRC siRNA对LRPPRC的下调会抑制胃癌细胞的生长。胃癌组织中线粒体氧化磷酸化和脂肪酸氧化的几种潜在生物标记物也有所增加,因此表明LRPPRC可能通过促进氧化磷酸化和脂肪酸氧化活性在胃癌的进展中发挥作用[36]。结果表明,肿瘤中的LRPPRC取决于特定的肿瘤类型,LRPPRC可以作为诊断和预后的肿瘤标志物。由于正常细胞几乎不表达LRPPRC,因此该蛋白可能成为癌症治疗的潜在分子靶标。有研究表明,LRPPRC在具有多重耐药性(multi-drug resistance,MDR)的胃癌细胞中过表达,LRPPRC的下调显着增强了细胞毒性药物敏感性,转运蛋白P-糖蛋白抑制阿霉素排出体外的能力降低,这与MDR-1转录活性降低有关[38]。
3.3LRPPRC与肺腺癌为了研究LRPPRC与肺腺癌的进展与预后的关系,Fahrmann等[39]从38例肺腺癌患者中获取的组织样本发现,大多数受试者是吸烟的白人女性,平均年龄为70岁。这些受试者被诊断患有IA或IB期腺癌。研究发现,在这38例患者中,有14例(36.8%)为进展期肺癌。蛋白质组学分析发现,在早期(IA/IB期)肺腺癌中可以发现LRPPRC升高,这表明该蛋白的失调可能会引发癌变。结果证实,LRPPRC过表达可导致肺腺癌的进展和预后不良[35,39]。
3.4LRPPRC与结直肠癌Nishio等[40]对结直肠癌的免疫组化分析中发现,结直肠癌组织中LRPPRC 蛋白表达是结直肠正常组织中水平的1.5倍,该研究一方面证实,结直肠癌组织中 LRPPRC的表达水平显著高于正常结直肠组织,其表达水平与肿瘤分化有关,特别是中度分化的结直肠癌组织LRPPRC表达水平更高。另一方面,低分化的结直肠癌患者中LRPPRC的表达水平低于中度分化,然而,在分化较差的结直肠癌患者中,基因组水平的不稳定或其他因素可能会降低其LRPPRC表达水平,进而降低新陈代谢。不涉及线粒体的途径(例如糖酵解)可以调节能量消耗并增强抗凋亡和侵袭的能力。研究证实,LRPPRC蛋白还参与了结直肠癌细胞分化。因此,LRPPRC可被用作结直肠癌诊断和预后的生物标志物,并为结直肠癌的药物研发奠定基础。
3.5LRPPRC与淋巴瘤、白血病研究发现,敲低LRPPRC表达可降低霍奇金淋巴瘤细胞的抗凋亡、侵袭和体外集落形成能力[35]。LRPPRC结合Ral鸟嘌呤核苷酸解离刺激剂(ral guanine nucleotide dissociation stimulator,RALGDS)、LIM和SH3蛋白1(LIM and SH3 protein 1,LASP1)、葡萄糖6磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)、ADRBKI和蛋白酶体亚基α1( proteasome subunit alpha 1,PSMA1),与慢性粒细胞白血病复发风险的增加显着相关。由ATP结合盒亚家族B成员1(ATP-binding cassette sub-family B member 1,ABCB1)基因编码的P糖蛋白充当外排泵,并有助于机体多重耐药。LRPPRC和MDR之间的关系已经在许多肿瘤中进行了研究。蛋白质组学研究结果发现,慢性髓样白血病耐多药/甲磺酸伊马替尼(imatinib mesylate,IM)交叉耐药细胞表达的LRPPRC mRNA和蛋白水平高于其亲代细胞,表明LRPPRC可用作IM耐药的假定因子并可预测其治疗反应[41]。
3.6LRPPRC与肝癌LRPPRC参与细胞体内稳态,激活一些基因的多药耐药性。为了研究其在HepG2和HUH7肝癌细胞中抗细胞凋亡的作用,Michaud等[42]通过研究LRPPRC在HepG2和HUH7肝癌细胞抗凋亡中的作用发现,LRPPRC表达水平降低不足以显着降低肝癌细胞中的P-糖蛋白生成,因此,LRPPRC蛋白表达水平降低后不会影响肝癌细胞排出药物的能力。LRPPRC具有抗凋亡作用,LRPPRC表达水平降低的肝癌细胞中细胞色素C氧化酶活性显着降低,使LRPPRC的抗凋亡作用增强。LRPPRC通过延缓肝癌细胞的凋亡进入细胞保持线粒体的氧化代谢。还有研究发现,LRPPRC在乳腺和子宫内膜腺癌中的表达也升高[35]。此外,在舌鳞状细胞癌中LRPPRC的启动子序列甲基化水平过高[43]。
4 问题与展望
LRPPRC蛋白的功能涉及能量产生和mRNA代谢,与人类恶性肿瘤发生发展密切相关。但是,尚未完全明确LRPPRC在恶性肿瘤中激活的分子机制。LRPPRC调控的信号转导途径也未完全明确,还需要进一步研究。因此,要进一步了解LRPPRC和蛋白质-蛋白质复合物在正常生理和病理生理方向的功能和作用。多项研究表明,LRPPRC在多种类型的恶性肿瘤中表达升高,并与恶性肿瘤的预后不良和耐药性相关[27-43]。LRPPRC的高表达提示肿瘤恶性程度高,增殖能力和抗凋亡能力强,容易出现远处转移。LRPPRC的下调则可诱导细胞凋亡并降低癌细胞的侵袭能力,表明LRPPRC可以作为恶性肿瘤的生物标志物和潜在的分子靶标。LRPPRC的下调是否会导致癌细胞在炎症和营养应激下更易受凋亡诱导剂的影响是未知的。这一问题对深入了解LRPPRC在恶性肿瘤中的病理作用,开发潜在的生物标志物和分子肿瘤治疗方案至关重要。
