可见光对RPE细胞自噬及凋亡的影响*
2021-03-03高园园李武军李娟黄洁俞洋
高园园 李武军 李娟 黄洁 俞洋②
年龄相关性黄斑变性(age-related macular degeneration,AMD)是引起世界上老年人视力不可逆性下降和失明的首要原因[1]。AMD是以视网膜色素上皮层的萎缩和光感受器细胞的坏死为显著特征,可伴有脉络膜新生血管的形成。AMD发病机制中至关重要环节是:RPE细胞极易受到氧化应激的损伤,其功能障碍可导致光感受器变性AMD的主要临床特征是视网膜色素上皮(RPE)和Bruch膜之间存在玻璃疣,随着疾病的进展RPE发生变性[2]。由于RPE的主要功能之一是维持感光器的健康,因此RPE变性继而导致感光器功能障碍引发AMD相关的视力障碍[3]。RPE是位于Bruch膜和光感受细胞器之间的单层色素细胞,起源于视杯的外层,具有抗氧化、参与视循环代谢、分泌生长因子、具有特殊的吞噬功能及滤过作用,RPE的顶端微绒毛与光感受器外段共同构成光传导的场所,是血视网膜屏障的重要组成部分,RPE功能障碍是导致永久性失明的许多遗传性和后天性疾病的基础。
自噬是一种只表现在真核细胞生物的、进化上高度保守的、在溶酶体和自噬囊泡的参与下降解胞质内蛋白或受损细胞器、回收可利用某些氧基酸和蛋白质的过程,对维持RPE内环境稳定特别重要。细胞凋亡在多细胞生物去除不需要的或异常的细胞中起着必要的作用,它在生物体的进化、内环境的稳定及多个系统的发育中起着重要的作用。自噬与细胞凋亡之间关系极其复杂,二者在多细胞生物的发育和体内平衡中起着至关重要的作用。自噬和凋亡可以在同一细胞中同时发生,并可能相互影响。自噬促进凋亡或自噬抑制凋亡,取决于细胞类型,细胞代谢稳态,细胞外营养物质的利用和触发刺激等[4-6]。目前少有光诱导对RPE细胞自噬的影响及RPE细胞在光诱导下自噬与凋亡之间关系的报道,故本研究重点探讨光诱导下的RPE自噬通量的改变及ARPE-19细胞在光损伤中自噬与凋亡之间的关系是如何变化的。
1 资料与方法
1.1 主要试剂及抗体
胎牛血清(以色列Bioind公司);DMEM/F12(以色列Bioind公司);青霉素-链霉素混合液、含或不含EDTA胰蛋白酶(北京Solarbio生物科技有限公司);磷酸盐缓冲液(美国HyClone公司);CCK8检测试剂盒(上海贝博生物科技有限公司);AnnexinV-FITC细胞凋亡检测试剂盒(上海贝博生物科技有限公司);BCA蛋白定量试剂盒、全蛋白提取试剂盒(江苏凯基生物技术股份有限公司);三甲基腺嘌呤(3-Methyladenine,3MA,美国Apexbio,货号A8353);Rapamycin(美国Apexbio,货号A8167);LC3A-Specific Antibody(武汉三鹰生物技术有限公司,货号18722-1-AP);LC3B-Specific Antibody(武汉三鹰生物技术有限公司,货号18725-1-AP);P62/SQSTM1 Antibody(武汉三鹰生物技术有限公司,货号18420-1-AP);Rabbit Anti-Beclin 1 antibody(北京博奥森生物技术有限公司,货号bs-1353R)。
1.2 主要仪器
Multiskan酶标仪(Thermo公司);FACSAriaⅡ型流式细胞检测仪(美国BD公司);TES-1332A数位式照度计(台北泰仕电子工业);H-7650B透射电镜(日立高新技术公司)。
1.3 细胞培养
人视网膜色素上皮细胞(ARPE-19)购于BNCC。ARPE-19放置在37 ℃5%的CO2培养箱中,用已配置新鲜的含10%的胎牛血清及1%双抗的DMEM/F12完全培养基,隔1~2 d换液1次,待细胞成长密度达到80%~90%时,预热的PBS洗涤2次,含或不含EDTA的胰酶消化,显微镜下观察到细胞变为亮的小圆点时且开始漂浮时迅速用完全培养基终止消化,用3 ml巴氏无菌吸管轻轻吹打至细胞悬液,1 200 r/min离心弃上清后,加入新鲜培养基吹打为细胞悬液,1∶3进行传代,取对数生长期3~6代细胞用以试验。将制备好的人RPE单细胞悬液,按1×104个/孔细胞接种于96孔培养板内,每孔100 μl,置37 ℃、5% CO2培养箱内培养12 h,待细胞贴壁后进行试验,所有细胞于分组前经低血清培养基同步化处理。试验分为四组:体外培养的人ARPE-19细胞组(对照组)、体外培养的人ARPE-19细胞+光照射(模型组),体外培养的人ARPE-19细胞+光照前+自噬抑制剂3-MA组(3MA组),体外培养的人ARPE-19细胞+光照前+自噬激动剂Rapamycin组(Rapamycin组)。于光照后设立的3个时间点(依据光照开始至损伤模型形成所历经时段进行划分)给予指标检测。
1.4 构建人RPE细胞光损伤模型
将3~6代人ARPE-19细胞培养于6孔板,光照在培养箱内密闭进行,无自然光干扰。以自制三基色LED冷光灯作为光源,悬挂于培养箱内顶端,采取直落式照射[7-8]。根据前期试验结果,TES-1332A数位式照度计监测光照强度,使被照细胞同一水平光照强度为(16 500±500)Lux,用上述光照器照射细胞12、18、24 h。光照时,细胞平面的温度变化控制在36.5 ℃~37.5 ℃之间,排除温度升高引起细胞光热损伤的可能。
1.5 CCK8法检测细胞存活率
选取试验所需对数生长期细胞,充分消化,接种于96孔板,测算细胞密度约5×103个/孔。换无血清DMEM/F12,培养箱中孵育过夜,使细胞同步化。各组于光照结束后终止培养,每孔加入CCK8溶液10 μl,37 ℃孵育2.5 h。96孔板,每组6个复孔,同时设立空白对照,酶标仪检测450 nm处各孔的OD值。试验重复3次。计算数据绘制细胞存活率图,细胞存活率=(加药细胞OD-空白OD/对照细胞OD-空白OD)×100%。
1.6 流式细胞仪测定细胞凋亡率
取生长状态良好,且处于对数生长期人RPE细胞用于试验。各组细胞于光照处理结束后,收集旧培养液,温PBS洗涤2遍,用0.25%不含EDTA胰酶消化细胞,并将细胞轻轻吹打混匀,制成单细胞悬液,移入相应离心管中,1 200 r/min,低速离心5 min,弃上清;预冷PBS 2 ml洗涤1次,轻轻混匀成单细胞悬液,1 200 r/min,5 min离心后,弃上清,此步骤重复2次;将细胞悬浮于400 μl Annexin-V结合液中,避光加入5 μl FITC,4 ℃放置15 min;上机前5 min避光加10μl PI,在1 h内完成流式细胞仪检测。
1.7 透射电镜观察自噬小体形成
吸除孔板中的培养液,PBS冲洗1~2遍,收集细胞。4 ℃下离心5 min;37 ℃下,2.5%戊二醛混合同等体积的固定剂制成细胞悬液。室温下保持5 min,冰浴30 min;用冰蒸馏水洗涤3次,每次3 min,将细胞用2%双氧铀醋酸染色,4 ℃条件下过夜;梯度乙醇脱水后嵌在Durcupan树脂内。超薄(70 nm)切片,醋酸铀和铅盐染色后用透射电子显微镜进行观察照相。
1.8 Western blot法检测LC3-Ⅱ、LC3-Ⅰ、P62、Beclin1蛋白表达水平
用蛋白裂解液提取各组细胞蛋白,利用BCA蛋白定量测定试剂盒对蛋白进行定量。通过计算机调整后变性,50 μg蛋白上样,经SDS-PAGE电泳后,用PVDF转膜,加入一抗,5%脱脂奶粉封闭2 h,4 ℃封闭过夜,TBST洗涤10 min/次,洗涤3次,加入二抗,37 ℃摇床孵育2 h。暗室中加发光液并进行曝光。X线片显影和定影后利用Image J2x软件分析蛋白条带的灰度值,以β-actin作为内参,对蛋白条带进行相对定量分析,定量分析不同蛋白条带灰度做柱状图。
1.9 统计学处理
本研究数据采用SPSS 21.0或Graphpad Prism 6.0软件进行分析和处理,计量资料以(±s)表示,对数据进行正态分布检验,符合正态分布且方差齐性资料比较采用单因素方差分析(one-factor ANOVA),多个样本均数间的多重比较采用SNK-q法检验;不符合正态分布且方差不齐的资料采用秩转换的非参数检验,显著性水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 透射电镜观察光诱导下ARPE-19细胞凋亡与自噬形态学表征
对照组,正常细胞形态:细胞器形态清晰,线粒体嵴(黑色箭头)清晰可见,内质网(粗白色箭头)尚未扩张,高尔基体(细白色箭头)可见,见图1。3MA组,细胞凋亡形态:细胞体积变小、变形,细胞核内染色质高度盘绕、凝聚、边缘出现许多空泡结构(灰色箭头),该细胞处于细胞凋亡的Ⅰ-Ⅱa期,若是细胞凋亡晚期可见凋亡小体,见图2。模型组细胞形态:透射电镜下可观察到双膜状吞噬小体(细黑色箭头)大量存在且线粒体嵴断裂(粗黑色箭头),内质网肿胀、断裂,可见部分溶酶体(白色箭头),细胞中自噬泡的数量增加,可观察到大量空泡,见图3。Rapamycin组,典型的双膜状自噬小体(黑色箭头),见图4。
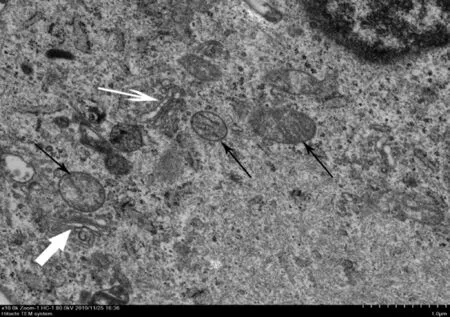
图1 对照组正常细胞形态(×10 000)

图2 3MA组细胞凋亡形态(×3 000)

图3 模型组细胞形态(×5 000)

图4 Rapamycin组细胞形态(×30 000)
2.2 光诱导对各组ARPE-19细胞存活率的影响
对照组细胞存活率接近100%,模型组随着光照时间延长,细胞存活率呈下降趋势(P<0.01);3MA组在12、18、24 h细胞存活率呈下降趋势且低于模型组(P<0.01);Rapaymcin组在12、18、24 h细胞存活率高于模型组(P<0.05),见图5、表1。

图5 ARPE-19细胞接受12、18、24 h光照,不同组别细胞存活率
表1 光诱导各组A-RPR细胞存活率比较 [%,(±s)]

表1 光诱导各组A-RPR细胞存活率比较 [%,(±s)]
*与对照组比较,P<0.01;#与模型组比较,P<0.05。
组别 光照12 h 光照18 h 光照24 h对照组(n=6) 99.99±5.06 99.99±10.05 100.03±1.92模型组(n=6) 63.15±5.99* 56.34±2.78* 48.29±2.89*3MA 组(n=6) 62.75±5.27# 46.27±4.72# 33.64±3.53#Rapamycin组(n=6) 68.66±4.63# 63.82±2.51# 51.99±0.85#F值 68.374 350.30 787.99 P值 <0.05 <0.05 <0.05
2.3 光诱导对各组ARPE-19细胞凋亡率的影响
相同条件下重复3次实验,对照组与模型组比较,在光照12~18 h A-RPE细胞凋亡率呈缓慢上升趋势(P<0.05),在18~24 h A-RPE细胞凋亡率随着光照时间延长而明显升高(P<0.01)。3MA组在12、18、24 h细胞凋亡率均高于模型组(P<0.01)。Rapaymcin组在12、18、24 h细胞凋亡率低于模型组(P<0.05),见图 6、图 7、表 2。

图6 各组18 h细胞凋亡率

图7 各组细胞12、18、24 h凋亡率比较
表2 各组细胞光照12、18、24 h凋亡率比较 [%,(±s)]

表2 各组细胞光照12、18、24 h凋亡率比较 [%,(±s)]
*与对照组比较,P<0.01,#与模型组比较,P<0.05。
组别 光照12 h 光照18 h 光照24 h对照组(n=3) 3.67±0.12 4.87±0.31 5.57±0.12模型组(n=3) 12.47±0.57* 15.23±0.86* 39.40±1.64*3MA 组(n=3) 17.77±1.34# 22.47±3.68# 56.47±3.33#Rapamycin组(n=3) 10.50±0.26# 11.53±0.40# 35.13±1.17#F值 184.48 44.38 354.27 P 值 <0.05 <0.05 <0.05
2.4 光损伤诱导ARPE-19细胞自噬通量的改变
相同条件下重复3次实验,3MA组P62蛋白表达量在12~24 h高于对照组(P<0.05),LC3Ⅱ/LC3Ⅰ及 Beclin1蛋白表达量在12~24 h低于对照组(P<0.05);Rapaymcin组P62蛋白表达量在12~24 h呈下降趋势(P<0.01),LC3Ⅱ/LC3Ⅰ、Beclin1蛋白表达量在12~24 h呈上升趋势(P<0.01);Rapaymcin组P62蛋白表达量在 12~24 h低于模型组(P<0.01),LC3Ⅱ/LC3Ⅰ、Beclin1蛋白表达量在12~24 h均高于模型组(P<0.01)。对照组与模型组比较,LC3Ⅱ/LC3Ⅰ及Beclin1在12~18 h呈上升趋势,18~24 h呈下降趋势(P<0.01);P62在12~18 h呈下降趋势,在18~24 h呈上升趋势(P<0.01),见图 8、图 9、表 3、图 10。

图8 对照组与模型组自噬相关蛋白的表达

图9 Rapaymcin和3MA对光诱导下ARPE-19自噬相关蛋白表达

图10 光损伤诱导各组ARPE-19细胞自噬通量的表达
表3 光损伤诱导各组ARPE-19细胞自噬通量表达的比较 [%,(±s)]

表3 光损伤诱导各组ARPE-19细胞自噬通量表达的比较 [%,(±s)]
组别 P62-12 h P62-18 h P62-24 h LC3Ⅱ/LC3Ⅰ-12 h LC3Ⅱ/LC3Ⅰ-18 h对照组(n=3) 45.95±0.60 46.92±0.70 41.34±14.23 155.42±5.70 155.05±4.67模型组(n=3) 69.86±1.05* 61.44±0.39* 68.17±12.16* 172.99±18.39* 195.57±32.59*3MA 组(n=3) 76.01±1.98# 62.21±5.25# 47.77±0.43# 148.10±0.72# 146.37±2.21#Rapamycin组(n=3) 42.94±12.41△ 38.97±14.10△ 54.03±0.53△ 181.33±0.44△ 197.14±1.00△

表3 (续)
3 讨论
自噬是溶酶体介导的细胞内降解过程[5]。在基础水平下,自噬的发生的主要功能是维持细胞内蛋白质及器官相互周转的平衡。在各种病理生理条件下,自噬活性能够被上调以供应细胞内相对更多的营养物质或能量的需求,满足发育相关的细胞内结构重塑,以及消化细胞内错误折叠蛋白,多余的或损伤的细胞器,以及入侵到细胞内的微生物,它充当代谢应激期间能量产生的替代机制[6]。有研究证明自噬在AMD等衰老性疾病中发挥保护作用[9-11]。自噬是一个分解代谢的过程,在维持RPE细胞的稳态中起着基础作用。当RPE细胞暴露于持续的氧化应激时,自噬可以作为一种细胞保护反应被激活。自噬的损伤可能导致受损细胞器和有毒蛋白质的积累,从而导致RPE细胞功能障碍或死亡[12]。相反,不受控制和过度的自噬激活可促使RPE细胞走向与自噬相关的细胞死亡,自噬在视网膜RPE细胞中是极其活跃的,其功能障碍诱导RPE细胞的凋亡[13]。自噬还有助于清除RPE细胞中的堆积物[14]。视网膜RPE细胞及光感受器细胞中,自噬是被高度激活的,自噬功能的损害可导致RPE细胞早期退化变性[15]。RPE的生理功能将自噬与视网膜衰老性疾病及光损伤导致的视网膜退行性疾病紧密关联。这使得自噬与视网膜疾病的研究热点集中在例如AMD等退行性病变中[16]。
当自噬被诱导时,微管相关蛋白1轻链(LC3Ⅰ)的胞浆形式被转化为膜结合形式的LC3Ⅱ,LC3Ⅰ是游离成熟的而LC3Ⅱ是脂化形式存在的,所以通常认为LC3Ⅱ的增加标志着自噬体的形成。p62蛋白与LC3和泛素化底物结合,随后被吞入完整的自噬体进行降解,这意味着p62降解的增加与自噬激活有关。Beclin 1信号通路作为经典自噬通路之一,正向调控自噬。本研究发现模型组LC3Ⅱ/LC3Ⅰ及Beclin1蛋白水平高于对照组,证明光诱导下ARPE细胞发生自噬;且LC3Ⅱ/LC3Ⅰ及Beclin1在12~18 h呈上升趋势,18~24 h呈下降趋势(P<0.01);P62在12~18 h呈下降趋势,在 18~24 h呈上升趋势(P<0.01),提示模型组在12~18 h自噬增强在18~24 h自噬减弱。加入自噬抑制剂3MA后LC3Ⅱ/LC3Ⅰ、Beclin1及P62蛋白水平在三个时间段比较差异无统计学意义(P>0.05),3MA组P62蛋白表达量在 12~24 h高于对照组(P<0.05),LC3Ⅱ/LC3Ⅰ及 Beclin1蛋白表达量在12~24 h低于对照组(P<0.05),证实3MA抑制ARPE自噬相关蛋白的表达。Rapaymcin组LC3Ⅱ/LC3Ⅰ、Beclin1蛋白水平在12~24 h均高于模型组(P<0.01),P62蛋白水平低于模型组(P<0.01),证实Rapaymcin激活ARPE细胞自噬,同时Rapaymcin组P62蛋白表达量在12~24 h呈下降趋势(P<0.01),LC3Ⅱ/LC3Ⅰ、Beclin1蛋 白 表 达 量 在 12~24 h呈 上 升 趋 势(P<0.01);提示在12~24 h Rapaymcin组ARPE自噬水平与时间呈正相关。
细胞凋亡是多种因素控制的复杂的一种细胞程序性死亡过程[11]。本研究发现模型组12、18、24 h细胞凋亡率高于对照组(P<0.01),证实光照对ARPE细胞的损伤。模型组细胞凋亡率在三个时间段均低于3MA组(P<0.01),均高于Rapaymcin组(P<0.01),同时模型组在光照12~18 h细胞凋亡率呈缓慢上升趋势(P<0.05),在18~24 h细胞凋亡率明显升高(P<0.01),提示在12~18 h细胞RPE细胞通过上调自噬应对光损伤以减少细胞的凋亡率,在18~24 h,自噬降低,损伤加重,自噬的降低可能是细胞耐受性下降,无法靠自身力量应对光损伤而导致细胞凋亡率升高。
本课题组前期试验证明视网膜光化学损伤过程中RPE的改变最先发生,长期接受光照刺激,易遭受氧化应激损伤,导致RPE细胞凋亡。本试验利用PI3K抑制剂(3MA即3-甲基腺嘌呤)与mTOR抑制剂-rapamycin(自噬激动剂)结合Western blot法检测自噬相关蛋白水平,及Annexin V/PI双染色法检测细胞凋亡率发现自噬抑制剂3MA组降低光诱导下RPE自噬相关蛋白的表达,自噬激动剂Rapaymcin组加强光诱导下RPE自噬相关蛋白的表达,同时发现Rapamycin通过上调自噬活性保护RPE应对光损伤。模型组细胞在12~18 h通过提高自噬来应对光损伤,然而在18~24 h,自噬降低,损伤加重,我们推测18~24 h自噬的降低可能是细胞耐受性下降,无法靠自身力量应对光损伤。
综上所述,笔者发现RPE细胞在特定强度光照下,在12~18 h中自噬抑制凋亡,提高细胞生存率,在18~24 h自噬降低,细胞凋亡率升高,但是自噬究竟是从何途径影响凋亡,以及在其他时间段两者之间又是何关系,是接下来要研究的。本文为自噬与AMD疾病的关系及光损伤诱导ARPE细胞自噬与凋亡之间的关系提供了更完整的理解,为自噬可能成为AMD治疗靶点提供了新观点。进一步以自噬为靶点的相关临床试验仍需施行,从而为临床治疗提供指导。
