脑心通胶囊药效成分对人脐静脉内皮细胞JAK/STAT信号通路、血管活性物质、黏附分子、炎症因子的影响
2021-03-02李伟霞王晓艳贾文汇张明亮唐进法李学林
李伟霞 王晓艳 贾文汇 张明亮 唐进法 李学林

摘 要 目的:研究脑心通胶囊主要药效成分对人脐静脉内皮细胞(HUVEC)JAK/STAT信号通路、血管活性物质、黏附分子、炎症因子的影响,以期阐明脑心通胶囊活血化瘀的作用机制。方法:采用CCK-8法检测不同浓度的12个脑心通胶囊药效成分[咖啡酸(1.56~200 μmol/L)、阿魏酸(1.56~200 μg/mL)、洋川芎内酯H(3.125~200 μmol/L)、丁烯基苯酞(3.125~200 μmol/L)、藁本内酯(1.56~200 μmol/L)、隐丹参酮(0.625~80 μmol/L)、丹参素钠(1.56~200 μmol/L)、芍药苷(1.56~200 μmol/L)、芒柄花素(1.56~200 μmol/L)、丹酚酸B(1.56~200 μmol/L)、儿茶素(1.56~200 μmol/L)、黄芪甲苷(1.56~200 μmol/L)]作用24 h后对HUVEC增殖的影响;采用逆转录-聚合酶链式反应(RT-PCR)法检测上述各药效成分(均分别设置3个剂量组,并设0 μmol/L的空白对照组,下同)对HUVEC的JAK/STAT信号通路关键蛋白Janus激酶(JAK2)、信号转导子及转录激活子(STAT3)、蛋白激酶B(Akt)、细胞外调节蛋白激酶(ERK)mRNA表达的影响;采用酶联免疫吸附试验(ELISA)检测各药效成分对HUVEC的纤溶酶原激活物抑制因子1(PAI-1)、血管内皮细胞黏附分子1(VCAM-1)、细胞间黏附分子1(ICAM-1)、血管内皮生长因子(VEGF)、核因子κB p65(NF-κB p65)表达的影响。结果:阿魏酸(6.25、25~200 μg/mL)、洋川芎内酯H(6.25~200 μmol/L)、藁本内酯(200 μmol/L)、隐丹参酮(10~80 μmol/L)、芍药苷(1.56、6.25、12.5 μmol/L)、丹酚酸B(1.56~12.5、200 μmol/L)和儿茶素(25 μmol/L)可显著抑制HUVEC增殖,咖啡酸(1.56、12.5 μmol/L)、藁本内酯(50 μmol/L)、丹参素钠(6.25 μmol/L)、芒柄花素(1.56、100、200 μmol/L)可显著促进HUVEC细胞增殖(P<0.05或P<0.01)。与空白对照组比较,阿魏酸、芒柄花素、丹酚酸B和黄芪甲苷部分剂量组细胞中JAK2、STAT3和Akt的mRNA相对表达量均显著降低(P<0.05或P<0.01);咖啡酸、阿魏酸和丁烯基苯酞部分剂量组细胞中PAI-1表达水平显著降低,咖啡酸、阿魏酸、丁烯基苯酞、隐丹参酮、芒柄花素和儿茶素部分剂量组细胞中ICAM-1和VCAM-1表达水平显著降低,阿魏酸、丁烯基苯酞、芒柄花素、丹酚酸B和黄芪甲苷部分剂量组细胞中NF-κB p65表达水平显著降低,咖啡酸和儿茶素部分剂量组细胞中VEGF表达水平显著升高(P<0.05或P<0.01)。结论:脑心通胶囊中药效成分可能通过抑制HUVEC中JAK/STAT信号通路关键蛋白mRNA和PAI-1、ICAM-1、VCAM-1、NF-κB p65的表达,并促进VEGF表达,从而发挥其活血化瘀的功效。
关键词 脑心通胶囊;人脐静脉内皮细胞;血管活性物质;黏附分子;炎症因子;药效成分;JAK/STAT信号通路;作用机制
中图分类号 R285.5 文獻标志码 A 文章编号 1001-0408(2021)03-0301-08
DOI 10.6039/j.issn.1001-0408.2021.03.09
ABSTRACT OBJECTIVE: To study the effects of the main active components of Naoxintong capsule (NXTC) on the JAK/STAT signal pathway of human umbilical vein endothelial cell (HUVEC) vasoactive substances, adhesion molecules and inflammatory factors so as to clarify the mechanism of NXTC for promoting blood circulation and removing blood stasis. METHODS: The effects of different concentration of 12 active components [caffeic acid (1.56-200 μmol/L), ferulic acid (1.56-200 μmol/L), senkyunolide H (3.125-200 μmol/L), n-butylidenephthalide (3.125-200 μmol/L), ligustilide (1.56-200 μmol/L), cryptotanshinone (0.625-80 μmol/L), tanshinol sodium (1.56-200 μmol/L), paeoniflorin (1.56-200 μmol/L), formononetin (1.56-200 μmol/L), salvianolic acid B (1.56-200 μmol/L), catechin (1.56-200 μmol/L) and astragaloside Ⅳ (1.56-200 μmol/L)] on the proliferation of HUVECs were evaluated by CCK-8 assay. The effects of above active components (3 dose groups, setting up 0 μmol/L blank control group, hereinafter) on mRNA expression of key proteins JAK2, STAT3, Akt, ERK in JAK/STAT signal pathway were measured by RT-PCR. The effects of each active component on the expression of PAI-1, VCAM-1, ICAM-1, VEGF and NF-κB p65 were detected by ELISA. RESULTS: Ferulic acid (6.25,25-200 μg/mL), senkyunolide H (6.25-200 μmol/L), ligustilide (200 μmol/L), cryptotanshinone (10-80 μmol/L), paeoniflorin (1.56, 6.25, 12.5 μmol/L), salvianolic acid B (1.56-12.5 μmol/L, 200 μmol/L) and catechin (25 μmol/L) could significantly inhibit the proliferation of HUVECs; caffeic acid (1.56, 12.5 μmol/L), ligustilide (50 μmol/L), trashinol sodium (6.25 μmol/L) and paeoniflorin (1.56, 100, 200 μmol/L) could significantly promote the proliferation of HUVECs (P<0.05 or P<0.01). Compared with blank control group, mRNA expression of JAK2, STAT3 and Akt were decreased significantly in some dose groups of ferulic acid, formononetin, salvianolic acid B and astragaloside Ⅳ (P<0.05 or P<0.01); the expression of PAI-1 were significantly decreased in some dose groups of caffeic acid, ferulic acid and n-butylphthalide; the expression of ICAM-1 and VCAM-1 were decreased significantly in some dose groups of caffeic acid, ferulic acid, n-butenylphthalide, cryptotanshinone, formononetin and catechin; the expression of NF-κB p65 were decreased significantly in some dose groups of ferulic acid, n-butenylphthalide, formononetin, salvianolic acid B and astragaloside Ⅳ; the expression of VEGF were increased significantly in some dose groups of caffeic acid and catechin (P<0.05 or P<0.01). CONCLUSIONS: The active components of Naoxintong capsule may play the role of promoting blood circulation and removing blood stasis by inhibiting the expression of JAK/STAT signal pathway key protein mRNA and PAI-1, ICAM-1, VCAM-1, NF-κB p65 in HUVEC, and promoting the expression of VEGF.
KEYWORDS Naoxintong capsule; Human umbilical vein endothelial cells; Vasoactive substances; Adhesion molecule; Inflammation factors; Active component; JAK/STAT signal pathway; Mechanism
脑心通胶囊组方是在《医林改错·卷下·瘫痿论》中补阳还五汤的基础上加味虫类药、活血化瘀药共16味中药而成,具有益气活血、化瘀通络的功效[1-2]。相关研究报道,脑心通胶囊主要通过抗动脉粥样硬化、抗炎性反应、抗血小板聚集、改善血管内皮功能和抗心肌缺血再灌注损伤等药理作用发挥治疗心脑血管疾病的作用[1-4]。
Janus激酶/信号转导子及转录激活子(JAK/STAT)信号通路是目前心脑血管疾病分子生物学研究领域的热点[5],其通路相关蛋白JAK2、STAT3、蛋白激酶B(Akt)和细胞外调节蛋白激酶(ERK)与活血化瘀和血管新生的作用关系密切,并参与血管内皮功能的调节[6]。纤溶酶原激活系统是体内防止血栓形成的重要机制,纤溶酶原激活物抑制因子1(PAI-1)是由血管内皮细胞合成和释放的活性物质,在机体内含量越高,形成血栓的可能性也就越高[7];血管内皮生长因子(VEGF)可通过刺激血管内皮细胞增殖、迁移、分化、管腔形成等,促进血管生成[8];内皮细胞黏附分子主要有血管内皮细胞黏附分子1(VCAM-1)和细胞间黏附分子1(ICAM-1),在细胞信号传导与活化、凝血和血栓形成、组织损伤修复等生理和病理过程中发挥重要作用,当机体内黏附分子含量升高,容易形成血栓[9-10];炎症是心脑血管疾病的关键驱动因素,核因子κB(NF-κB)与多种关键炎症因子如细胞因子类[肿瘤坏死因子(TNF-α)、白細胞介素6(IL-6)]、黏附分子类(VCAM-1、ICAM-1)等的表达有关[11-12]。相关研究发现,有机酸类(如咖啡酸、阿魏酸、丹参素钠、丹酚酸B)、苯酞内酯类(如洋川芎内酯H、丁烯基苯酞、藁本内酯)、黄酮类(如隐丹参酮、芒柄花素、儿茶素)和皂苷类(如芍药苷、黄芪甲苷)等是脑心通胶囊的主要药效成分[13-15]。而上述药效成分如何通过调节JAK/STAT信号通路、血管活性物质、黏附分子和炎症因子发挥治疗脑血管疾病药效的物质基础和作用机制尚不清楚。因此,本研究以人脐静脉内皮细胞(HUVEC)为载体,通过考察脑心通胶囊各药效成分对其JAK/STAT信号通路相关蛋白(JAK2、STAT3、Akt、ERK)mRNA、血管活性物质(PAI-1、VEGF)、黏附分子(VCAM-1、ICAM-1)及炎症因子(NF-κB p65)等相关指标的影响,研究该药活血化瘀作用的分子机制,为其临床应用提供数据支撑。
1 材料
1.1 主要仪器
本研究所用的主要仪器有:Light Cycler 96型实时荧光定量聚合酶链式反应(PCR)仪(瑞士Roche公司),VeritiTM 96-Well Thermal Cycler型梯度PCR仪(美国ABI公司),NanoDrop One型超微量分光光度计、3111型CO2恒温培养箱、Multiskan FC型酶标仪、Megafuge 8型离心机(美国Thermo Fisher Scientific公司),AE31型倒置相差显微镜(麦克奥迪实业集团有限公司),S11型电热恒温水浴锅(上海森信实验仪器有限公司)。
1.2 主要药品与试剂
本研究所用的主要药品与试剂有:咖啡酸、阿魏酸、洋川芎内酯H、丁烯基苯酞、藁本内酯对照品(南京良纬生物科技有限公司,批号分别为lw16081501、lw170112004、lw18010302、lw16042702、lw18010501,纯度均不低于98%),隐丹参酮、丹参素钠、芍药苷、芒柄花素、丹酚酸B、儿茶素、黄芪甲苷对照品(成都克洛玛生物科技有限公司,批号分别为CHB190305、CHB180108、CHB190124、CHB180130、CHB180108、CHB180809、CHB190107,纯度均不低于98%),磷酸盐缓冲液(PBS,博斯特生物技术有限公司,批号PYGOO21),二甲基亚砜(DMSO)、青链霉素混合液(北京索莱宝科技有限公司,批号分别为1213C0330、20190320),胎牛血清、胰酶、DMEM高糖完全培养基(美国HyClone公司,批号分别为 NYMI1035、J170003、AL209346),CCK-8试剂[东仁化学科技(上海)有限公司,批号NG703],PAI-1、ICAM-1、VEGF酶联免疫吸附试验(ELISA)试剂盒(上海茁彩生物科技有限公司,批号分别为0711E19、0711E19、0711E19),NF-κB p65、VCAM-1 ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号分别为W5Z6C3RW4T、1BRVZE5H94),RNA快速提取试剂盒、逆转录试剂盒、反转录PCR(RT-PCR)扩增试剂盒(上海奕杉生物科技有限公司,批号分别为20190901、20190901、20190901),PCR引物(华大基因公司设计合成,引物序列及产物长度见表1)。
1.3 细胞
HUVEC由河南中医药大学第一附属医院中药药理实验室惠赠。
2 方法
2.1 细胞培养
将HUVEC复苏后,接种到含10%胎牛血清、1%青链霉素的DMEM高糖完全培养基(以下简称“培养基”),于37 ℃、5% CO2条件下培养,每隔2 d进行传代,取对数生长期细胞进行试验。
2.2 脑心通胶囊各药效成分对细胞增殖的影响
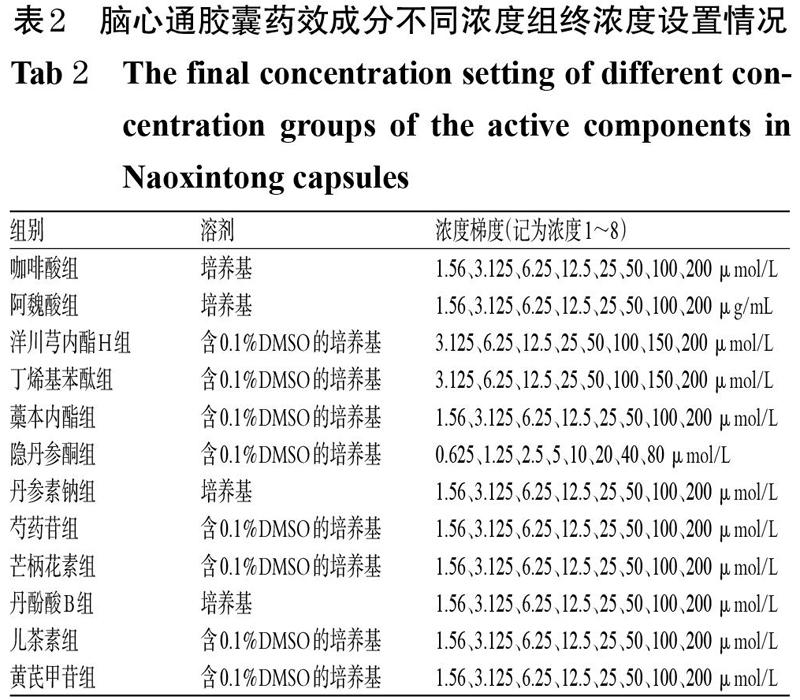
采用CCK-8法进行检测。将HUVEC按3 000个/孔接种于96孔板中,待细胞贴壁后,吸弃培养基,备用。将细胞分为空白对照组(溶剂为含或不含0.1%DMSO的培养基)和脑心通胶囊药效成分不同浓度组[每个药效成分均设置8个终浓度(各浓度设置参考预试验结果,详见表2),按相应对照品溶解性采用含或不含0.1%DMSO的培养基配成]。空白对照组加入含或不含0.1% DMSO的培养基200 μL,脑心通胶囊药效成分不同浓度组加入相应药液200 μL,每组设6个复孔,于37 ℃、5% CO2条件下培养24 h。吸弃培养基后,每孔加入CCK-8溶液60 μL,继续培养1 h后,使用酶标仪于450 nm波长处检测各孔光密度(OD)值,并计算细胞存活率(细胞存活率=OD药效成分组/OD空白对照×100%)。
2.3 脑心通胶囊各药效成分对细胞中JAK/STAT信号通路相关蛋白mRNA表达的影响考察
采用RT-PCR法进行测定。将HUVEC按1×105个/孔接种于6孔板内,待细胞贴壁后,吸弃培养基,备用。将细胞分为空白对照组和脑心通胶囊药效成分不同浓度组(各药效成分终浓度根據“2.2”项下筛选结果制定,按相应对照品溶解性采用含或不含0.1% DMSO的培养基配成相应药液)。空白对照组加入含或不含0.1% DMSO的培养基4 mL,脑心通胶囊药效成分不同浓度组加入含相应药液4 mL,每组设3个复孔,于37 ℃、5% CO2条件下培养24 h。收集细胞并提取总RNA后,取适量逆转录成cDNA。以cDNA为模板,进行PCR扩增。PCR反应体系(20 μL)为:PCR扩增缓冲液10 μL、cDNA 1 μL、上下游引物各0.04 μL和适量双蒸水。反应条件为:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,60 ℃延伸30 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法[16]分析JAK2、STAT3、Akt、ERK mRNA的相对表达量。
2.4 脑心通胶囊各药效成分对血管活性物质、黏附分子及炎性因子表达的影响考察
采用ELISA法进行测定。将HUVEC按3 000个/孔接种于96孔板中,待细胞贴壁后,吸弃培养基,备用。将细胞按“2.3”项下方法分组并培养24 h后,收集细胞上清液,然后按照相应试剂盒的说明书方法操作,检测PAI-1、ICAM-1、VEGF、VCAM-1和NF-κB p65的表达水平。
2.5 统计学分析
采用SPSS 20.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 细胞存活率的测定结果
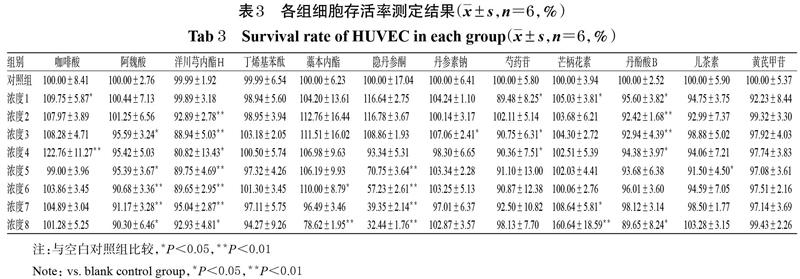
与空白对照组比较,阿魏酸6.25、25、50、100、200 μg/mL组,洋川芎内酯H 6.25、12.5、25、50、100、150、200 μmol/L组,藁本内酯200 μmol/L组,隐丹参酮10、20、40、80 μmol/L,芍药苷1.56、6.25、12.5 μmol/L组,丹酚酸B 1.56、3.125、6.25、12.5、200 μmol/L组,儿茶素25 μmol/L组细胞存活率均显著降低(P<0.05或P<0.01);咖啡酸1.56、12.5 μmol/L组,藁本内酯50 μmol/L组,丹参素钠6.25 μmol/L和芒柄花素1.56、100、200 μmol/L组细胞存活率均显著升高(P<0.05或P<0.01)。各组细胞存活率测定结果见表3。基于此,选择脑心通胶囊各药效成分对HUVEC增殖无明显抑制作用的3个浓度(低、中、高)进行后续试验,即咖啡酸25、50、100 μmol/L,阿魏酸0.025、0.25、2.5 μg/mL,洋川芎内酯H 1.25、2.5、5 μmol/L,丁烯基苯酞0.01、0.1、1 μmol/L,藁本内酯0.025、0.25、2.5 μmol/L,隐丹参酮0.3、1、3 μmol/L,丹参素钠5、10、20 μmol/L,芍药苷25、50、100 μmol/L,芒柄花素2.5、5、25 μmol/L,丹酚酸B 25、50、100 μmol/L,儿茶素5、50、100 μmol/L,黄芪甲苷2.5、5、25 μmol/L。
3.2 脑心通胶囊各药效成分对JAK/STAT信号通路相关蛋白mRNA表达的影响
与空白对照组比较,咖啡酸50 μmol/L组细胞中STAT3,阿魏酸0.025 μg/mL组细胞中JAK2,洋川芎内酯H 2.5 μmol/L组细胞中JAK2及5 μmol/L组Akt,丁烯基苯酞1 μmol/L组细胞中Akt及0.1 μmol/L组ERK,藁本内酯0.025 μmol/L组细胞中JAK2,芒柄花素2.5 μmol/L组细胞中ERK,丹酚酸B 100 μmol/L组细胞中STAT3的mRNA相对表达量均显著升高(P<0.05);阿魏酸2.5 μg/mL组细胞中STAT3、Akt、ERK,芒柄花素25 μmol/L组细胞中JAK2,丹酚酸B 50 μmol/L组细胞中JAK2、STAT3,黄芪甲苷2.5 μmol/L组细胞中Akt 的mRNA相对表达量均显著降低(P<0.05或P<0.01)。各组细胞中JAK/STAT信号通路相关蛋白的mRNA相对表达量测定结果见表4(注:表中0 μg/mL均表示空白对照)。
3.3 脑心通胶囊各药效成分对细胞中PAI-1、ICAM-1、VCAM-1、VEGF和NF-κB p65表达水平的影响
与空白对照组比较,咖啡酸100 ?mol/L组细胞中PAI-1和50、100 ?mol/L组ICAM-1以及25、50、100 ?mol/L组VCAM-1,阿魏酸2.5 ?g/mL组细胞中PAI-1和0.025、0.25、2.5 ?g/mL组ICAM-1、NF-κB p65,洋川芎内酯H 1.25、2.5 ?mol/L组细胞中VEGF,丁烯基苯酞1 ?mol/L组细胞中PAI-1和0.01、0.1、1 ?mol/L组ICAM-1、NF-κB p65以及0.1、1 ?mol/L组VEGF、VCAM-1,隐丹参酮3 ?mol/L组细胞中ICAM-1,芒柄花素25 ?mol/L组细胞中VCAM-1和5 ?mol/L组NF-κB p65,丹酚酸B 25、50、100 ?mol/L组细胞中NF-κB p65,儿茶素100 ?mol/L组细胞中VCAM-1,黄芪甲苷25 ?mol/L组细胞中NF-κB p65的表达水平均显著降低(P<0.05或P<0.01);咖啡酸25、50 ?mol/L组细胞中VEGF,阿魏酸0.025、0.25、2.5 ?g/mL组细胞中VCAM-1,洋川芎内酯H 1.25、2.5、5 ?mol/L组细胞中ICAM-1、NF-κB p65和1.25 ?mol/L组VCAM-1,隐丹参酮3 ?mol/L组细胞中VCAM-1,丹参素钠5 ?mol/L组细胞中PAI,芍药苷25 ?mol/L组细胞中ICAM-1,儿茶素50 ?mol/L组细胞中PAI和5 ?mol/L组ICAM-1、VEGF,黄芪甲苷5 ?mol/L组细胞中VCAM- 1的表达水平均显著升高(P<0.05或P<0.01),详见表5。
4 讨论
血管内皮细胞对维持血管的正常功能以及血管新生有着重要作用,其中HUVEC因具有干细胞的潜能,故常用于医学研究领域[17]。JAK/STAT信号通路是参与细胞信号转导的重要通路之一,其广泛参与细胞的生长、增殖、分化、凋亡及氧化应激等多种生物学过程,同时还介导机体免疫调节、炎症反应及肿瘤生成等过程,该通路中的JAK2、STAT3、ERK和Akt蛋白失调可能导致多种疾病[18-19]。此通路涉及机制较多,随之出现的细胞模型也越来越多,如高糖诱导HUVEC凋亡模型[20]、TNF-α诱导HUVEC损伤模型[21]、NaS2O4诱导HUVEC缺氧损伤模型[22]、氯化钴诱导HUVEC缺氧损伤模型[23]、H2O2诱导HUVEC损伤模型[24]等,但各模型均仅针对心脑血管疾病机制中的一个具体机制,不能完全模拟其发病机制,且对JAK/STAT信号通路影响不一,故本研究采用正常的HUVEC进行试验。有文献报道,阿魏酸在常氧或缺氧状态下均可促进HUVEC的增殖和迁移,其对细胞的调节功能可能与ERK1/2信号通路相关基因表达有关[25];黄芪甲苷促进受损心肌组织血管新生及内皮细胞增殖的作用机制与PI3K/Akt信号通路有关[26]。基于此,本研究结果发现,脑心通胶囊中阿魏酸(2.5 μg/mL)可显著下调细胞中STAT3、Akt、ERK的mRNA表达,丹酚酸B(50 μmol/L)可显著下调细胞中JAK2和STAT3的mRNA表达,芒柄花素(25 μmol/L)和黄芪甲苷(2.5 μmol/L)分别可显著下调细胞中JAK2和Akt的mRNA表达;而部分有效成分如咖啡酸(50 μmol/L)、阿魏酸(0.025 μg/mL)等可显著升高STAT3和JAK2的mRNA表达。
纤溶酶原激活系统是体内防止血栓形成的重要机制,而PAI-1是由血管内皮细胞合成和释放的活性物质,是纤溶酶原激活物的生理性抑制剂[7]。本研究结果显示,脑心通胶囊中的咖啡酸(100 μmol/L)、阿魏酸(2.5 ?g/mL)和丁烯基苯酞(1 ?mol/L)均可显著下调PAI-1的表达,与文献报道一致[27]。VCAM-1可介导单核细胞的黏附作用,对脑梗死患者而言,脱落于血管内皮细胞表面的VCAM-1具有高可溶性,能够促进区域血小板聚集,加速血栓形成;ICAM主要分布于上皮细胞、平滑肌细胞、白细胞、内皮细胞等,其血清含量高表达提示内皮细胞、淋巴细胞、单核细胞黏附作用的增强[28];且ICAM和VCAM的表达水平与冠心病的严重程度相关[29]。本研究结果显示,咖啡酸(50、100 ?mol/L)、丁烯基苯酞(0.1、1 μmol/L)均可显著下调ICAM-1和VCAM-1的表达,阿魏酸(0.025、0.25、2.5 μmol/L)、丁烯基苯酞(0.01 μmol/L)和隐丹参酮(3 μmol/L)均可显著下调ICAM-1的表达,咖啡酸(25 ?mol/L)、芒柄花素(25 μmol/L)、儿茶素(100 μmol/L)均可显著下调VCAM-1的表达。
NF-κB家族中活性较强的是p65和p50蛋白構成的NF-κB异源二聚体,其在细胞内含量最高[11]。本研究结果显示,阿魏酸(0.025、0.25、2.5 ?g/mL)、丁烯基苯酞(0.01、0.1、1 ?mol/L)、芒柄花素(5 ?mol/L)、丹酚酸B(25、50、100 ?mol/L)、黄芪甲苷(25 ?mol/L)可显著下调NF-κB p65的表达。相关文献报道,丹酚酸B可显著降低缺氧造模后H9C2细胞中NF-κB mRNA及蛋白表达水平[30];黄芪甲苷对脂多糖诱导的急性血管内皮损伤具有保护作用,其作用机制可能是通过抑制Toll样受体4(TLR4)/NF-κB信号通路、降低炎症反应有关[31],与本研究结果基本一致。
VEGF与心脑血管疾病组织损伤有密切关系,还可诱导神经营养因子再生、促进钙离子吸收、抑制内皮细胞凋亡等[10]。本研究结果显示,咖啡酸(25、50 μmol/L)和儿茶素(5 μmol/L)均可显著上调VEGF的表达,与文献结果一致[32]。
值得注意的是,由于中药成分具有多靶标、多通路的作用特点,所以不同成分对同一通路或者同一指标并不一定具有相同的调节趋势,且剂量依赖性不强,而是整体发挥作用[33]。例如有文献报道,黄芪甲苷Ⅳ可降低骨髓抑制模型小鼠血清中粒细胞-巨噬细胞集落刺激因子(GM-CSF)水平,而芒柄花素、阿魏酸可显著升高血清中GM-CSF水平[34];4 ?mol/L丹酚酸B可显著升高氧化应激和高糖损伤的HUVEC中TNF-α水平,而20、100 ?mol/L丹酚酸B可显著降低TNF-α水平[35]。此外,本文PCR结果数据采用2-ΔΔCt法进行计算,对Ct值未进行均一化处理,因此本研究各空白对照组间的mRNA表达量具有差异,此现象在部分研究中也存在[36]。
综上所述,脑心通胶囊中12个药效成分可通过抑制JAK-STAT信号通路相关蛋白mRNA、黏附分子相关指标或炎症相关指标的表达,从而促进血管活性物质表达,进而发挥活血化瘀的作用。基于此,本课题组后续将在HUVEC的缺糖缺氧/复氧模型上进一步探索脑心通胶囊治疗血管性疾病的作用机制。
参考文献
[ 1 ] 王阶,赵涛,李军,等.脑心通胶囊治疗冠心病的临床疗效与作用机制[J].中医杂志,2020,61(9):814-817.
[ 2 ] 宋晓征,李成杰,吴雪英.脑心通胶囊对外周血组织炎症反应的作用及其机理[J].中国实验血液学杂志,2019,27(6):1966-1972.
[ 3 ] XUE J,ZHANG XJ,ZHANG C,et al. Protective effect of Naoxintong against cerebral ischemia reperfusion injury in mice[J]. J Ethnopharmacol,2016. DOI:10.1016/j.jep. 2016.02.022.
[ 4 ] 劉振权.脑心通胶囊治疗缺血性中风作用机制的实验研究[D].北京:北京中医药大学,2005.
[ 5 ] GROTE K,LUCHTEFELD M,SCHIEFFER B. JANUS under stress:role of JAK/STAT signaling pathway in vascular diseases[J]. Vascul Pharmacol,2005,43(5):357- 363.
[ 6 ] BARTOLI M,PLATT D,LEMTALSI T,et al. VEGF differentially activates STAT3 in microvascular endothelial cells[J]. FASEB J,2003,17(11):1562-1564.
[ 7 ] 李建会,裴俊文,蒋立峰.黄芪含药血清对血管紧张素Ⅱ诱导内皮细胞分泌Ⅰ型纤溶酶原激活物抑制因子的影响[J].中医学报,2016,31(10):1554-1555.
[ 8 ] CYBULSKY MI,IIYAMA K,LI H,et al. A major role for VCAM-1,but not ICAM-1,in early atherosclerosis[J]. J Clin Invest,2001,107(10):1255-1262.
[ 9 ] NOWACKA M,OBUCHOWICZ E. BDNF and VEGF in the pathogenesis of stress-induced affective diseases:an insight from experimental studies[J]. Pharmacol Rep,2013,65(3):535-546.
[10] DI BATTISTA AP,RHIND SG,HUTCHISON MG,et al. Inflammatory cytokine and chemokine profiles are asso- ciated with patient outcome and the hyperadrenergic state following acute brain injury[J]. J Neuroinflammation,2016. DOI:10.1186/s12974-016-0500-3.
[11] CHAMORRO ?,DIRNAGL U,URRA X,et al. Neuroprotection in acute stroke:targeting excitotoxicity,oxidative and nitrosative stress,and inflammation[J]. Lancet Neurol,2016,15(8):869-881.
[12] LUTGENS E,ATZLER D,D?RING Y,et al. Immunotherapy for cardiovascular disease[J]. Eur Heart J,2019,40(48):3937-3946.
[13] LI J,BAI Y,BAI Y,et al. Pharmacokinetics of caffeic acid,ferulic acid,formononetin,cryptotanshinone,and tanshinone Ⅱ after oral administration of naoxintong capsule in rat by HPLC MS/MS[J]. Evid Based Complement Alternat Med,2017. DOI:10.1155/2017/9057238.
[14] XU HY,SHI Y,ZHANG YQ,et al. Identification of key active constituents of Buchang Naoxintong capsules with therapeutic effects against ischemic stroke by using an integrative pharmacology-based approach[J]. Mol Biosyst,2016,12(1):233-245.
[15] 王铎,盛龙生,宋越,等. HPLC-MS法测定步长脑心通中多种黄芪皂苷类成分[J].中国天然药物,2006,4(4):287-290.
[16] 孔瑕,刘娇娇,李慧,等.黄精多糖对高脂血症小鼠脂代谢相关基因mRNA及蛋白表达的影响[J].中国中药杂志,2018,43(18):3740-3747.
[17] BOU?S D,HOSPERS GA,MEIJER C,et al. Endothelium in vitro:a review of human vascular endothelial cell lines for blood vessel-related research[J]. Angiogenesis,2001,4(2):91-102.
[18] XIN P,XU X,DENG C,et al. The role of JAK/STAT signaling pathway and its inhibitors in diseases[J]. Int Immunopharmacol,2020. DOI:10.1016/j.intimp.2020.106210.
[19] VILLARINO AV,KANNO Y,FERDINAND JR,et al. Mechanisms of JAK/STAT signaling in immunity and di- sease [J]. J Immunol,2015,194(1):21-27.
[20] 王树蓉. [Gly14]-humanin在高糖诱导的人脐静脉内皮细胞凋亡中的作用[D].苏州:苏州大学,2019.
[21] 秦明春,王若光,尤昭玲,等.黄芩苷对TNF-α诱导下人脐静脉血管内皮细胞影响的初步研究[J].时珍国医国药,2014,25(8):2016-2019.
[22] 赵汴霞,马莉,宛蕾.人参皂苷Rd对Na2S2O4致人脐静脉内皮细胞缺氧损伤的保护作用[J].河南职工医学院学报,2012,24(5):580-583、723.
[23] 吴昊,孙昊,王军,等.川芎嗪对人脐静脉内皮细胞株 (Eahy926)氯化钴诱导缺氧后纤溶功能的影响[J].南京医科大学学报(自然科学版),2010,30(5):641-645.
[24] 张继江,刘影哲,周亚滨.黄芪含药血清对H2O2诱导人脐静脉内皮细胞氧化损伤模型细胞活性的影响[J].中医药信息,2011,28(2):19-21.
[25] LIN CM,CHIU JH,WU IH,et al. Ferulic acid augments angiogenesis via VEGF,PDGF and HIF-1α[J]. J Nutr Biochem,2010,21(7):627-633.
[26] 李玉梅,杨辛欣,韩旭,等.川芎嗪与黄芪甲苷配伍对人脐静脉内皮细胞血管生成的作用及机制探讨[J].中草药,2017,48(4):722-727.
[27] 周英,李敏,孙黔云.绿原酸、咖啡酸和阿魏酸对补体旁路激活致内皮细胞炎症相关分子表达的干预[J].中国药理学通报,2016,32(12):1723-1728.
[28] 孙燕辉.丹参川芎嗪注射液对急性脑梗死老年患者血清血管细胞间黏附分子-1、细胞间黏附分子-1、內皮素-1和一氧化氮水平的影响[J].现代中西医结合杂志,2016,25(19):2088-2090.
[29] ZHAO JH,GUAN JL. Signal transduction by focal adhesion kinase in cancer[J]. Cancer Metastasis Rev,2009,28(1/2):35-49.
[30] 李庆菊.丹酚酸B通过抑制NLRP3炎症小体priming阶段减轻缺氧诱导大鼠心肌细胞损伤[J].中国药理学通报,2020,36(2):210-215.
[31] 潘增烽,周园,阮岩,等.儿茶素抑制NF-κB-TSLP通路缓解过敏性哮喘小鼠炎症反应[J].中国药理学通报,2018,34(2):207-212.
[32] 战云,张英杰,冷彬.黄芪甲苷通过TLR4/NF-κB通路改善脂多糖诱导的急性血管内皮损伤[J].中药药理与临床,2018,34(3):77-80.
[33] 王升启.中药作用分子机制研究新策略[J].中国药理学与毒理学杂志,2019,33(9):647.
[34] 徐昊,黄小平,张伟,等.黄芪和当归的主要活性成分配伍对骨髓抑制小鼠造血功能的影响[J].中国药理学通报,2019,35(5):707-713.
[35] 孙成静,曾慧婷,宿树兰,等.丹参茎叶提取物及其主要成分对人脐静脉内皮细胞的保护作用及机制研究[J].中草药,2019,50(14):3357-3367.
[36] DOI T,ISHIKAWA T,OKAYAMA T,et al. The JAK/STAT pathway is involved in the upregulation of PD-L1 expression in pancreatic cancer cell lines[J]. Oncol Rep,2017,37(3):1545-1554.
(收稿日期:2020-06-04 修回日期:2020-10-27)
(编辑:唐晓莲)
