强化剂量与标准剂量霉酚酸类药物用于成年肾移植受者有效性与安全性比较的Meta分析
2021-03-02刘爽王冠儒易湛苗赵荣生
刘爽 王冠儒 易湛苗 赵荣生

摘 要 目的:比較强化剂量与标准剂量霉酚酸类药物用于成年肾移植受者的有效性与安全性,为临床合理用药提供循证参考。方法:计算机检索Embase、PubMed、Cochrane图书馆、Clinical trials.gov、中国知识资源总库、万方数据、中国生物医学文献数据库,检索时限均为各数据库建库起至2020年3月,收集霉酚酸类药物[吗替麦考酚酯(MMF)、麦考酚钠肠溶片(EC-MPS)]强化剂量对比标准剂量用于成年肾移植受者的随机对照试验(RCT)和队列研究;筛选文献、提取资料后,采用Cochrane干预措施系统评价手册(第5版)推荐的偏倚风险评估工具对RCT进行质量评价,采用NOS量表对队列研究进行质量评价;采用Rev Man 5.3软件进行Meta分析,并进行敏感性分析。结果:共纳入8项研究,其中6项为RCT、2项为队列研究,共1 637例患者。Meta分析结果显示,强化剂量组患者经活检证实的急性排斥反应(BPAR)发生率[RR=0.65,95%CI(0.48,0.89),P=0.007]、巨细胞病毒(CMV)感染发生率[RR=0.39,95%CI(0.17,0.91),P=0.03]均显著低于对照组。按药物进行的亚组分析结果显示,MMF强化剂量组[RR=0.72,95%CI(0.53,0.99),P=0.04]、EC-MPS强化剂量组[RR=0.19,95%CI(0.04,0.81),P=0.03]患者的BPAR发生率均显著低于标准剂量组;MMF强化剂量组[RR=0.16,95%CI(0.02,1.33),P=0.09]、EC-MPS强化剂量组[RR=0.51,95%CI(0.20,1.30),P=0.16]患者的CMV感染发生率与标准剂量组比较,差异均无统计学意义(P>0.05)。两组患者排斥反应、治疗失败、移植物丢失、终止治疗、病死、总体不良事件、感染(总体)、BK病毒感染、尿路感染、血液系统不良事件(总体)、白细胞减少、贫血、血小板减少、胃肠道不良事件(总体)、恶心、呕吐、腹泻等发生率比较,差异均无统计学意义(P>0.05)。敏感性分析结果显示,排斥反应、CMV感染、白细胞减少发生率的结果稳定性一般。结论:早期强化剂量霉酚酸类药物用于成年肾移植受者的有效性、安全性与标准剂量总体相当,虽然强化剂量可降低BPAR及CMV感染的发生风险,但结合敏感性分析结果,建议应谨慎解读排斥反应、CMV感染、白细胞减少发生率等结果。
关键词 霉酚酸类药物;吗替麦考酚酯;麦考酚钠;强化剂量;标准剂量;肾移植;Meta分析;有效性;安全性
中图分类号 R979.5 文献标志码 A 文章编号 1001-0408(2021)03-0346-07
DOI 10.6039/j.issn.1001-0408.2021.03.16
ABSTRACT OBJECTIVE: To compare the effectiveness and safety of intensified dose and standard dose of mycophenolic acids (MPA) for kidney transplant recipients, and to provide evidence-based reference for clinical use of drugs. METHODS: Retrieved from Embase, PubMed, Cochrane library, Clinical trials, CNKI, Wanfang database and CBM, randomized controlled trial (RCT) and cohort study about intensified dose and standard dose of clinical commonly used Mycophenotate mofetil (MMF) and Mycophenolate sodium enteric-coated tablet (EC-MPS) for adult kidney transplant recipients were collected during the inception to Mar. 2020. After literature screening and data extraction, the quality of RCTs were evaluated with bias risk evaluation tool recommended by Cochrane Handbook for Systematic Reviews of Interventions (fifth edition). The quality of cohort study was evaluated by NOS scale. Meta-analysis was performed by using Rev Man 5.3 software, and sensitivity analysis was conducted. RESULTS: A total of 8 studies were included, involving 6 RCTs, 2 cohort studies, with 1 637 patients involved. Meta-analysis results showed that, the incidence of biopsy-proven acute rejection (BPAR) [RR=0.65, 95%CI(0.48, 0.89),P=0.007] and cytomegalovirus (CMV) infection [RR=0.39, 95%CI(0.17, 0.91),P=0.03] in intensified dose group were significantly lower than control group. Subgroup analysis by drug showed that the incidence of BPAR in MMF intensive dose group [RR=0.72, 95%CI (0.53, 0.99), P=0.04] and EC-MPS intensive dose group [RR=0.19, 95%CI (0.04, 0.81), P=0.03] was significantly lower than that in standard dose group; there was no statistical significance in the incidence of CMV infection in MMF intensive dose group [RR=0.16, 95%CI (0.02,1.33), P=0.09] and EC-MPS intensive dose group [RR=0.51, 95%CI (0.20,1.30), P=0.16], compared with standard dose group (P>0.05). There was no significant difference in the incidence of rejection, treatment failure, graft loss, termination of treatment, death, overall adverse events, infection (overall), BK virus infection, urinary tract infection, hematological adverse events (overall), leucopenia, anemia, thrombocytopenia, gastrointestinal adverse events (overall), nausea, vomiting or diarrhea between 2 groups (P>0.05). Sensitivity analysis showed that the incidence of rejection, CMV infection and leukopenia were generally stable. CONCLUSIONS: The efficacy and safety of early intensive dose of MPA in adult renal transplant recipients are generally similar to those of standard dose. Although intensive dose can reduce the risk of BPAR and CMV infection, the incidence of rejection, CMV infection and leucopenia should be carefully interpreted according to results of sensitivity analysis.
KEYWORDS Mycophenolic acids; Mycophenolate mofetil; Mycophenolate sodium; Intensified dose; Standard dose; Renal transplant; Meta-analysis
霉酚酸(MPA)是一种抗细胞增殖类免疫抑制剂,在实体器官移植患者中应用广泛,可通过抑制次黄嘌呤单核苷酸脱氢酶的活性来耗竭鸟嘌呤核苷酸,阻断DNA的合成,抑制T、B淋巴细胞增殖,从而发挥免疫抑制作用[1-2]。目前,临床常用的MPA类药物主要包括吗替麦考酚酯(MMF)和麦考酚钠肠溶片(EC-MPS)。有研究表明,1 440 mg/d的EC-MPS与2 g/d的MMF用于实体器官移植受者的有效性与安全性相当[3]。在初始给药剂量方面,MMF药品说明书推荐肾移植受者的日剂量为2 g,并提及每日接受2 g MMF的患者总体安全性优于每日接受3 g的患者,且后者并无明显获益。英国国家卫生与临床优化研究院(NICE)的《成人肾脏移植的免疫抑制指南》(2017版)推荐可用于成年肾移植受者MMF剂量为2 g[4]。但由于MPA类药物的药动学个体差异明显,在使用标准剂量的患者中仅有50%患者的血药浓度可在移植后早期维持在有效治疗窗范围内,且不能有效预防肾移植受者排斥反应的发生[5-6]。
随着MPA类药物在临床应用的增多,初期大剂量给药后再恢复标准剂量的强化治疗方案得以实施,通过早期强化治疗,可使患者体内药物暴露浓度更高,以减少排斥反应的发生,进而提高器官移植受者的器官存活率,但其安全性尚未明确,其原因可能为移植早期过高的药物浓度暴露,可引起胃肠道不良事件、血液系统不良事件以及机会性感染等不良临床结局[7-8]。卢克鹏等[9]研究发现,肾移植术后早期予以强化剂量EC-MPS是安全有效的;但目前尚无关于MMF初始给药方案的循证证据,且不同临床中心对MPA类药物的初始剂量选择尚未统一[10]。基于此,本研究采用Meta分析的方法比较了强化剂量与标准剂量MPA类药物用于成年肾移植受者的有效性和安全性,旨在为临床合理用药提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的随机对照试验(RCT)及队列研究。
1.1.2 研究对象 接受MPA类药物治疗的肾移植受者;年龄≥18岁;患者种族、性别均不限。
1.1.3 干预措施 MPA类药物给药剂量为强化剂量或负荷剂量对比标准剂量。根据NICE指南[4]和药品说明书推荐标准剂量为MMF 2 g/d或EC-MPS 1 440 mg/d。
1.1.4 结局指标 ①排斥反应发生率;②经活检证实的急性排斥反应(BPAR)发生率;③治疗失败率;④移植物丢失发生率;⑤终止治疗率;⑥病死率;⑦总体不良事件发生率;⑧感染总发生率;⑨巨细胞病毒(CMV)感染发生率;⑩BK病毒感染发生率;11尿路感染发生率;12血液系统不良事件总发生率;13白细胞减少发生率;14贫血发生率;15血小板减少发生率;16胃肠道不良事件总发生率;17恶心发生率;18呕吐发生率;19腹泻发生率。其中,①~⑥为有效性指标,⑧~11为感染指标,⑦、12~19为安全性指标。
1.1.5 排除标准 ①会议摘要;②非中英文文献;③无法获得全文的文献;④未描述具体用药剂量的文献;⑤重复发表的文献。
1.2 文献检索策略
计算机检索PubMed、Embase、Cochrane图书馆、Clinical trials.gov、中国知识资源总库、万方数据、中国生物医学文献数据库。中文检索词为“霉酚酸”“吗替麦考酚酯”“麦考酚钠”“骁悉”“米芙”“剂量”;英文检索词为“Mycophenolic acid”“Mycophenolate mofetil”“Mycophenolate sodium”“Cellcept”“Myfortic”“Dose”“Dosage”,限制条件为“Human”。同时,手工检索纳入研究的参考文献,并利用Google等搜索引擎补充检索其他来源的相关文献。检索时限均为各数据库建库起至2020年3月。
1.3 文献筛选与资料提取
由2名研究者按照纳入与排除标准独立筛选文献,首先基于题目、摘要进行筛选,其次阅读全文确定最终纳入的研究,并交叉核对;如遇分歧,则由2名研究者讨论确定是否纳入,必要时咨询第3名研究者(即本文通信作者)。对于数据资料缺失的研究,必要时应与作者通过邮件等形式进行咨询,获得详细信息。提取资料包括第一作者、发表年份、国家、研究类型、患者例数、干预措施、结局指标和随访时间等。
1.4 文献质量评价
采用Cochrane干预措施系统评价手册(第5版)推荐的偏倚风险评估工具对纳入RCT进行质量评价,包括随机序列生成、分配隐藏、盲法實施、数据完整性、报告偏倚和其他偏倚来源,每个条目均分为“低风险”“高风险”“不清楚”[11]。采用Newcastle-Ottawa scale(NOS)量表对队列研究进行质量评价,共包括8个评价条目,其中研究人群选择方面4个条目、组间可比性方面1个条目、结果测量方面3个条目,满分为9分;7~9分为高质量研究,5~6分为中等质量研究,1~4分为低质量研究[12]。
1.5 统计学方法
采用Excel 2016软件建立数据库并进行数据分析与处理,双人录入并交叉校对。当2项或2项以上文献报道了同一种结局指标时,采用Rev Man 5.3软件进行Meta分析。二分类变量采用相对危险度(RR)及其95%置信区间(CI)表示;连续性变量采用均数差(MD)及其95%CI表示。采用Q检验及I 2判断研究间的异质性。若P>0.10或I 2≤50%,表示各研究间无统计学异质性,采用固定效应模型进行分析;反之,则采用随机效应模型进行分析[13]。采用敏感性分析判断结果的稳定性和可靠性;采用倒漏斗图评估发表偏倚(研究数>10时有效)[14]。若各研究间结果存在统计学异质性时,首先排除数据提取错误,并作亚组分析以判断其是否可以解释异质性来源,再结合敏感性分析寻找异质性来源;对于无法定量合并的研究,进行描述性分析。P<0.05为差异有统计学意义。
2 结果
2.1 文献筛选结果
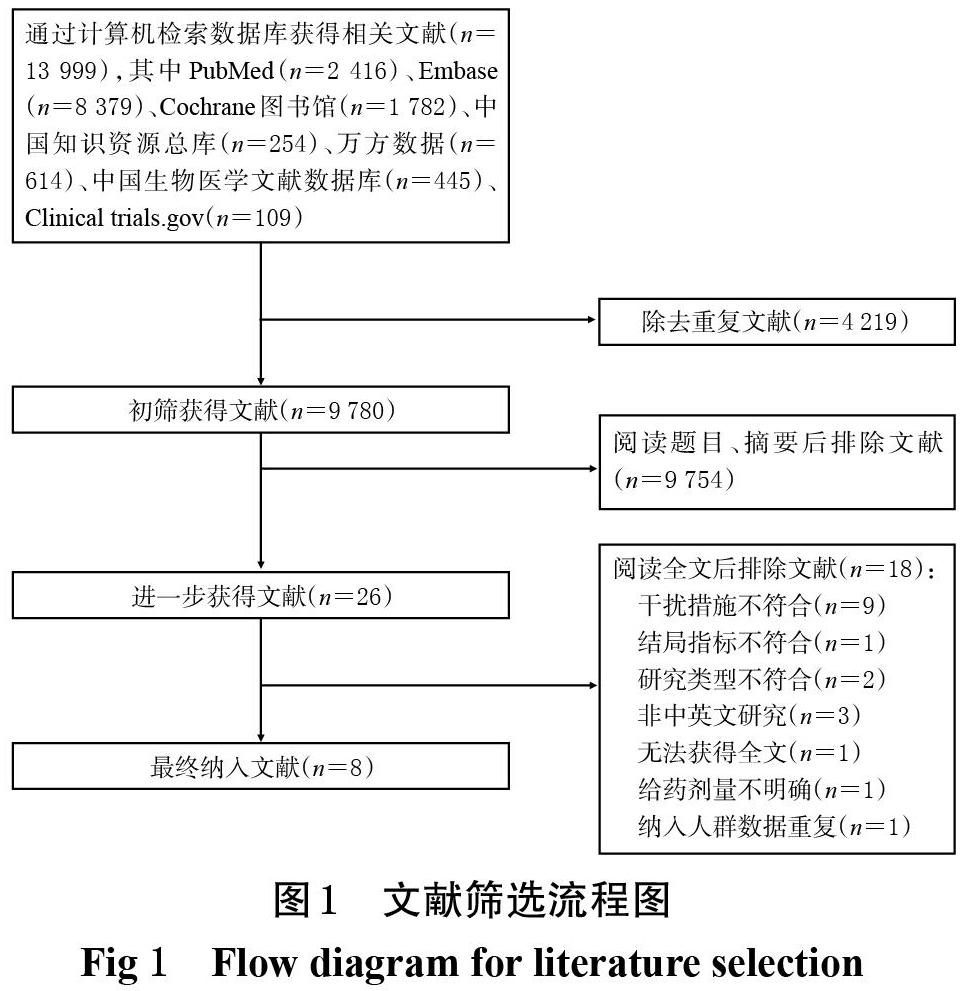
初检共获得相关文献13 999篇,除去重复发表的文献,阅读题目、摘要,进一步阅读全文后,最终纳入8项研究[15-22],文献筛选流程见图1。
2.2 纳入研究基本信息
共纳入了8项研究[15-22],包括6项RCT [15-20]、2项队列研究[21-22],共计1 637例患者,其中强化剂量778例、标准剂量859例。4项RCT [15-17,19]比较了MMF的初始给药剂量,标准剂量为2 g/d,强化剂量为3 g/d。4项研究[18,20-22]比较了EC-MPS的初始给药剂量,其中2项RCT[18,20]标准剂量为1 440 mg/d,强化剂量为2 880 mg/d(第0~14天)、2 160 mg/d(第15~42天);2项队列研究[21-22]關注中国人群的标准剂量为720~1 440 mg/d,强化剂量为720~2 160 mg/d。5项RCT [15-18,20]涉及免疫抑制剂合并用药为环孢素及糖皮质激素,2项研究[19,22]为合并他克莫司及糖皮质激素,1项队列研究[21]为合并环孢素或他克莫司及糖皮质激素,详见表1。
2.3 纳入研究的质量评价结果
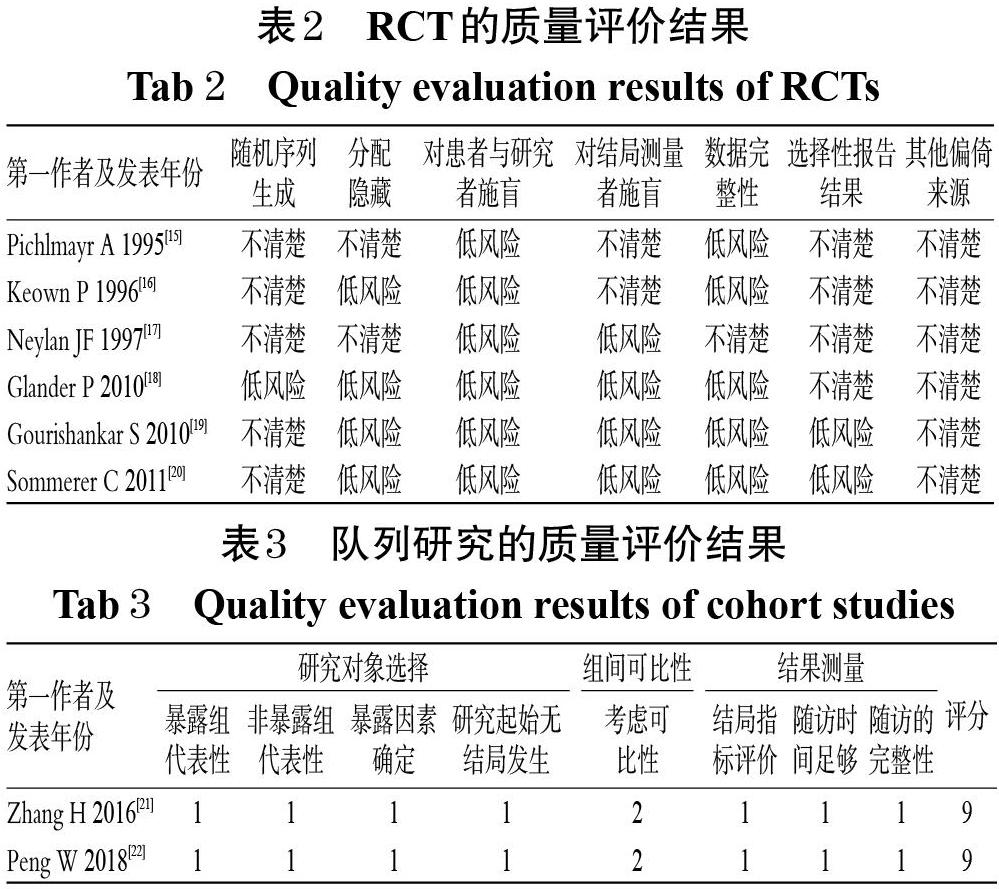
2.3.1 RCT的质量评价 5项研究[15-17,19-20]未描述随机序列的生成;2项研究[15,17]未描述是否进行分配隐藏;6项研究[15-20]均采用双盲设计;5项研究[15-16,18-20]采用意向性治疗原则分析数据且数据完整;所有研究均不清楚是否存在其他偏倚来源,详见表2。
2.3.2 队列研究的质量评价 所有研究[21-22]均充分考虑了纳入人群的选择与队列间的可比性,并报道了纳入人群的随访情况,评分均为9分,均为高质量研究,详见表3。
2.4 Meta分析结果
2.4.1 排斥反应发生率 3项RCT[16-17,19]报道了排斥反应发生率。各研究间无统计学异质性(P=0.21,I 2=37%),采用固定效应模型进行Meta分析,详见图2。Meta分析结果显示,两组患者的排斥反应发生率比较,差异无统计学意义[RR=0.78,95%CI(0.60,1.00),P=0.05]。1项队列研究[21]报道了排斥反应发生率。结果表明,两组患者的排斥反应发生率比较,差异无统计学意义(P>0.05)。
2.4.2 BPAR发生率 4项RCT[15-16,19-20]报道了BPAR发生率。各研究间无统计学异质性(P=0.14,I 2=46%),采用固定效应模型进行Meta分析,详见图3。Meta分析结果显示,强化剂量组患者的BPAR发生率显著低于标准剂量组[RR=0.65,95%CI(0.48,0.89),P=0.007]。1项队列研究[22]报道了BPAR发生率。结果显示,两组患者BPAR发生率比较,差异无统计学意义(P>0.05)。
按药物进行亚组分析。Meta分析结果显示,MMF强化剂量组[RR=0.72,95%CI(0.53,0.99),P=0.04]、EC-MPS强化剂量组[RR=0.19,95%CI(0.04,0.81),P=0.03]患者的BPAR发生率均显著低于标准剂量组,详见图3。
2.4.3 治疗失败发生率 3项RCT[15-16,20]报道了治疗失败发生率。Meta分析结果显示,两组患者的治疗失败发生率比较,差异无统计学意义(P>0.05),详见表4。
2.4.4 移植物丢失发生率 3项RCT[15-16,20]报道了移植物丢失发生率。Meta分析结果显示,两组患者的移植物丢失发生率比较,差异无统计学意义(P>0.05),详见表4。
2.4.5 终止治疗率 2项RCT[16,20]报道了终止治疗率。结果表明,两组患者的终止治疗率比较,差异无统计学意义(P>0.05)。
2.4.6 病死率 3项RCT[15-16,20]报道了病死率。Meta分析结果显示,两组患者的病死率比较,差异无统计学意义(P>0.05),详见表4。
2.4.7 总体不良事件发生率 3项RCT [17-18,20]报道了总体不良事件发生率。各研究间有统计学异质性(P<0.000 01,I 2=95%),采用随机效应模型进行Meta分析,详见图4。Meta分析结果显示,两组患者的总体不良事件发生率比较,差异无统计学意义[RR=1.08,95%CI(0.99,1.18),P=0.07]。1项队列研究[21]报道了总体不良事件发生率。结果表明,两组患者的总体不良事件发生率比较,差异无统计学意义(P>0.05)。
排除数据提取错误,按药物进行亚组分析。EC- MPS组的异质性为0,考虑异质性可能与不同药物有关。结果显示,MMF强化剂量组[RR=2.27,95%CI(0.96,5.38),P=0.06]、EC-MPS强化剂量组[RR=1.00,95%CI(0.97,1.03),P=1.00]患者的总体不良事件发生率与标准剂量组比较,差异均无统计学意义,详见图4。
2.4.8 感染总发生率 4项RCT [15-16,18,20]及2项队列研究[21-22]报道了感染总发生率。Meta分析结果显示,两组患者的感染总发生率比较,差异无统计学意义(P>0.05),详见表5。
2.4.9 CMV感染发生率 3项RCT [18-20]报道了CMV感染发生率。各研究间无统计学异质性(P=0.43,I 2=0),采用固定效应模型进行Meta分析,详见图5。Meta分析结果显示,强化剂量组患者的CMV感染发生率显著低于标准剂量组[RR=0.39,95%CI(0.17,0.91),P=0.03]。
按药物进行亚组分析。Meta分析结果显示,MMF强化剂量组[RR=0.16,95%CI(0.02,1.33),P=0.09]、EC-MPS强化剂量组[RR=0.51,95%CI(0.20,1.30),P=0.16]患者的CMV感染发生率与标准剂量组比较,差异均无统计学意义(P>0.05),详见图5。
2.4.10 BK病毒发生率 2项RCT[18,20]报道了BK病毒发生率。Meta分析结果显示,两组患者的BK病毒发生率比较,差异无统计学意义(P>0.05),详见表5。
2.4.11 尿路感染发生率 2项RCT[19-20]报道了尿路感染发生率。Meta分析结果显示,两组患者的尿路感染发生率比较,差异无统计学意义(P>0.05),详见表5。
2.4.12 血液系统不良事件总发生率 3项RCT[15,18,20]报道了血液系统不良事件总发生率。Meta分析结果显示,两组患者的血液系统不良事件总发生率比较,差异无统计学意义(P>0.05),详见表6。
2.4.13 白细胞减少发生率 5项RCT[15-16,18-20]和1项队列研究[22]报道了白细胞减少发生率。Meta分析结果显示,两组患者的白细胞减少发生率比较,差异无统计学意义(P>0.05),详见表6。
2.4.14 贫血发生率 5项RCT[15-16,18-20]和1项队列研究[22]报道了贫血发生率。Meta分析结果显示,两组患者的贫血发生率比较,差异无统计学意义(P>0.05),详见表6。
2.4.15 血小板减少发生率 5项RCT[15-16,18-20]报道了血小板减少发生率。Meta分析结果显示,两组患者的血小板减少发生率比较,差异无统计学意义(P>0.05),详见表6。
2.4.16 胃肠道不良事件总发生率 3项RCT[15,18,20]报道了胃肠道不良事件总发生率。Meta分析结果显示,两组患者的胃肠道不良事件总发生率比较,差异无统计学意义(P>0.05),详见表6。
2.4.17 恶心发生率 5项RCT[15-16,18-20]报道了恶心发生率。Meta分析结果显示,两组患者的恶心发生率比较,差异无统计学意义(P>0.05),详见表6。
2.4.18 呕吐发生率 5项RCT[15-16,18-20]报道了呕吐发生率。Meta分析结果显示,两组患者的呕吐发生率比较,差异无统计学意义(P>0.05),详见表6。
2.4.19 腹泻发生率 5项RCT[15-16,18-20]和2项队列研究[21-22]报道了腹泻发生率。Meta分析结果显示,两组患者的腹泻发生率比较,差异无统计学意义(P>0.05),详见表6。
2.5 敏感性分析
对纳入Meta分析的所有指标进行敏感性分析,逐一剔除纳入的文献后,结果显示,大部分指标的Meta分析合并效应量保持稳定,未发生显著改变,结果可靠性较好;但以排斥反应、CMV感染和白细胞减少发生率为指标进行敏感性分析时,Meta分析合并效应量与剔除前比较,发生显著改变,提示这3个指标所得Meta分析结果可靠性一般。
3 讨论
肾移植是目前治疗终末期肾病的最佳方式,为预防术后排斥反应,肾移植术后受者需长期接受多种免疫抑制剂治疗,由于长期使用钙神经蛋白抑制剂(CNI,包括他克莫司和环孢素)引起慢性肾毒性等不良反应,故临床常使用MPA类药物以减少CNI用量,从而降低CNI的毒性,常用的肾移植免疫维持方案为由CNI联合MPA类药物、糖皮质激素组成的“三联免疫抑制方案”[23-26]。
一般早期足量的MPA类药物有利于预防BPAR的发生[27],在强化剂量与标准剂量MPA的药动学比较中,Gourishankar等[19]的研究表明,与MMF标准剂量(2 g/d)相比,使用强化剂量(3 g/d,5 d)的患者在移植后第3天和第5天时,其体内平均血药浓度曲线下面积(AUC)水平显著增加;使用强化剂量者移植后第3天和第10天的药物浓度显著高于标准剂量者(52.9% vs. 22.2%,P<0.05)。可见,早期给予足量MPA类药物可达到更高的浓度暴露。但由于MPA类药物的暴露浓度在个体间及个体内均存在显著差异,不同患者间体内MPA类药物暴露可相差10倍[28],因此具体的给药剂量需根据移植受者的性别、体质量、外周血白细胞计数及其对药物的耐受情况而定[29-30]。目前,尚无关于MPA剂量调整的指南推荐。2010年霉酚酸治疗药物监测罗马共识建议,应监测实体器官移植患者体内MPA类药物的血药浓度,以指导移植术后的个体化用药[31]。《器官移植免疫抑制剂临床应用技术规范(2019版)》指出,在维持治疗阶段,应根据移植受者的临床表现或MPA类药物的AUC调整剂量[32]。目前,MPA类药物给药剂量与体内浓度暴露的相关性尚存在争议,仍有很多移植中心尚未常规开展MPA类药物治疗药物监测,而是基于临床经验调整MPA类药物给药剂量,剂量过高可引起骨髓抑制等不良事件,剂量过低则会导致BPAR的发生[33]。对于MPA类药物初始给药剂量,有研究针对不同种族人群接受不同剂量MPA类药物的情况进行统计,使用3 g/d的MMF类药物可有助于预防非裔美国(AA)患者的BPAR,而2 g/d则可为非AA患者提供更好的获益/风险比[16]。此外,针对亚洲人群的研究表明,其MPA类药物总体耐受性低于高加索人群;在临床实际应用中,推荐适当降低MPA类药物初始给药剂量[34]。
本研究结果显示,与标准剂量比较,强化剂量MPA类药物可显著降低BPAR的发生风险;但在排斥反应、治疗失败、移植物丢失、终止治疗、死亡发生风险等方面,差异均无统计学意义;强化剂量MPA类药物可显著降低CMV感染的发生风险,但敏感性分析结果显示,此结论的稳定性一般;在总体不良事件、感染(BK病毒感染、尿路感染)、血液系统不良事件(贫血、白细胞减少、血小板减少)、胃肠道不良事件(腹泻、恶心、呕吐)发生风险方面,强化剂量与标准剂量比较差异均无统计学意义,且敏感性分析结果也显示,除白细胞减少外的其余结论的稳定性较好。EC-MPS的分子结构中以钠盐替代了MMF的酯基团,故降低了消化道的不良反应[35]。但本研究中,MMF与EC-MPS兩种药物的亚组分析结果显示,强化剂量与标准剂量患者消化道不良反应发生率比较,差异均无统计学意义。
综上所述,早期强化剂量MPA类药物用于成年肾移植受者的有效性、安全性与标准剂量总体相当;虽然,强化剂量可降低BPAR及CMV感染的发生风险,但结合敏感性分析结果,建议应谨慎解读排斥反应、CMV感染、白细胞减少发生率等结果。本研究的局限性有:(1)各研究中强化剂量的定义不尽相同,可能与不同种族及不同移植中心给药习惯等不同有关;(2)各研究间不良反应统计类型不尽相同,定义标准不一,如血液系统不良事件、不同类型的感染等,受纳入数据限制,无法定量合并;(3)虽然已在数据库中搜索了会议论文等灰色文献,但仍未能找到可纳入的相关研究;(4)由于本研究纳入原始研究数目小于10项,故未进行发表偏倚分析,故此结论有待更多大样本、多中心、高质量的研究进一步验证。
参考文献
[ 1 ] 陈岚,丁莹,黄凯,等.肾移植患者术后优化应用麦考酚酸的临床研究进展[J].中国新药杂志,2017,26(2):187- 192.
[ 2 ] 曹懿睿,贾亦臣.霉酚酸类药物在器官移植受者中的药代动力学研究进展[J].器官移植,2020,11(5):635-645.
[ 3 ] CATTANEO D,CORTINOVIS M,BALDELLI S,et al. Pharmacokinetics of mycophenolate sodium and comparison with the mofetil formulation in stable kidney transplant recipients[J]. Clin J Am Soc Nephrol,2007,2(6):1147-1155.
[ 4 ] National Institute for Health and Care Excellence(NICE).Immunosuppressive therapy for kidney transplant in adults [EB/OL].(2017-10-11)[2020-08-15]. http://www.nice.org.uk/guidance/TA481/chapter/1-Recommendations.
[ 5 ] GELDER TV,SILVA HT,FIJTER JW,et al. Renal transplant patients at high risk of acute rejection benefit from adequate exposure to mycophenolic acid[J]. Transplantation,2010,89(5):595-599.
[ 6 ] COSSART AR,COTTRELL WN,CAMPBELL SB,et al.Characterizing the pharmacokinetics and pharmacodyna- mics of immunosuppressant medicines and patient outcomes in elderly renal transplant patients[J]. Transl Androl Urol,2019,8(Suppl 2):S198-S213.
[ 7 ] BUNNAPRADIST S,AMB?HL PM. Impact of gastrointestinal-related side effects on mycophenolate mofetil dosing and potential therapeutic strategies[J]. Clin Transplant,2008,22(6):815-821.
[ 8 ] KIBERD BA,LAWEN J,DALEY C. Limits to intensified mycophenolate mofetil dosing in kidney transplantation[J]. Ther Drug Monit,2012,34(6):736-738.
[ 9 ] 盧克鹏,孟亚磊,王明乐,等.强化剂量与标准剂量的麦考酚钠肠溶片用于肾移植术后免疫抑制治疗中有效性与安全性的Meta分析[J].中国医院药学杂志,2018,38(17):1828-1832、1836.
[10] BENTATA Y. Mycophenolates:the latest modern and potent immunosuppressive drugs in adult kidney transplantation:what we should know about them[J]. Artif Organs,2020,44(6):561-576.
[11] HIGGINS JP,ALTMAN DG,G?TZSCHE PC,et al. The Cochrane collaborations tool for assessing risk of bias in randomised trials[J]. BMJ,2011. DOI:10.1136/bmj.d5928.
[12] STANG A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. Eur J Epidemiol,2010,25(9):603-605.
[13] SEDGWICK P. Meta-analyses:what is heterogeneity[J].BMJ,2015. DOI:10.1136/bmj.h1435.
[14] SEDGWICK P,MARSTON L. How to read a funnel plot in a meta-analysis[J]. BMJ,2015. DOI:10.1136/bmj.h4718.
[15] PICHLMAYR A. Placebo-controlled study of mycophenolate mofetil combined with cyclosporin and corticosteroids for prevention of acute rejection:European mycophenolate mofetil cooperative study group[J]. Lancet,1995,345(8961):1321-1325.
[16] KEOWN P. A blinded,randomized clinical trial of mycophenolate mofetil for the prevention of acute rejection in cadaveric renal transplantation[J]. Transplantation,1996,61(7):1029-1037.
[17] NEYLAN JF. Immunosuppressive therapy in high-risk transplant patients:dose-dependent efficacy of mycophenolate mofetil in African-American renal allograft recipients:U.S. renal transplant mycophenolate mofetil study group[J]. Transplantation,1997,64(9):1277-1282.
[18] GLANDER P,SOMMERER C,ARNS W,et al. Pharmacokinetics and pharmacodynamics of intensified versus standard dosing of mycophenolate sodium in renal transplant patients[J]. Clin J Am Soc Nephrol,2010,5(3):503-511.
[19] GOURISHANKAR S,HOUDE I,KEOWN PA,et al. The clear study:a 5-day,3-g loading dose of mycophenolate mofetil versus standard 2-g dosing in renal transplantation[J]. Clin J Am Soc Nephrol,2010,5(7):1282-1289.
[20] SOMMERER C,GLANDER P,ARNS W,et al. Safety and efficacy of intensified versus standard dosing regimens of enteric-coated mycophenolate sodium in de novo renal transplant patients[J]. Transplantation,2011,91(7):779-785.
[21] ZHANG H,LIU L,LI J,et al. The efficacy and safety of intensified enteric-coated mycophenolate sodium with low exposure of calcineurin inhibitors in Chinese de novo kidney transplant recipients:a prospective study[J]. Int J Clin Pract,2016,6(70):22-30.
[22] PENG W,LIU G,HUANG H,et al. Short-term intensified dosage regimen of mycophenolic acid is associated with less acute rejection in kidney transplantation from donation after circulatory death[J]. Urol Int,2018,101(4):443-449.
[23] GELDER TV,HESSELINK DA. Mycophenolate revisi- ted[J]. Transpl Int,2015,28(5):508-515.
[24] SANTANA DC,THEODOROPOULOS NM. Immunization of solid organ transplant candidates and recipients:a 2018 update[J]. Infect Dis Clin North Am,2018,32(3):517-533.
[25] MALVEZZI P,ROSTAING L. The safety of calcineurin inhibitors for kidney-transplant patients[J]. Expert Opin Drug Saf,2015,14(10):1531-1546.
[26] PAWINSKI T,DURLIK M,SZLASKA I,et al. Comparison of mycophenolic acid pharmacokinetic parameters in kidney transplant patients within the first 3 months post- transplant[J]. J Clin Pharm Ther,2006,31(1):27- 34.
[27] SAINT-MARCOUX F,VANDIERDONCK S,PR?MAUD A,et al. Large scale analysis of routine dose adjustments of mycophenolate mofetil based on global exposure in renal transplant patients[J]. Ther Drug Monit,2011,33(3):285-294.
[28] SHAW LM,KORECKA M,VENKATARAMANAN R, et al. Mycophenolic acid pharmacodynamics and pharmacokinetics provide a basis for rational monitoring strategies[J]. Am J Transplant,2003,3(5):534-542.
[29] METZ DK,HOLFORD N,KAUSMAN JY,et al. Optimizing mycophenolic acid exposure in kidney transplant recipients:time for target concentration intervention[J]. Transplantation,2019,103(10):2012-2030.
[30] FILLER G,FERRAND A. Do we need to worry about mycophenolate overdose[J]. Expert Opin Drug Saf,2014,13(5):521-524.
[31] KUYPERS DR,LE MEUR Y,CANTAROVICH M,et al.Consensus report on therapeutic drug monitoring of mycophenolic acid in solid organ transplantation[J]. Clin J Am Soc Nephrol,2010,5(2):341-358.
[32] 田普训,敖建华,李宁,等.器官移植免疫抑制剂临床应用技术规范:2019版 [J].器官移植,2019,10(3):213-226.
[33] 王华彬,满江位,胡伟,等.霉酚酸血药浓度监测在肾移植受者中的应用进展[J].医学综述,2020,26(4):652-657.
[34] LI P,SHUKER N,HESSELINK DA,et al. Do Asian renal transplant patients need another mycophenolate mofetil dose compared with Caucasian or African American patients[J]. Transpl Int,2014,27(10):994-1004.
[35] PACHECO E SILVA FILHO A,MANFRO RC,CONTIERI FL,et al. Evaluation of tolerability of enteric-coated mycophenolate sodium versus mycophenolate mofetil in de novo renal transplantation[J]. J Bras Nefrol,2015,37(3):291-296.
(收稿日期:2020-09-14 修回日期:2020-12-07)
(編辑:陈 宏)
