细胞外组蛋白通过促进凋亡参与新生大鼠缺氧缺血性脑病损伤过程
2021-03-02朱融和孙媛媛王凯王楸
朱融和,孙媛媛,王凯,王楸
温州医科大学附属第一医院 儿科,浙江 温州 325015
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是由于各种围生期因素引起的脑缺氧或缺血而形成的常见脑损伤,是儿童神经系统损伤引起的新生儿期的重要疾病之一,探索HIE的发病机制是寻求该病有效治疗方案的根本途径[1]。炎症反应和细胞凋亡在HIE发病过程中起重要的作用,细胞死亡可释放出细胞外组蛋白[2]。在体外研究中,细胞外组蛋白可损伤内皮细胞[3]、刺激细胞因子的释放[4],并能诱导嗜中性粒细胞细胞外诱捕网的形成和髓过氧化物酶的释放。因此,若能将细胞外组蛋白阻断,中和或降解其细胞毒性作用,对减少HIE的发生具有重要的临床意义。本研究通过建立7日龄新生SD大鼠缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)模型,外源性给予抗组蛋白中和抗体,观察其对HIBD是否有保护作用,并且研究细胞外组蛋白是否通过凋亡途径参与HIBD的发生与进展。
1 材料和方法
1.1 材料
1.1.1 实验动物及分组:7日龄新生SD大鼠54只,体质量12~15 g,雌雄不限,由温州医科大学实验动物中心提供,动物许可证号:SYXK(浙)2015-0009。利用随机数余数分组法将其分成3组,分别 为:假手术组、HIBD组和治疗组,每组18只。造模后各组又随机分为3个亚组:6 h组、24 h组和72 h组。每个亚组6只。
1.1.2 主要试剂:8%氧氮混合气体购自广州气体厂;检测细胞外组蛋白ELISA试剂盒(Cell Death Detection Kit)购自德国Roche公司;特异性组蛋白H4中和抗体购自南京金斯瑞生物科技有限公司;兔抗鼠anti-cleaved casepase-3 抗体,antiβ-actin抗体及山羊抗兔二抗购自美国Abcam公司,TUNEL染色试剂盒、尼氏(Nissl)染色液及Western blot相关试剂均购自南通碧云天生物技术研究所,其他试剂为国产分析纯。
1.2 方法
1.2.1 动物模型制备:缺氧缺血动物模型参考文 献[5]。7日龄新生SD大鼠游离并结扎左侧颈总动脉,术后2 h后置于37 ℃恒温水浴的缺氧舱,以2 L/min 的速度输入8%氧气和92%氮气的混合气体,2 h后 取出并返回母鼠身边继续喂养。假手术组仅分离左侧颈总动脉,不做结扎和缺氧处理。治疗组在造模前5 min尾静脉注射特异性组蛋白H4中和抗体 20 mg/kg,假手术组和HIBD组尾静脉注射等量0.9%氯化钠溶液。
1.2.2 ELISA法检测血浆细胞外组蛋白水平:各组动物在造模后6 h、24 h和72 h,采取心脏采血法。收集血液标本,3 000 r/min离心10 min分离血清,ELISA法检测血清中组蛋白水平,具体操作步骤严格按照试剂盒说明书进行。
1.2.3 HE染色:取各组造模后24 h及72 h亚组的左侧脑组织标本(n=3/亚组)以4%多聚甲醛固定,常规脱水、石蜡包埋,连续切片,厚度5 μm,行HE染色,光学显微镜下观察脑组织病理变化。
1.2.4 脑含水量检测:取各组造模后24 h亚组的完整脑组织(n=3/亚组),沿大脑中线将左右侧大脑分开并称量湿重。然后,在105 ℃恒温箱中干燥48 h 并称量干重。根据公式计算脑含水量:脑含水量= (湿重-干重)/湿重×100%。
1.2.5 尼氏染色:脑组织石蜡切片脱蜡、水化、 0.5%甲基紫避光染色20 min,PBS漂洗后分化6 s、无水乙醇脱水,二甲苯透明、封片观察,利用Imagepro plus6.0 图像分析软件分析结果,计算公式:脑组织损失率=(右侧正常脑组织面积-左侧剩余正常脑组织面积)/右侧正常组织面积×100%。
1.2.6 组织蛋白提取及Western blot分析:分离造模72 h后的左侧大脑皮层(n=3/组),加入组织裂解液,组织匀浆机匀浆后低温下12 000 r/min离心10 min,取上清液,测定蛋白浓度并稀释到相同浓度,按比例加入5×上样缓冲液,100 ℃金属浴5 min。取30 μg蛋白进行凝胶电泳,PVDF膜转膜,5%脱脂奶粉封闭30 min,抗cleaved casepase-3、β-actin抗体4 ℃孵育过夜,二抗室温孵育2 h,ECL发光暗室显影后对胶片进行拍摄,利用ImageJ软件进行灰度值分析。
1.2.7 TUNEL染色:石蜡切片脱蜡至水,用蛋白酶K工作液处理15 min,PBS漂洗3次,滴加TUNEL反应液避光孵育60 min,PBS漂洗3次后加DAPI染色 5 min,再用PBS漂洗3次,显微镜拍照。
1.3 统计学处理方法 采用SPSS23.0软件进行统计学分析。计量资料用±s表示,多组间比较采用单因素方差分析,组内两两比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 脑组织肉眼大体观察及脑含水量测定 造模后24 h的大体观察,与假手术组相比,HIBD组左侧脑组织有明显水肿;治疗组与HIBD组相比,左侧脑组织水肿程度明显轻(见图1A)。HIBD组脑含水量比假手术组高(P<0.05),治疗组较HIBD组含水量低 (P<0.05),见图1B。
2.2 脑组织HE染色观察 假手术组在6 h、24 h和72 h脑组织结构层次均清晰,细胞轮廓正常,细胞核界限清晰,核仁明显,尼氏体均匀分布在核周围。HIBD组造模24 h后左侧脑细胞大片坏死,神经元细胞及胶质细胞可见核固缩、核碎裂;72 h后左侧脑组织在大片坏死的背景下,神经元细胞及胶质细胞数量明显减少,嗜神经细胞现象明显(黑色箭头),可见大量的核固缩、核碎片。治疗组造模24 h后可见左侧脑细胞轻度水肿,较HIBD组明显好转;72 h后可见少数嗜神经细胞现象(黑色箭头)。见图2。

图1 脑组织大体形态学观察及脑含水量测定
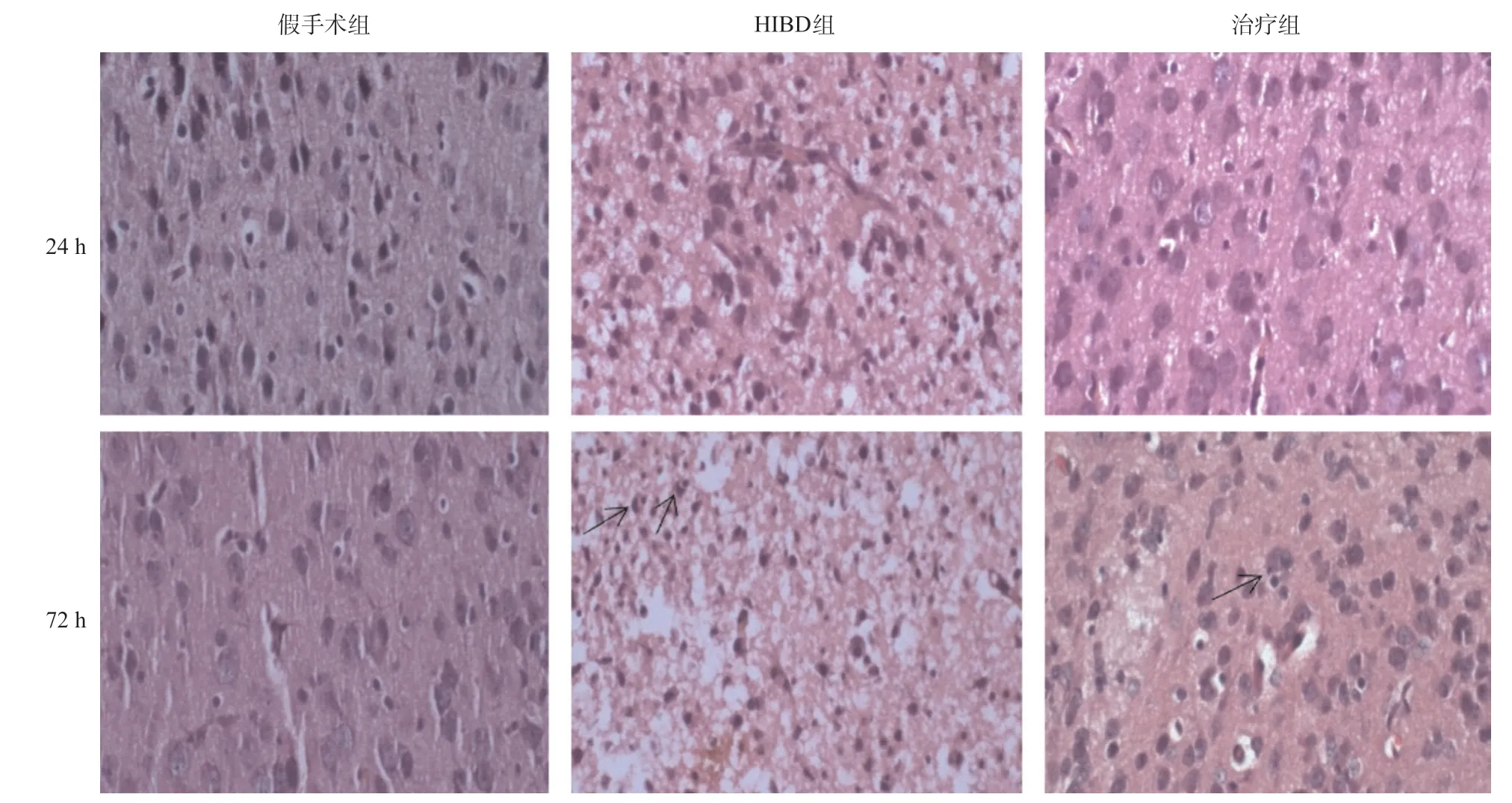
图2 新生大鼠左侧大脑组织HE染色结果(×400)
2.3 脑组织尼氏染色观察 假手术组大脑皮层、海马区和纹状体细胞排列有序,结构分明(见图3A)。HIBD组出现明显的损伤,结构紊乱,细胞大量丢失(见图3B)。与HIBD组相比,治疗组细胞变性和坏死情况减轻(见图3C),脑组织损失率测定HIBD组较假手术组增加,而治疗组较HIBD组减少(P <0.01),见图3D。
2.4 各组血浆细胞外组蛋白水平变化 假手术组在造模后6 h、24 h和72 h时血浆细胞外组蛋白水平差异无统计学意义(P>0.05);HIBD组在造模后6 h、24 h和72 h时血浆细胞外组蛋白水平差异无统计学意义(P>0.05),并且分别明显高于假手术组相同3个时间点的组蛋白水平(均P<0.05);治疗组在造模后6 h、24 h和72 h时血浆细胞外组蛋白水平差异无统计学意义(P>0.05),并且分别低于HIBD组相同3个时间点的组蛋白水平(均P <0.01)。见图4。


图3 造模72 h后的脑组织尼氏染色

图4 各组不同时间点血浆细胞外组蛋白水平
2.5 各组细胞凋亡情况 造模72 h后TUNEL染色检测脑组织细胞凋亡情况,假手术组基本没有细胞凋亡,HIBD组较假手术组细胞凋亡量高(P<0.01);而治疗组较HIBD组细胞凋亡的数量低(P<0.01)。见图5。
2.6 各组凋亡相关蛋白表达情况 检测造模72 h后组织凋亡蛋白的表达情况,HIBD组凋亡蛋白cleaved caspase-3较假手术组表达高(P<0.05),而治疗组较HIBD组cleaved caspase-3表达低(P<0.05)。见图6。
3 讨论
组蛋白是染色质的主要成分之一,在细胞核内含量丰富且非常恒定,主要包括5种类型:H1、H2A、H2B、H3和H4[6]。细胞凋亡或坏死时染色质降解,核内组蛋白被释放至细胞外成为细胞外组蛋白[7]。细胞外组蛋白具有较强的细胞毒性,不仅能杀伤入侵的微生物病原体,同时其自身毒性与败血症[8]、血栓[9]、自身免疫性疾病[10-11]及肿瘤[12]等相关,还 会对肺[13]、肝[14]、肾[15]等脏器造成损伤,表明细胞外组蛋白可能是一种参与各种炎症损伤过程的致病 因子[16]。但是,目前关于细胞外组蛋白对于中枢神经系统疾病,特别是HIBD中的作用效应仍不清楚。
国内学者通过建立大鼠脑缺血再灌注(I/R)损伤模型,发现I/R损伤后脑内局部的组蛋白浓度和细胞外组蛋白水平均升高,而细胞外组蛋白可直接导致培养的原代神经细胞死亡,提示细胞外组蛋白在脑I/R损伤中发挥重要作用[17]。DE MEYER等[18]研究发现,脑组织在I/R损伤后会出现细胞外染色质水平升高,而用抗组蛋白抗体中和细胞外组蛋白可以明显改善小鼠的神经功能及运动功能,保护脑组织并减少梗死灶体积。相关的临床研究[19-20]也证实了上述的观点,脑卒中患者外周血核小体水平显著增加,且与严重程度正相关。然而在HIE患儿中,外周血中细胞外组蛋白水平变化规律及其是否存在加重脑损伤的直接效应,阻断其表达是否对HIE有一定的保护作用,目前尚缺乏相关报道。本研究在发现HIBD模型中细胞外组蛋白含量明显上升的基础上,进一步通过在缺氧缺血前尾静脉注射特异性组蛋白H4中和抗体,结果显示在3个时间点治疗组血浆中细胞外组蛋白含量较HIBD组明显下降,并且脑组织水肿坏死减少,提示细胞外组蛋白参与HIBD的过程。
LEE等[21]的研究发现细胞凋亡参与了HIBD的损伤过程。FANG等[22]的研究发现可以通过抑制凋亡减轻HIBD。为了进一步探索细胞外组蛋白是否参与HIBD的损伤及其可能的机制,本研究进一步检测了各组脑组织中凋亡相关指标,发现HIBD组的脑组织凋亡程度增加,而注射抗组蛋白中和抗体的治疗组脑组织凋亡程度较HIBD组减轻,提示细胞外组蛋白可以促进凋亡引起脑损伤,这可能是其参与HIBD过程的机制。


图5 TUNEL染色检测凋亡情况(×100)
本研究结果显示,细胞外组蛋白可能是通过凋亡途径参与缺氧缺血后脑损伤的进程,抗组蛋白中和抗体对新生大鼠缺氧缺血后引起的脑损伤具有一定的保护作用。

图6 Western blot检测cleaved caspase-3蛋白表达情况
