阳春砂3个萜类合酶基因启动子的克隆及其参与萜类调控的分析
2021-02-25赵海莹林晓静赵圆圆梁慧琳叶泽萍杨锦芬
赵海莹,李 萌,林晓静,赵圆圆,梁慧琳,叶泽萍,杨锦芬*
• 药材与资源 •
阳春砂3个萜类合酶基因启动子的克隆及其参与萜类调控的分析
赵海莹1,李 萌1,林晓静1,赵圆圆1,梁慧琳1,叶泽萍2,杨锦芬1*
1. 广州中医药大学 中药资源科学与工程研究中心,岭南中药资源教育部重点实验室(广州中医药大学),国家中成药工程技术研究中心南药研发实验室,广东 广州 510006 2. 广州中医药大学中药学院,广东 广州 510000
获得药用植物阳春砂萜类合酶基因AvBPPS(bornyl diphosphate synthase)、AvLIS(linalool synthase)和AvHUS(humulene synthase)的启动子,探究其顺式作用调控元件参与萜类合成的调控。从阳春砂叶片基因组DNA(genomic DNA,gDNA)中分别克隆获得AvBPPS、AvLIS和AvHUS的gDNA序列,据此设计特异引物,再通过FPNI-PCR(fusion primer and nested integrated PCR,FPNI-PCR)方法分别克隆其启动子并进行生物信息学分析,结合转录组及对应萜类含量数据,分析其较为关键的顺式作用调控元件与萜类调控的关系。获得AvBPPS、AvLIS和AvHUS的gDNA长度分别为2374、2295、2362 bp,均包含相应基因的完整编码区和7个外显子。进一步克隆获得470、934、762 bp的启动子。AvBPPS启动子含有参与胚乳表达的顺式作用调控元件GCN4-motif,结合基因表达量的分析,该顺式作用调控元件调控了AvBPPS在阳春砂药用部位种子中的特异表达,进而影响了主要药效萜类成分龙脑、乙酸龙脑酯等在种子中的积累。AvLIS和AvHUS启动子均含有参与茉莉酸甲酯(methyl jasmonate,MeJA)反应的顺式作用调控元件,转录组和萜类含量的分析显示AvLIS响应高浓度MeJA的诱导,而AvHUS没有表现出对MeJA的响应。首次从药用植物阳春砂的启动子中发现了参与胚乳表达和MeJA反应的调控元件,为深入探究萜类合成关键酶的种子表达特异性和对MeJA响应的机制提供了基础,为萜类代谢的调控提供了操作元件。
启动子;阳春砂;萜类合酶;萜类化合物;茉莉酸甲酯
萜类化合物是自然界存在的一类由异戊二烯为结构单元组成的化合物[1],包括含有2个异戊二烯单位的单萜类化合物,如芳樟醇;含有3个异戊二烯单位的倍半萜类化合物,如青蒿素;含有4个异戊二烯单位的二萜类化合物,如紫杉醇;以及含有6个异戊二烯单位的三萜类化合,如植物甾醇。萜类不仅对植物的生长发育、抗逆防御等有重要作用,还具有重要的药用价值,如青蒿素是治疗疟疾的特效药[2];紫杉醇是治疗多种癌症最有效的化疗剂之一[3]等。阳春砂仁为姜科豆蔻属阳春砂Lour.的干燥成熟果实,是我国著名的“四大南药”之一,具有化湿开胃、温脾止泻、理气安胎等功效[4]。其挥发油中富含乙酸龙脑酯、樟脑、龙脑等单萜类成分[5]。
植物细胞中萜类合酶以异戊二烯焦磷酸——香叶基焦磷酸(geranyl diphosphate,GPP)、法呢基焦磷酸(farnesyl diphosphate,FPP)、牻牛儿基牻牛儿基焦磷酸(geranylgeranyl diphosphate,GGPP)为底物,合成大量结构功能多样的萜类化合物[6]。按形成产物的不同,可分为单萜合酶、倍半萜合酶、二萜合酶等。目前,已有多种萜类合酶被报道,如‘西伯利亚’百合(Lilium‘Siberia’)中的LoTPS1催化底物GPP产生芳樟醇[7];檀香树L.中的SaTPS2催化FPP产生多种倍半萜化合物,其主产物为()-α-佛手柑[8]。课题组从阳春砂中克隆并鉴定了多个萜类合酶,如单萜合酶——蒎烯合酶(pinene synthase,AvPS)、龙脑基二磷酸合酶(bornyl diphosphate synthase,AvBPPS)和芳樟醇合酶(linalool synthase,AvLIS),它们对应的主产物分别为蒎烯[9]、龙脑基二磷酸[9]和芳樟醇;还有倍半萜合酶——葎草烯合酶(humulene synthase,AvHUS)催化FPP生成倍半萜石竹烯和葎草烯,以葎草烯为主产物[10]。其中AvBPPS除了以龙脑基二磷酸为主产物,还生成莰烯、柠檬烯和月桂烯,而龙脑基二磷酸是阳春砂主要药效物质乙酸龙脑酯、樟脑和龙脑的直接或间接前体。因此AvBPPS是阳春砂萜类药效物质合成途径的关键酶[9]。AvLIS和AvHUS的主产物芳樟醇和葎草烯是香料以及医药和食品工业的重要原料。
启动子(promoter)是位于基因上游的一段提供RNA聚合酶识别并结合的DNA序列[11]。启动子通常有G-box、GCN4-motif、TATA-box、CGTCA-motif等顺式作用调控元件[12-13],其能够在种子中特异表达,也能够响应激素如MeJA或脱落酸等,因而在植物种子萌发、衰老、抗逆反应等生物过程基因表达调控中发挥着重要的作用。如刺五加L. mevalonate diphosphate decarboxylase(MDD)的2个茉莉酸甲酯(methyl jasmonate,MeJA)顺式作用调控元件可根据MeJA的浓度来调控其皂苷类化合物的含量[14]。萜类合酶基因启动子的表达调控会影响植物萜类产物的合成,克隆并分析药用植物次生代谢相关功能基因的启动子,对深入了解药用植物的萜类合成机制有重要的意义。课题组已从阳春砂中克隆了AvPS的启动子,并验证了其活性[15]。本实验在前期研究的基础上,克隆阳春砂的AvBPPS、AvLIS和AvHUS的基因组DNA(genomic DNA,gDNA),进而克隆其启动子并分析其顺式作用调控元件,以期了解其表达模式及其调控相应萜类合成的机制。
1 材料与试剂
1.1 材料
样品栽培于广州中医药大学时珍山,由广州中医药大学何国振教授鉴定为阳春砂Lour.,取其嫩叶保存至−80 ℃冰箱。
1.2 试剂
植物基因组DNA提取试剂盒(离心柱型)、pLB零背景快速克隆试剂盒购于天根生化科技(北京)有限公司;DH5α感受态细胞、PCR酶PrimerSTAR、LA Taq、DL2000 Maker、DNA切胶回收试剂盒购于Takara公司;引物合成和基因测序由北京擎科生物科技有限公司完成。
2 方法
2.1 阳春砂叶片DNA的提取
参照植物gDNA提取试剂盒的操作说明书,提取阳春砂叶片基因组DNA,用1%琼脂糖凝胶电泳和微量紫外分光光度计检测DNA完整性及浓度。
2.2 AvBPPS、AvLIS和AvHUS gDNA序列扩增、分析及提交
以阳春砂叶片gDNA为模板,使用Primer STAR高保真酶对AvBPPS、AvLIS和AvHUS编码区的gDNA序列进行PCR扩增,引物与从cDNA中克隆基因编码区的引物一致(表1)。PCR扩增条件:98 ℃,预变性5 min;98 ℃,变性10 s,按相应退火温度退火30 s,72 ℃,延伸2.5 min,30个循环;最后72 ℃延伸5 min。将PCR产物纯化后连接至pLB载体,并转化至DH5α,进行菌落PCR筛选阳性重组子并测序获得AvBPPS、AvLIS和AvHUS的gDNA序列。利用Clustal Omega(http://www.ebi.ac.uk/Tools/ msa/clustalo/)和DNAMAN软件,将测序结果分别与已获得的AvBPPS、AvLIS和AvHUS序列比对,确定其gDNA序列后,登录GenBank https: //www.ncbi. nlm.nih.gov/genbank/submit/,用BankIt提交gDNA序列。

表1 扩增gDNA的引物
2.3 启动子克隆
根据fusion primer and nested integrated PCR(FPNI-PCR)引物设计原则和“2.2”项获得的AvBPPS、AvLIS和AvHUS gDNA序列,在5’端分别设计3条方向一致的特异性引物(gene specific primers,GSP),见表2。FPNI-PCR分为3轮扩增,第1轮PCR取适量阳春砂叶片gDNA,用9条通用简并引物FP1~9[15]分别与AvBPPS、AvLIS和AvHUS特异引物GSP TPS3/TPS12/TPS6-1进行热不对称PCR;第2轮PCR取第1轮PCR产物为模板,巢式特异引物FSP1分别与3个基因的特异引物GSP TPS3/TPS12/TPS6-2进行普通PCR;第3轮方法与第2轮类似,以逐步分离目的DNA片段。将3轮PCR产物进行琼脂糖凝胶电泳检测,用第3轮PCR产物直接测序或连入pLB载体测序。利用Clustal Omega对测序结果与已获得的目的基因 gDNA序列分别比对,确认3’端与其gDNA序列的5’端部分序列是否重叠。对于AvBPPS,在第1次FPNI-PCR获得部分启动子序列的基础上再设计3条特异引物GSP TPS3-4~6进行第2次FPNI-PCR,将获得的延长序列与第1次扩增的序列进行拼接后,根据拼接序列5’末端设计上游引物TPS3-0F(表2),与GSP TPS3-3配对,扩增完整更长的片段。

表2 克隆启动子的特异性引物
TPS3对应AvBPPS,TPS6对应AvHUS,TPS12对应AvLIS
TPS3 corresponds to AvBPPS, TPS6 corresponds to AvHUS, TPS12 corresponds to AvLIS
2.4 启动子的生物信息学分析
用Neural Network Promoter Predictio(http:// www. fruitfly.org/seq-tools/promoter.html)预测转录起始位点,以预测值0.5为cut-off值进行转录起始位点预测;将扩增得到的启动子序列提交到启动子顺式作用调控元件预测网PlantCARE(http://bioin formatics.psb.ugent.be/webtools/plantcare/html/)进行分析,预测启动子潜在的顺式作用调控元件。
2.5 AvBPPS、AvPS、AvLIS和AvHUS在阳春砂2个转录组中的表达量分析
从阳春砂果实转录组[10]和MeJA诱导的转录组[16]中提取AvBPPS、AvPS、AvLIS和AvHUS对应的RPKM(reads per kb per million reads)值表征其表达量。
3 结果与分析
3.1 gDNA的克隆和分析
PCR分别获得大于2 kb的AvBPPS、AvLIS和AvHUS的gDNA片段(图1),测序获得其序列长度分别为2374、2295、2362 bp,均包含了对应基因完整的开放阅读框(open reading frame,ORF)(表2)。向GenBank提交了AvBPPS、AvLIS 和 AvHUS的gDNA序列,分别获得序列号MG763230、MN829545、MN829547,同时得到各基因外显子(E1~7)的分布数据(表3)。
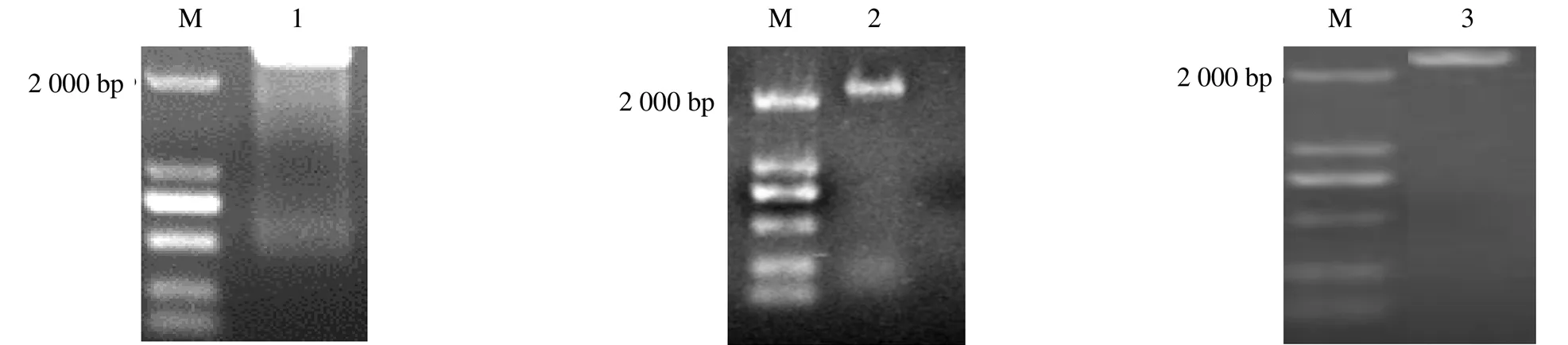
M-Marker 1-AvBPPS 2-AvHUS 3-AvLIS

表3 gDNA外显子分布
对AvBPPS、AvLIS和AvHUS的gDNA结构分析发现其均包含7个外显子和6个内含子(图2),其中外显子3(E3)的核苷酸序列最长。单萜合酶基因AvBPPS(图2-A)和AvLIS(图2-B)的结构相似,而倍半萜合酶基因AvHUS(图2-C)与它们的结构略有不同,其外显子E1的核苷酸序列比单萜合酶基因的E1序列短,因为倍半萜合酶中不存在质体转运肽。与植物萜类合酶催化功能密切相关的4个保守结构域(R,K)X8W、RXR、DDXXD和(N、D)D(L、I、V)X(S、T)XXXE分别位于E1、E4以及E6和E7,其中(N,D)D(L、I、V)X(S、T)XXXE分布在2个外显子中(图2)。
3.2 启动子克隆
用FPNI-PCR法克隆启动子,AvBPPS在引物FP2第3轮PCR结果中出现特异性目的条带(图3-A),测序结果表明该片段与gDNA 5’端有264 bp重叠序列,初步确认获得其部分启动子序列。由于获得的净启动子片段较短,再次设计引物延长扩增后,在FP3第3轮PCR中出现特异性目的条带(图3-B);测序结果表明该片段的3’端与前述的启动子序列5’端153 bp的序列一致,初步确认获得AvBPPS启动子的延长片段。将2次扩增获得的序列进行拼接,获得795 bp的序列,根据其5’端设计上游引物与下游引物GSP TPS3-3配对(表2),扩增获得约800 bp的长片段,并克隆到载体中测序(图3-C);测序结果表明长片段与拼接序列的相似度为99%。
AvLIS和AvHUS分别在引物FP3和FP2第3轮PCR结果中出现特异性目的条带,测序结果表明AvLIS和AvHUS目的片段分别与其gDNA 5’端有156 bp和220 bp的一致序列,初步确认获得了AvHUS和AvLIS的启动子序列(图4)。

E1~7-外显子1~7,框中数字为该外显子编码的氨基酸个数 I1~I6-内含子1~6
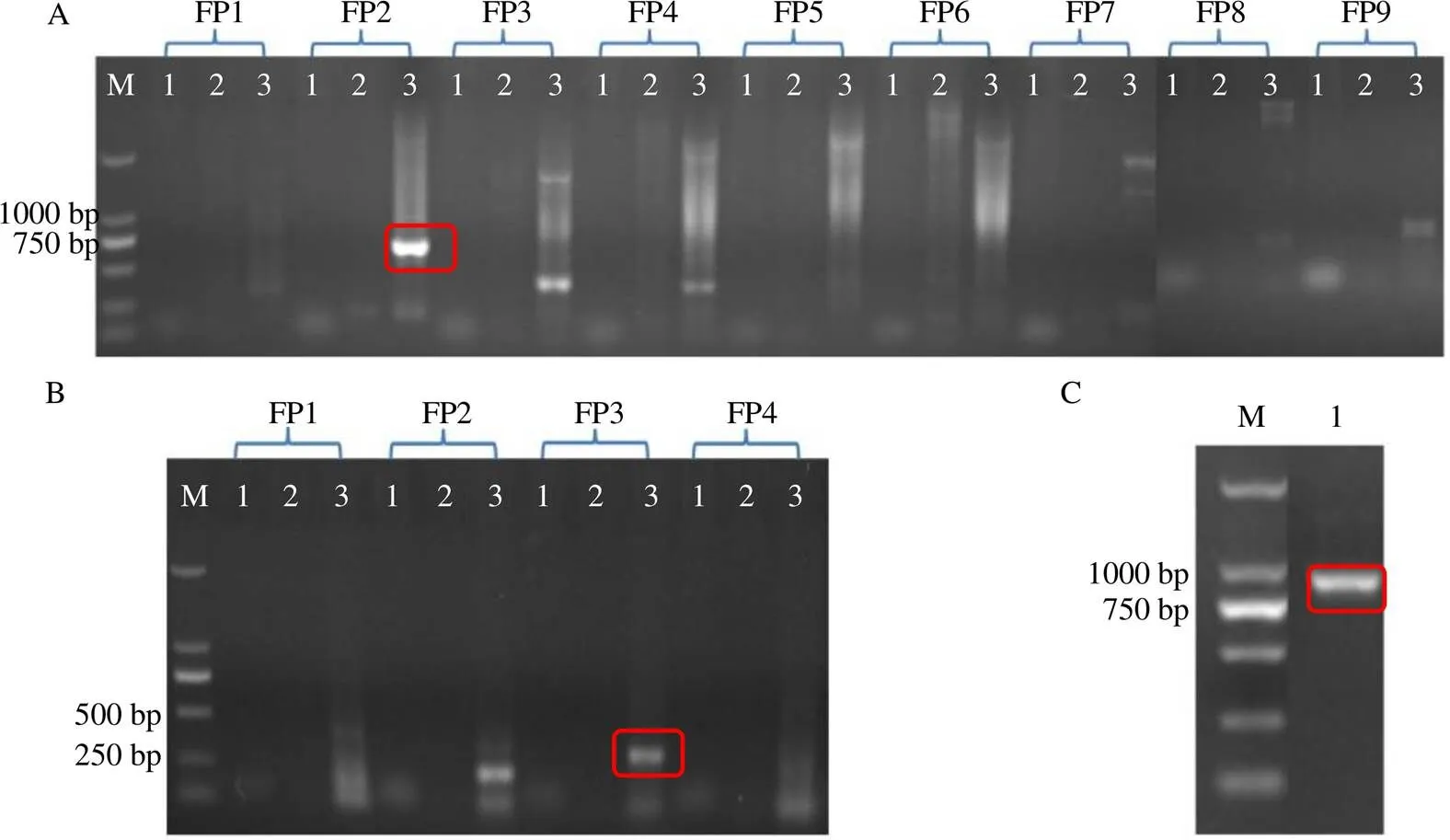
A-FPIN-PCR扩增产物 B-FPIN-PCR延长扩增片段 C-长片段 M-Marker
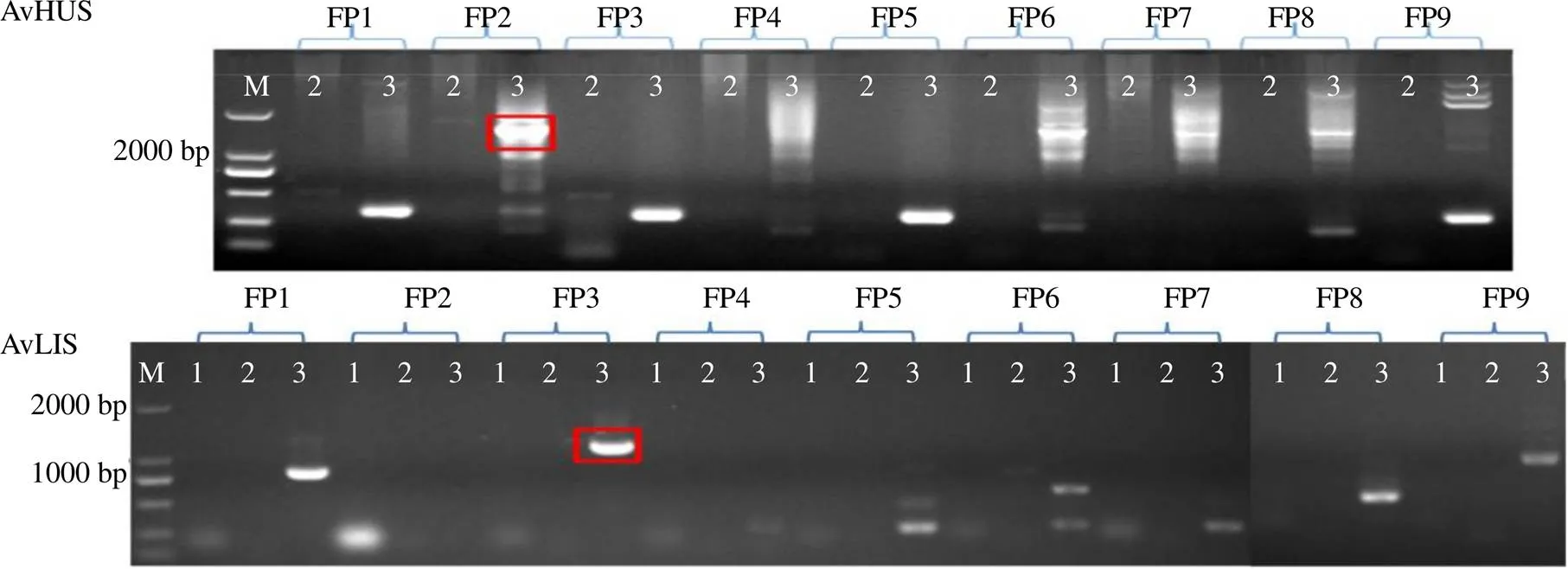
1~3-重复次数
3.3 启动子的顺式作用调控元件及比较
AvBPPS、AvLIS和AvHUS启动子序列的转录起始位点分别位于其起始密码子ATG上游59、23、389 bp处,截取转录起始位点上游序列,最终分别获得470、934、762 bp启动子序列。为了区分碱基的位置和正负链,从转录起始位点左边第1个碱基位置设为“−1”,依此类推。分别分析AvBPPS、AvLIS和AvHUS启动子顺式作用调控元件的类型、数量及位置。AvBPPS(图5-A)、AvLIS(图5-B)和AvHUS(图5-C)启动子均包含多个真核生物启动子保守元件,如TATA-box和CAAT-box。AvBPPS启动子中包含GCN4-motif(TGAGTCA)—参与胚乳表达的顺式作用调控元件,还有G-Box—与光响应的顺式作用调控元件,此外,还含有参与脱落酸反应、低温响应、MYB结合位点等顺式作用调控元件。预测得分(matrix score)超过5分的元件见表4。其中,GCN4-motif是本研究最为关注的顺式作用调控元件。

图5 AvBPPS (A)、AvLIS (B) 和AvHUS (C) 启动子序列及其顺式作用调控元件

表4 AvBPPS启动子预测的顺式作用调控元件
“+”链以转录起始位点左边第1个碱基的位置为−1;“*”当预测的TATA-box数目超过3个时,仅展示得分最高的3个,下表同
Position of first base at left of transcription initiation site was −1 in + chain; When number of predicted TATA-boxes exceeded three, only top three with highest matrix score were shown, same as below table
AvLIS和AvHUS启动子顺式作用调控元件大体相似,均含有涉及MeJA反应的顺式作用调控元件CGTCA-motif/TGACG-motif;还含有参与脱落酸反应的顺式作用调控元件AAGAA-motif和ABRE以及参与光响应的顺式调节元件G-box。AvHUS启动子中含有与代谢调节有关和厌氧诱导所必需的顺式调节元件;而AvLIS启动子中含有参与低温响应和生长素反应的顺式作用调控元件,还含有MYB、MYC、I-box、W-box等元件。W-box可以与WRKY转录因子进行特异性结合从而调控目标基因的表达[17]。启动子元件AvLIS和AvHUS预测得分超过5分的见表5、6。
3.4 AvBPPS在种子中特异表达及其对应萜类产物在种子中富集
课题组前期的研究比较了AvBPPS在阳春砂在多个组织部位的表达,发现AvBPPS表现出种子特异表达的模式[10]。本实验利用阳春砂的转录组数据[10],比较4个萜类合酶基因AvBPPS、AvPS、AvLIS和AvHUS的表达量,发现它们在种子中均有表达,但AvBPPS在种子中的表达量显著高于其他3个基因的表达量,表现出在种子中特异表达的模式(图6-A)。分析这4个酶对应的萜类产物含量,其中AvBPPS的催化主产物BPP是阳春砂主要药效成分乙酸龙脑酯、龙脑和樟脑的关键前体,AvBPPS在种子中的高表达与其对应的萜类成分(包括直接产物与间接产物)在种子中的富集模式一致(图6-B)。AvBPPS在种子中的特异表达与其启动子含有的参与胚乳表达的元件GCN4-motif相符,而其余3个基因的启动子均无GCN4-motif,与它们在种子中的低表达相符。
3.5 MeJA处理后的AvLIS、AvHUS表达量及其对应萜类产物的分析
已克隆的4个萜类合酶基因AvBPPS、AvPS、AvLIS和AvHUS启动子中,只有AvLIS和AvHUS含有MeJA调控的顺式作用调控元件,其中AvLIS有3个此类元件,而AvHUS有2个。根据本课题组之前对MeJA处理阳春砂的研究数据[16],分析AvLIS和AvHUS在MeJA诱导后其分别在果皮中的表达量与其对应的萜类产物含量,发现2个基因均在低剂量(200 μmol/L)组表达量最低,与溶剂对照组(CK)相比,AvLIS(图7-A)在高剂量(600 μmol/L)组中表达量提高且其对应的萜类成分也相应提高,表明AvLIS响应高浓度的MeJA诱导,与其启动子含有MeJA调控的顺式作用调控元件相符;而AvHUS(图7-B)在2个剂量组中的表达量均低于溶剂对照组,其对应的萜类产物含量也变化不大,AvHUS未表现出对MeJA的响应。
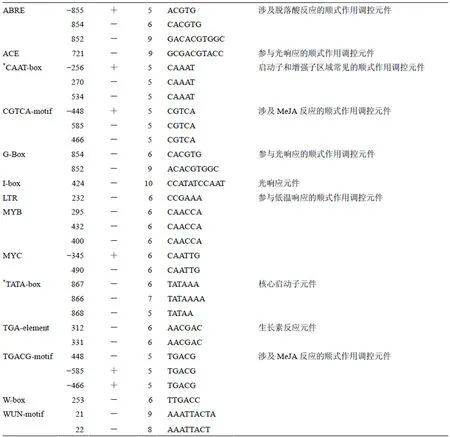
表5 AvLIS启动子预测的顺式作用调控元件
4 讨论
本实验通过FPNI-PCR获得了阳春砂AvBPPS、AvLIS和AvHUS的启动子,对其顺式作用调控元件的分析发现3个启动子均包含光响应元件G-box,这3个基因可能受光照的调控。文献报道G-box参与UV-A诱导,拟南芥COX5b-2基因编码细胞色素C氧化酶5b亚基,该基因受UV-B诱导表达,其启动子中有一个保守的G-box元件,突变此元件会使该基因丧失对UV-B诱导的响应[18]。增强光照是否会提高AvBPPS、AvLIS和AvHUS在阳春砂果实中的表达,进而增加其对应萜类化合物的积累量,有待进一步研究。
课题组前期研究发现[16],MeJA处理阳春砂果实后,大部分萜类的积累量明显上升,如芳樟醇、蒎烯等,说明MeJA能有效调控阳春砂中部分挥发性萜类成分的代谢[16]。MeJA处理阳春砂比较转录组显示,MeJA诱导的代谢路径和次生代谢物生物合成路径中注释到的Unigene更多,说明MeJA诱导促使较多的参与次生代谢的基因被激活[16]。本实验发现AvLIS和AvHUS启动子含有涉及MeJA调控的CGTCA-motif/TGACG-motif元件,AvLIS响应MeJA的诱导且其对应萜类产物芳樟醇的含量也相应提高,而AvHUS未表现出对MeJA的响应;这2个基因启动子中涉及MeJA调控元件的数目不同,有可能影响了其对MeJA响应的程度。

表6 AvHUS启动子预测的顺式作用调控元件

萜类含量数据来源于文献报道[10];B中AvPS对应的萜类产物为α-蒎烯和β-蒎烯,AvBPPS对应的萜类产物包括直接产物柠檬烯和月桂烯及间接产物樟脑、龙脑和乙酸龙脑酯,AvHUS对应的萜类产物包括葎草烯和石竹烯,AvLIS对应的萜类产物为芳樟醇

CK-溶剂对照组 M1-200 μmol·L−1 MeJA喷施组 M2-600 μmol·L−1 MeJA喷施组
GCN4-motif是胚乳特异性表达所必需的顺式作用调控元件之一,存在于大多数种子储藏蛋白基因和一些代谢关键酶基因的启动子中[19]。GCN4-motif的功能在水稻中已经很明确,该顺式作用调控元件不但指导谷蛋白基因在胚乳中的特异表达,还对其启动子的活性具有正调控作用[20-21]。如在水稻种子贮藏蛋白中各种谷蛋白(glutelin)的编码基因都含有GCN4基序,当其发生突变时,大部分启动子活性会丧失,还会使谷蛋白基因在叶片中表达[21]。水稻中的转录因子OsSMF1与GCN4-motif相互作用,可以调节种子贮藏蛋白的合成,是淀粉合成的关键调控因子[22]。本实验发现AvBPPS启动子中含有GCN4-motif,荧光定量PCR和转录组数据分析的结果表明AvBPPS在种子中特异表达,且其相应的萜类产物乙酸龙脑酯、樟脑、龙脑等在种子中富集。砂仁以干燥成熟的果实入药,其果实的结构以种子团为主,干燥后果皮的占比更小,因此,种子实际上是砂仁(包括阳春砂仁)的主要药用部位。AvBPPS启动子中含有的参与胚乳表达的顺式作用调控元件GCN4-motif为AvBPPS的种子表达特异性提供了支撑,也为进一步揭示阳春砂乙酸龙脑酯、樟脑、龙脑等药效成分在药用部位种子中富集的机制提供了重要线索。
本实验首次从药用植物阳春砂的启动子中发现了参与胚乳表达和MeJA反应的顺式作用调控元件,为深入探究萜类合成关键酶的种子表达特异性和对MeJA响应的机制提供了基础,为萜类代谢的调控提供了操作元件。后续将通过转基因实验验证启动子的功能,特别是探究AvBPPS启动子的种子表达特异性,以期更深入地探讨启动子调控基因表达和萜类合成的机制。
利益冲突 所有作者均声明不存在利益冲突
[1] Lange B M, Rujan T, Martin W,. Isoprenoid biosynthesis: The evolution of two ancient and distinct pathways across genomes [J]., 2000, 97(24): 13172-13177.
[2] Klayman D L. Qinghaosu (artemisinin): An antimalarial drug from China [J]., 1985, 228(4703): 1049-1055.
[3] Misra A, Srivastava N K, Srivastava A K,. Influence of gibberellic acid and arbuscular mycorrhizae inoculation on carbon metabolism, growth, and diterpene accumulation invar. mairei [J]., 2010, 2(2): 22-27.
[4] 中国药典 [S]. 一部. 2015: 253.
[5] 胡玉兰, 张忠义, 林敬明. 中药砂仁的化学成分和药理活性研究进展 [J]. 中药材, 2005, 28(1): 72-74.
[6] 岳跃冲, 范燕萍. 植物萜类合成酶及其代谢调控的研究进展 [J]. 园艺学报, 2011, 38(2): 379-388.
[7] Abbas F, Ke Y, Yu R,. Functional characterization and expression analysis of two terpene synthases involved in floral scent formation in‘Siberia’ [J]., 2019, 249(1): 71-93.
[8] Zhang X, Niu M, Teixeira da S J A,. Identification and functional characterization of three new terpene synthase genes involved in chemical defense and abiotic stresses in[J]., 2019, 19(1): 115.
[9] Wang H, Ma D, Yang J,. An integrative volatile terpenoid profiling and transcriptomics analysis for gene mining and functional characterization of AvBPPS and AvPS involved in the monoterpenoid biosynthesis in[J]., 2018, 9: 846.
[10] 李萌. 阳春砂单萜和倍半萜合酶的功能鉴定及BPPS的功能比较 [D]. 广州: 广州中医药大学, 2019.
[11] 王镜岩. 生物化学 [M]. 第3版. 北京: 高等教育出版社, 2002: 236.
[12] Joshi C P. An inspection of the domain between putative TATA box and translation start site in 79 plant genes [J]., 1987, 15(16): 6643-6653.
[13] Müller M, Knudsen S. The nitrogen response of a barley C-hordein promoter is controlled by positive and negative regulation of the GCN4and endosperm box [J]., 1993, 4(2): 343-355.
[14] 李志栋, 杨果, 尤鹏升, 等. 刺五加MDD基因启动子的克隆与生物信息学分析 [J]. 中草药, 2016, 47(21): 3871-3875.
[15] 王虹, 李萌, 马东明, 等. 阳春砂萜类合酶AvTPS1启动子的克隆及其活性分析 [J]. 中草药, 2019, 50(9): 2181-2187.
[16] 王焕, 杨锦芬, 邓可, 等. 茉莉酸甲酯影响阳春砂挥发性萜类代谢和基因转录 [J]. 世界科学技术—中医药现代化, 2014, 16(7): 1528-1536.
[17] 谢政文, 王连军, 陈锦洋, 等. 植物WRKY转录因子及其生物学功能研究进展 [J]. 中国农业科技导报, 2016, 18(3): 46-54.
[18] Comelli R N, Gonzalez D H. Identification of regulatory elements involved in expression and induction by sucrose and UV-B light of theCOX5b-2 gene, encoding an isoform of cytochrome c oxidase subunit 5b [J]., 2009, 137(3): 213-224.
[19] 周淑芬. 种子特异性启动子研究进展 [J]. 福建农业科技, 2012(10): 71-74.
[20] Yoshihara T, Washida H, Takaiwa F. A 45-bp proximal region containing AACA and GCN4motif is sufficient to confer endosperm-specific expression of the rice storage protein glutelin gene, GluA-3 [J]., 1996, 383(3): 213-218.
[21] Wu C Y, Washida H, Onodera Y,. Quantitative nature of the Prolamin-box, ACGT and AACA motifs in a rice glutelin gene promoter: Minimal-element requirements for endosperm-specific gene expression [J]., 2000, 23(3): 415-421.
[22] Kim J S, Chae S, Jun K M,. Genome-wide identification of grain filling genes regulated by the OsSMF1transcription factor in rice [J]., 2017, 10(1): 16.
Cloning and bioinformatics analysis of promoters of three terpene synthase genes and their terpenoid regulation in
ZHAO Hai-ying1, LI Meng1, LIN Xiao-jing1, ZHAO Yuan-yuan1, LIANG Hui-lin1, YE Ze-ping2, YANG Jin-fen1
1. Research Center of Chinese Herbal Resource Science and Engineering, Key Laboratory of Chinese Medicinal Resource from Lingnan, Ministry of Education, Joint Laboratory of National Engineering Research Center for Pharmaceutics of Traditional Chinese Medicines, Guangzhou University of Chinese Medicine, Guangzhou 510006, China 2. College of Traditional Chinese Medicine, Guangzhou University of Chinese Medicine, Guangzhou 510006, China
To obtain the promoters of terpenoid synthase genes AvBPPS (bornyl diphosphate synthase), AvLIS (linalool synthase) and AvHUS (humulene synthase) of medicinal plants, and investigate the regulation of-acting regulatory elements involved in terpenoid synthesis.The gDNA of AvBPPS, AvLIS, and AvHUS were cloned from genomic DNA (gDNA) of leaves from, and then specific primers were designed accordingly. The promoters were cloned by FPNI-PCR subsequently and bioinformatics analysis was performed. The relationship between key-acting regulatory elements and terpene regulation was analyzed by combining the transcriptome data and terpenoid contents.The gDNA lengths of AvBPPS, AvLIS and AvHUS were 2374 bp, 2295 bp and 2362 bp, respectively, and all contained complete coding regions of the corresponding genes and seven exons. The promoters of AvBPPS, AvLIS and AvHUS were cloned, respectively. The promoter of AvBPPS contained GCN4-motif, a-acting regulatory element involved in endosperm expression. Combined with the analysis of gene expression, it was speculated that this-acting regulatory element regulated the specific expression of AvBPPS in seeds, and then affected the accumulation of major terpenoids such as borneol and borneol acetate in seeds. Both AvLIS and AvHUS promoters contained-acting regulatory elements involved in methyl jasmonate (MeJA) reaction. Transcriptome and terpene content analysis showed that AvLIS responded to the induction of high-concentration-MeJA, while AvHUS showed no response to MeJA.-acting regulatory elements involved in endosperm expression and MeJA response were discovered from promoters of medicinal plants, which provided a basis for in-depth exploration of seed expression specificity of key enzymes of terpene synthesis and the mechanism of response to MeJA, and provided operating elements for regulation of terpene metabolism.
promoter;Lour.; terpene synthase; terpenoids; methyl jasmonate
R282.12
A
0253 - 2670(2021)04 - 1117 - 11
10.7501/j.issn.0253-2670.2021.04.025
2020-08-06
国家自然科学基金面上项目(81872954)
赵海莹(1993—),女,在读硕士研究生,研究方向为药用植物次生代谢。Tel: 15625132812 E-mail: 965301844@qq.com
杨锦芬(1978—),女,研究员,研究方向为药用植物萜类化合物生物合成与调控。Tel: (020)39358331 E-mail: yangif@gzucm.edu.cn
[责任编辑 时圣明]
