猪伪狂犬病病毒安徽分离株对小鼠的致病性研究
2021-02-22李春芬何赞赞杨龙斌何长生占松鹤魏建忠
李春芬,何赞赞,杨龙斌,何长生,占松鹤,孙 裴,魏建忠,李 郁
(1.安徽农业大学动物科技学院,安徽 合肥 230036;2.巢湖市畜牧兽医中心,安徽 巢湖 238000;3.安徽省动物疫病预防与控制中心,安徽 合肥 230091)
猪伪狂犬病(Pseudorabies, PR)是由猪伪狂犬病病毒(Pseudorabies virus, PRV)引起的一种高度接触性传染病[1]。一般成年猪呈隐性感染,可导致妊娠母猪流产、死胎和木乃伊胎,种猪不育,15日龄内的仔猪病死率高,肥育猪呼吸困难、生长停滞、增重缓慢等。PR呈世界性分布,是危害全球养猪业的重大传染病之一。世界动物卫生组织(OIE)将PR列为必须通报的动物疫病,我国农业农村部将PR列为二类动物疫病,同时PR也是我国《国家中长期动物疫病防治规划(2012—2020年)》中优先防治的动物疫病,要求到2020年底全国所有种猪场达到净化标准。
疫苗免疫接种是预防和控制PR的根本措施,以净化猪群为主要手段。20世纪90年代以来,随着PR基因缺失疫苗(Bartha-K61株)的引入并广泛使用,PR在我国大部分地区得到有效控制[2]。但自2011年以来,我国各地均有PR疫情的报道[3-5],给养猪业造成了严重的经济损失。安徽地区猪群中PRV的感染率也呈现逐年上升趋势[6-7],可临床流行毒株的致病性、与疫苗株之间的匹配性等目前尚不清楚。本研究在从安徽不同地区疑似PRV感染病猪中分离鉴定的13株PRV基础上,以小鼠为动物模型,通过对13株PRV安徽分离株的半数致死量(LD50)测定、病理剖检和病理组织学观察以及各组织脏器的病毒载量检测,了解和掌握PRV安徽分离株的毒力特征,从而为深入研究PRV安徽分离株的抗原性奠定基础,为安徽地区PR的有效防控提供科学依据。
1 材料与方法
1.1 试验时间与地点
试验于2016年1月至2018年12月在安徽农业大学动物传染病研究室进行。
1.2 毒株、细胞及试验动物
13株PRV安徽分离株(代号为AH1601~AH1604、AH1701~AH1704、AH1801~AH1805)由安徽农业大学动物传染病研究室分离、鉴定[8];Vero细胞由安徽农业大学动物传染病研究室保存;455只体重为18~22 g清洁级昆明雌性小鼠购自安徽医科大学动物实验中心。
1.3 主要试剂与仪器
DMEM培养液、2×SuperStar Plus High-GC PCR Mix、DL 2000 DNA Marker。荧光定量PCR仪、PCR扩增仪、凝胶成像系统、超高速离心机。
1.4 半数致死量(LD50)的测定
在13株PRV安徽分离株中,每株为1组,共计13组(编号为1~13)。以第1组(代号为AH1601的PRV安徽分离株)为例说明。将AH1601半数组织培养感染剂量(50% tissue culture infective dose, TCID50)为106/mL进行10倍递增稀释,取6个不同释梯度(106~101TCID50)的病毒液编号为1A~1F。35只小鼠随机分成7组(编号1A~1F和G),每组5只。试验组1A~1F,颈部皮下注射对应的不同稀释度PRV,0.1 mL/只;对照组G,以相同的接种途径和剂量注射DMEM细胞培养液。在适宜环境下每组小鼠分别隔离饲养。持续观察1周并记录小鼠的精神状态及死亡情况,按照Reed-Muench法计算AH1601的LD50。
1.5 病理剖检及病理组织学观察
经1.4攻毒后观察各组小鼠精神状态,分别取第1~13组PRV攻毒剂量为106TCID50(试验A组)小鼠,依次标记为1A~13A,对照组小鼠标记为G,剖检小鼠观察各脏器病变,并采集小鼠的脑组织及肺、肝、脾和肾脏于10%福尔马林溶液中,24 h后重新更换福尔马林,进行固定和保存,之后送至安徽医科大学制备病理组织切片,显微镜观察,比较各组织病变程度。
1.6 感染小鼠各组织脏器中PRV载量的检测
经1.4攻毒后,分别取第1~13组PRV攻毒剂量为106TCID50(试验A组)小鼠,采其脑组织及肺、肝、脾和肾脏于1.5 mL研磨管,称重记录(各组织重约100 mg),按照一定体积比(1∶5)加入无菌PBS缓冲液进行研磨,提取各组织核酸,利用安徽农业大学动物传染病实验室建立的SYBR Green Ⅰ荧光定量PCR检测PRVgE基因的方法,对各脏器组织进行PRV载量的检测。
2 结果与分析
2.1 LD50的测定结果
1 3株PRV安徽分离株对小鼠的LD50在102.569~105.167TCID50之间,不同毒株对小鼠致病力大小各有差异,其中AH1802和AH1803对小鼠的致病力最强,LD50分别为102.569TCID50和102.833TCID50,AH1603和AH1703对小鼠的致病力最弱,LD50均为105.167TCID50(表1)。

表1 13株PRV安徽分离株对小鼠的LD50测定结果
2.2 病理剖检及病理组织学观察结果
在LD50的测定中,对照组小鼠均健活,试验组小鼠死前出现精神沉郁、食欲下降、呼吸加快等现象。部分小鼠出现典型的PR症状:奇痒、啃咬注射部位,致使局部被毛脱落、皮肤出血,随后四肢麻痹,倒地不起,最后衰竭死亡。剖检死亡小鼠可见肝、脾、肺、肾脏及脑等部位均有不同程度的出血、肿大,对照组无异常变化。病理组织HE检查结果如下。
2.2.1 脑部 对照组G结构正常,未见明显病理变化。试验组1A、3A未见明显病理变化;2A少量炎症细胞浸润;4A脑血管轻微充血;5A、7A、8A少量炎症细胞浸润;6A轻微病毒性脑炎;9A大量炎症细胞浸润,脑水肿;10A病毒性脑炎,大量炎症细胞浸润;11A病毒性脑炎,脑水肿;12A轻微脑炎,出血;13A病毒性脑炎,脑水肿(图1)。结果表明,AH1801、AH1802、AH1803感染小鼠脑组织病理变化较为严重。
2.2.2 肺脏 对照组G整体结构正常,肺泡结构清晰,肺泡壁无明显增厚,组织未见明显炎症细胞浸润。试验组1A轻微出血,少量炎症细胞浸润;2A炎症细胞浸润,肺泡壁增厚;3A少量炎症细胞浸润;4A肺动脉充血;5A炎症细胞浸润;6A、9A肺泡壁轻微增厚;7A肺泡腔变小;8A肺动脉血管充血,组织间隙轻微出血;10A肺脏出血、肺泡内出血;11A炎症细胞浸润;12A肺动脉充血,肺泡壁增厚;13A肺脏出血,弥漫性炎症细胞浸润(图2)。结果表明,AH1802、AH1803、AH1804、AH1805感染小鼠肺脏组织病理变化较为严重。

图1 各组小鼠脑组织病理组织学观察(HE染色,20×)

图2 各组小鼠肺脏病理组织学观察(HE染色,20×)
2.2.3 肝脏 对照组G整体结构正常,中央静脉轮廓清晰,肝细胞结构饱满,肝索沿着中央静脉放射状排列。试验组1A淤血;2A中央静脉充血;3A无特征性明显病变;4A肝窦间隙轻微增宽,组织少量炎症细胞浸润;5A少量炎症细胞浸润;6A炎症细胞浸润;7A出血,充血;8A少量炎症细胞浸润;9A充血;10A肝细胞排列紊乱,空泡性变性;11A炎症细胞浸润,肝水肿;12A肝窦间隙轻微增宽;13A少量炎症细胞浸润(图3)。结果表明,AH1702、AH1802、AH1803感染小鼠肝脏组织病理变化较为严重。
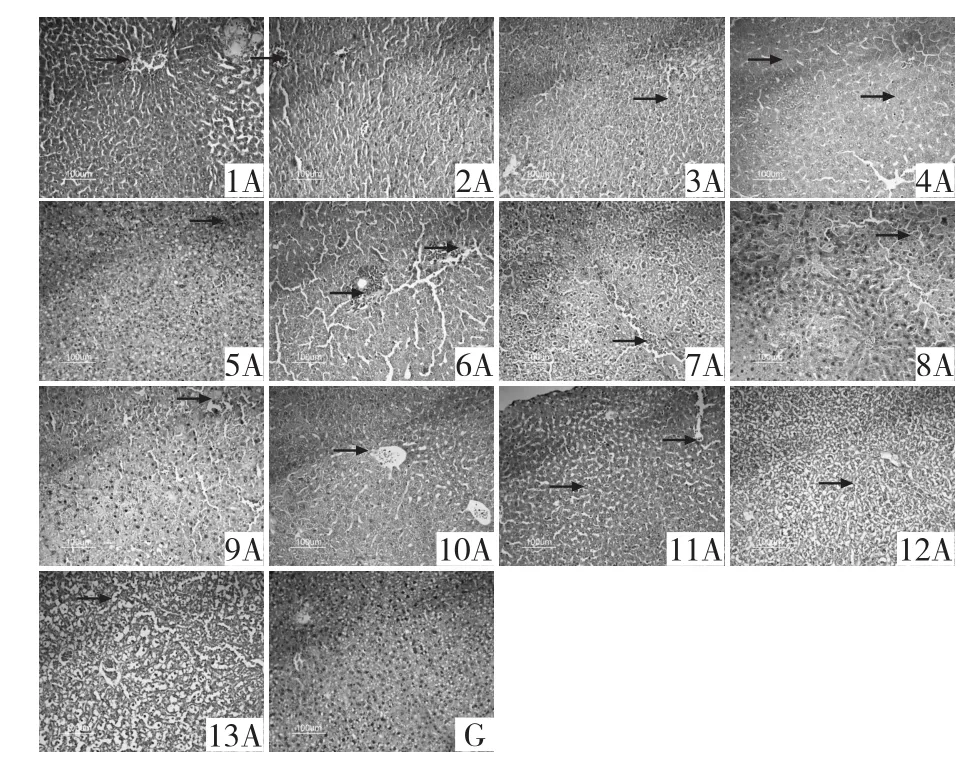
图3 各组小鼠肝脏病理组织学观察(HE染色,20×)
2.2.4 脾脏 对照组G整体结构正常,脾小结结构清晰,无明显增大缩小,红髓白髓界限分明,无明显坏死,淋巴细胞无明显变性坏死,组织未见明显中性粒细胞浸润。试验组1A、7A、9A无明显特征性病变;2A、3A、8A少量中性粒细胞浸润;4A淤血;5A出血;6A红细胞浸润;10A红髓白髓界限不清;11A中性粒细胞浸润;12A结缔组织增生;13A淋巴细胞增生,红细胞浸润(图4)。结果表明,AH1701、AH1802、AH1803感染小鼠脾脏组织病理变化较为严重。

图4 各组小鼠脾脏病理组织学观察(HE染色,20×)
2.2.5 肾脏 对照组G整体结构正常,未见肾小管上皮细胞明显脱落水肿,肾小球结构清晰可见,组织未见明显炎症细胞浸润。试验组1A少量炎症细胞浸润;2A、4A肾小管上皮细胞空泡性变性;3A血管充血,炎症细胞浸润;5A肾小球轻微出血;6A轻微出血;7A肾小管上皮细胞空泡性变性;8A无明显病理变化;9A组织间隙少量出血;10A出血;11A血管充血;12A肾小管上皮细胞空泡性变性,炎症细胞浸润;13A大量炎症细胞浸润,组织间隙轻微出血(图5)。结果表明,AH1703、AH1802、AH1803、AH1804感染小鼠肾脏组织病理变化较为严重。

图5 各组小鼠肾脏病理组织学观察(HE染色,20×)
2.3 感染小鼠各组织脏器中PRV载量的检测结果
13株PRV安徽分离株在感染小鼠各组织脏器中的病毒载量因不同毒株、不同脏器存在差异。试验组第1~9、12~13组肝脏病毒含量显著低于第10、11组(P<0.05),第10组显著低于第11组(P<0.05),第11组病毒含量最高;第1~9、12~13组脾脏病毒含量显著低于第10、11组(P<0.05),第11组显著低于第10组(P<0.05),第10组病毒含量最高;第1~6、8、9、11~13组肺脏病毒含量显著低于第7、10组(P<0.05),第7组显著低于第10组(P<0.05),第10组病毒含量最高;第2、3、5、8、9、11、13组间肾脏组织病毒含量以及第4、6、10、12组间肾脏组织病毒含量无显著差异(P>0.05),但均显著低于第7、1组(P<0.05),第7组与第1组差异不显著(P>0.05),第1组病毒含量最高;第1~7、9、12~13组脑组织病毒含量均显著低于第8、10、11组(P<0.05),第8组显著低于第10组(P<0.05),第10组显著低于第11组(P<0.05),第11组病毒含量最高。结果表明,AH1802和AH1803感染小鼠肝脏、脾脏、脑中的病毒含量显著高于其他11株(P<0.05),AH1703和AH1802在肺脏中的病毒含量显著高于其他11株(P<0.05),AH1703、AH1704和AH1804在脑和肺脏中的病毒含量均显著高于肝脏、脾脏和肾脏(表2)。

表2 13株PRV分离株攻毒后小鼠各组织病毒载量的测定结果 ng/μL
3 讨论
PR具有传播快、病死率高、流行范围广、传播途径多、病原体顽固等特点。自2011年以来,我国多省免疫过PRV基因缺失疫苗(Bartha-k61株)的猪群均出现PR疫情,其主要表现为突发性大面积母猪流产,肥育猪致死性感染,猪群gE抗体阳性率突然升高。有研究表明,此PR的暴发是由PRV变异株引起[9]。新的PRV流行株在多个基因位点发生了抗原变异,变异株与经典株属于两个不同的进化分支,且Bartha-k61株疫苗不能对变异株的攻击提供完全抵抗[10-11]。2012年以来,安徽省部分地区也相继发生PR。李春芬等[7]对2013—2017年安徽部分地区22 130份血清样品进行PRV-gE抗体检测,结果显示猪群PRV感染呈现逐年上升趋势。袁献宇等[8]从2016—2018年安徽临诊病例中共分离鉴定了15株PRV,其主要毒力基因核苷酸序列均与2011年国内PRV变异株同源性较高,变异株已成为安徽省主要的流行毒株。面对PRV变异株的广泛流行,对PRV变异株进行致病性研究,了解流行毒株的特征,对于提出科学有效的防制措施具有重要意义。
因PRV感染猪、羊及小鼠组织病理学病变相似,且小鼠感染PRV强毒株后病理变化明显[11],故本研究以小鼠为试验动物模型。PRV只有1个血清型,不同毒株在毒力和生物学特性等方面存在差异。本研究LD50测定结果显示,13株PRV的LD50在102.569~105.167TCID50之间,其中AH1802和AH1803的LD50分别为102.569TCID50和102.833TCID50,AH1603和AH1703的LD50均为105.167TCID50,表明PRV安徽分离株之间的毒力存在差异,AH1802和AH1803对小鼠的致病力最强,AH1603和AH1703对小鼠的致病力最弱。病理学结果显示,小鼠肝、脾、肺、肾脏和脑等部位均有不同程度的出血、肿大,但各组织的病变程度因不同毒株而异,其中AH1802、AH1803引起的病变较其他毒株严重,主要表现为病毒性脑炎、脑水肿,肺、肝脏出血、炎症细胞浸润,脾脏红白髓界限不清,大量炎症细胞浸润,肾脏出血等,进一步表明源自安徽不同地区的13株PRV毒力不同。
不同毒力PRV毒株感染后在机体内的分布存在差异,强毒株广泛分布于全身,而弱毒株和中等毒力毒株在体内的扩散只局限在中枢神经系统(central nervous system, CNS)[12]。本研究13株PRV经颈部皮下攻毒小鼠,试验组小鼠出现精神沉郁、食欲下降、呼吸加快等现象,部分小鼠出现奇痒、啃咬注射部位等典型PR症状后不久死亡;发病和死亡小鼠多个组织器官均出现明显病理变化,且从发病和死亡小鼠的脑部、肺脏、肝脏、脾脏、肾脏等组织均检测出PRV核酸,而对照组小鼠则均健活,且组织器官未呈现异常变化,表明13株PRV在发病和死亡小鼠体内分布广泛,对小鼠具有较强的致病性。
荧光定量PCR检测结果显示,13株PRV在感染小鼠各组织中的病毒载量因不同毒株、不同脏器而各有不同,其中AH1802和AH1803感染小鼠在脑、肝脏、脾脏中的病毒载量显著高于其他11株(P<0.05),AH1703和AH1802在肺脏中的病毒载量显著高于其他11株(P<0.05),AH1601在肾脏中的病毒载量最高,AH1703、AH1704和AH1804在脑和肺脏中的病毒载量显著高于肝脏、脾脏和肾脏,这或与毒株来源于不同地区、毒株本身发生变异和PRV在小鼠内的侵染途径不同有关,究其原因需要进一步地深入研究。
综上表明13株PRV均对小鼠具有较强的致病性,且AH1802和AH1803对小鼠的致病性强于其他毒株。针对PR的防控策略,在重视和加强疫苗免疫的基础上,加强毒株遗传变异研究,针对性地进行疫苗研发才是控制PR的关键。本研究不仅丰富了安徽PR流行病学资料,为进一步研究PRV安徽分离株的抗原性奠定基础,也为安徽地区PR的有效防控提供了科学依据。
