三叶青黄酮对荷Lewis肺癌小鼠免疫功能及肿瘤组织凋亡相关蛋白的影响
2021-02-01林钰久柴树人龙坤兰石冀敏徐静静
林钰久,柴树人,龙坤兰,陈 骏,石冀敏,徐静静*
1电子科技大学医院,成都 610054;2浙江省宁波市中医院,宁波 315000
肺癌是一种常见的恶性肿瘤,据2018年全球数据统计,男性肺癌的发病率和死亡率均位于恶性肿瘤首位,女性肺癌的发病率位于第3位,死亡率仅次于乳腺癌[1]。目前,肺癌的治疗主要采用等化疗来控制病情发展,延长生存期[2]。顺铂是临床常用的一种化疗药物,但研究显示,随着顺铂的长期使用以及剂量的增加,会出现不同程度的恶心、呕吐、脱发、免疫抑制等毒副作用[3]。研究肺癌的发病机制,寻找有效的治疗药物,提高患者的生活质量,成为了当前的研究热点。三叶青黄酮是从传统中药三叶青中提取的一种黄酮类化合物,具有抗炎、抗氧化等作用,对于心肌缺血、高血压、心绞痛等具有良好的治疗效果[4]。近年来研究显示[5],三叶青黄酮具有抗肿瘤活性,不仅可以促进机体的免疫功能,还可以通过调节细胞内相关细胞因子的分泌,发挥抗肿瘤作用。但三叶青黄酮调节肺癌患者免疫功能以及诱导肿瘤组织凋亡的机制尚未明确。因此,本研究探索了三叶青黄酮对荷Lewis肺癌小鼠免疫功能及其肿瘤组织凋亡的影响,旨在为临床研究提供一定的理论基础。
1 材料与方法
1.1 仪器、试剂与动物
FACSCanto II流式细胞仪(美国BD公司);Lewis肺癌细胞株(中国科学院(上海)细胞库);顺铂(齐鲁制药有限公司,国药准字H20023461);三叶青黄酮(浙江省中药新药研发重点实验室);转化生长因子(transforming growth factor,TGF-β)、白介素-2(interleukin,IL-2)和IL-10检测试剂盒(上海歌凡生物科技有限公司);TUNEL检测试剂盒(上海嵘崴达实业有限公司);B细胞淋巴瘤/白血病-2(B-cell lymphoma-2,Bcl-2)、BCL2相关X蛋白(B-cell lymphoma-2 associated X protein,Bax)、裂解的半胱氨酸天冬氨酸蛋白酶3(cleaved Caspase-3)(美国Santa Cruz公司);辣根过氧化酶(horseradish peroxidase,HRP)标记羊抗兔IgG(丹麦DAKO公司)。
60只SPF级C57BL/6J雌性小鼠,6~8周龄,体重均为20±2g,由北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2015-0001,饲养于本院动物中心实验室,保持室温恒定为25 ℃,自由摄食与饮水。
1.2 Lewis肺癌细胞悬液的制备
采用含10%胎牛血清的DMEM培养液将冻存Lewis肺癌细胞复苏,于37 ℃、5%CO2条件下培养至对数期,制成细胞悬液(1×107个/mL),取0.2 mL细胞悬液接种于小鼠右侧腋窝皮下,接种10天后,脱颈处死小鼠,无菌剥取瘤组织,匀浆,过滤,制成细胞悬液。
1.3 动物造模及给药
小鼠预饲养1周后,随机选取其中50只小鼠进行造模,采用右侧腋窝皮下注射0.2 mL Lewis肺癌细胞悬液(1×107个/mL)复制荷Lewis肺癌小鼠模型[6],若造模后1周,肉眼可见瘤组织,则为造模成功,将造模小鼠随机分为模型组、三叶青黄酮高、中、低剂量组和顺铂组各10只,另设10只小鼠为对照组,于右侧腋窝皮下注射0.2 mL生理盐水。接种肿瘤细胞24 h后,三叶青黄酮高、中、低剂量组灌胃0.2 mL三叶青黄酮(剂量依次为100、50、25 mg/mL),1次/天,顺铂组腹腔注射0.5 mL顺铂(剂量为0.2mg/mL),2次/天,模型组和对照组灌胃等体积生理盐水,各组均连续干预14天。末次给药后,处死小鼠,收集血液,无菌分离肿瘤组织、脾脏和胸腺。
1.4 观察各组小鼠的移植瘤体积和重量
剥离小鼠移植瘤组织,测移植瘤长径、短径,计算其肿瘤体积=(长径×短径2)/2,同时称取移植瘤重量,计算抑瘤率=(1-实验组肿瘤组织重量/对照组肿瘤组织重量)×100%。
1.5 HE和TUNEL染色检测肿瘤组织病理变化
取小鼠移植瘤组织,进行常规切片制作,一份用于HE染色,在光镜下观察组织的病理变化,每张切片随机取5个视野拍照;另一份用于TUNEL染色,观察移植瘤组织细胞的凋亡情况,严格按照试剂盒说明操作。
1.6 Western blot检测移植瘤组织凋亡相关蛋白的表达
取小鼠移植瘤组织,匀浆,使用细胞裂解液严格按照蛋白裂解步骤提取总蛋白,BCA法进行蛋白定量、依次SDS-PAGE凝胶电泳,电转膜至PVDF膜、室温密封2 h,洗膜并加一抗(Bcl-2、Bax和cleaved Caspase-3,稀释比例均为1∶1 000)4 ℃孵育过夜,洗膜加HRP标记的二抗(稀释比例为1∶5 000)室温孵育2 h。再用电化学发光显示,凝胶成像系统分析条带强弱,选用β-actin作为内参。
1.7 检测各组小鼠的胸腺指数和脾脏指数
取小鼠胸腺和脾脏组织,用Hanks液冲洗干净后滤纸印干,称取胸腺和脾脏的质量,计算小鼠胸腺指数和脾脏指数。
1.8 ELISA检测外周血IL-2、IL-6和IL-10水平
分离腹主动脉血液,抗凝离心(3 000 rpm,5 min),弃上清,采用ELISA法检测血浆IL-2、IL-6和IL-10水平。
1.9 流式细胞仪分析外周血调节性T细胞(Regulatory T cells,Treg)比例
分离腹主动脉血液,采用淋巴细胞分离液分离外周血单个核细胞,PBS重悬后,加入FITC抗CD25mAb和APC抗CD4mAb各20 μL,避光孵育20 min,加入配比好的破膜剂,加入PE抗Foxp3mAb,避光孵育20 min,上机流式细胞仪检测,分析Treg细胞比例。
1.10 统计学分析
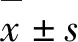
2 结果
2.1 三叶青黄酮对各组荷瘤小鼠移植瘤体积和重量的影响
与模型组相比,三叶青黄酮高、中剂量组和顺铂组荷瘤小鼠的肿瘤体积和肿瘤质量明显降低(P<0.05),且随着三叶青黄酮剂量升高,其作用明显增强(P<0.05);顺铂组相比,三叶青黄酮高、中剂量组荷瘤小鼠的肿瘤体积、肿瘤质量和抑瘤率明显升高(P<0.05)(见表1)。
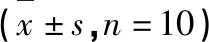
表1 各组小鼠移植瘤的体积和重量
2.2 HE染色观测各组荷瘤小鼠移植瘤组织的病理变化
HE染色结果显示,对照组和三叶青黄酮低剂量组小鼠移植瘤组织细胞结构较为完整,未见明显病理变化;三叶青黄酮高、中剂量组和顺铂组移植瘤组织细胞可见明显细胞坏死,核固缩(见图1)。
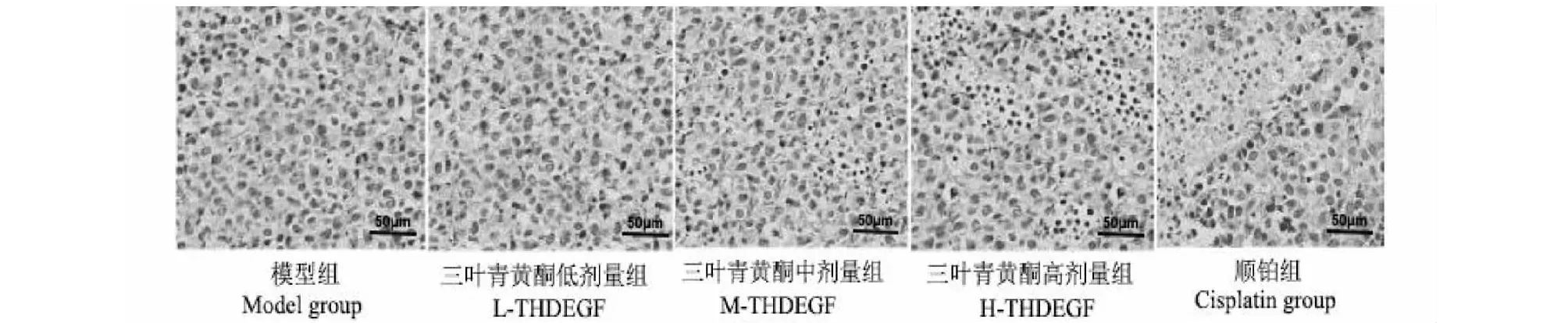
图1 HE染色观测各组荷瘤小鼠移植瘤组织的病理变化(×200)Fig.1 Pathological changes of transplanted tumor tissues of tumor-bearing mice in each group were observed by HE staining (×200)
2.3 三叶青黄酮对各组荷瘤小鼠移植瘤组织凋亡及相关蛋白的影响
与模型组相比,顺铂组、三叶青黄酮高、中剂量组移植瘤组织细胞凋亡率明显升高(P<0.05),Bcl-2的表达明显下降(P<0.05),Bax和cleaved Caspase-3的表达明显升高(P<0.05),且随着三叶青黄酮剂量升高,其作用明显增强(P<0.05);与顺铂组相比,三叶青黄酮高、中剂量组移植瘤组织细胞凋亡率明显下降(P<0.05),Bcl-2的表达明显升高(P<0.05),Bax和cleaved Caspase-3的表达明显下降(P<0.05)(见图2、表2)。
2.4 三叶青黄酮对各组荷瘤小鼠胸腺指数和脾脏指数的影响
与对照组相比,模型组、三叶青黄酮中、低剂量组荷瘤小鼠的胸腺指数和脾脏指数明显降低(P<0.05),与模型组相比,三叶青黄酮高、中剂量组和顺铂组荷瘤小鼠的胸腺指数和脾脏指数明显升高(P<0.05),且随着三叶青黄酮剂量升高,其作用明显增强(P<0.05);与顺铂组相比,三叶青黄酮高、中剂量组荷瘤小鼠的胸腺指数和脾脏指数无明显差异(P>0.05)(见表2)。
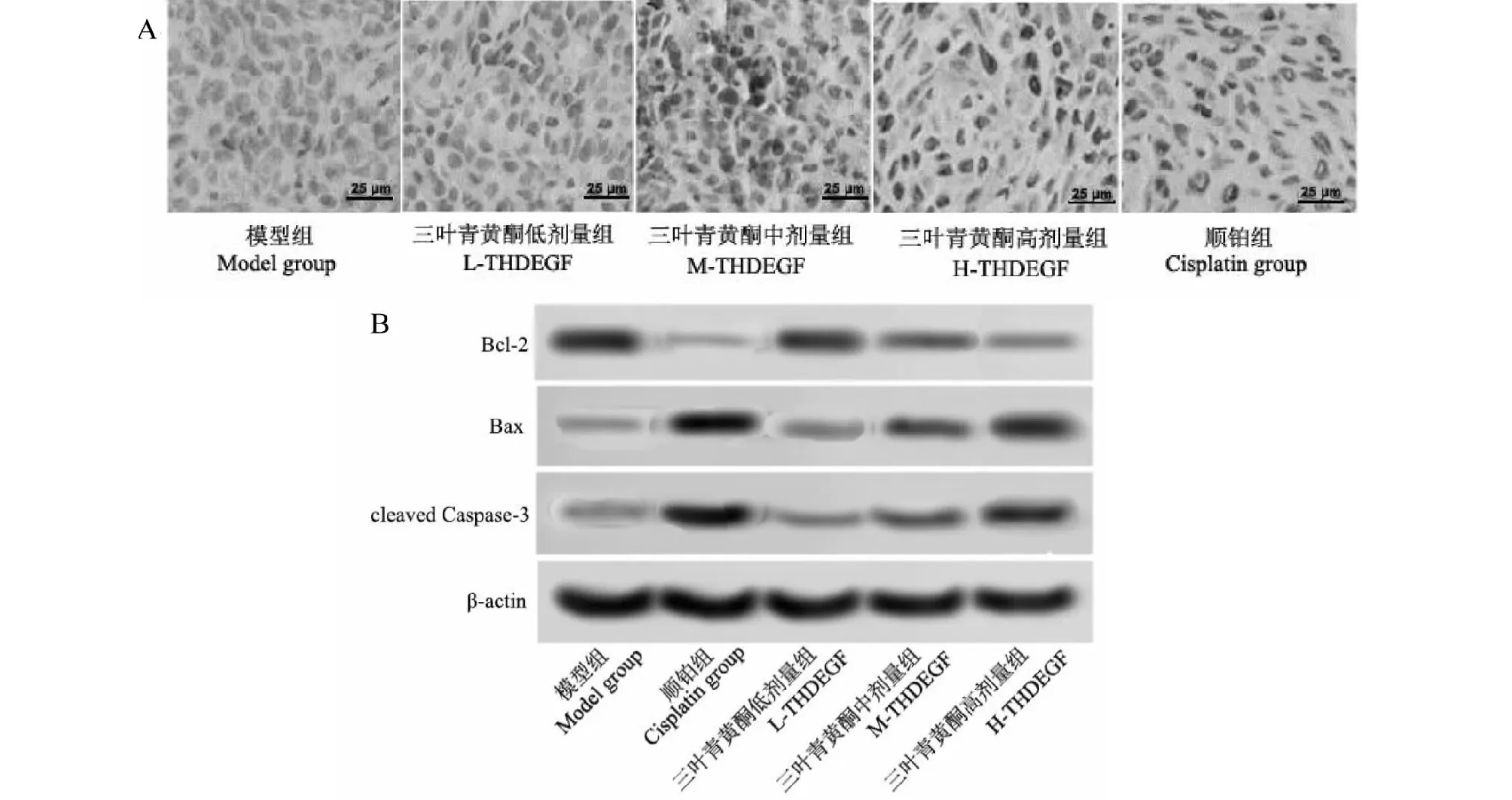
图2 三叶青黄酮对各组荷瘤小鼠移植瘤组织凋亡的影响(×400)Fig.2 Effect of flavonoids on apoptosis of transplanted tumor tissues of tumor-bearing mice in each group (×400)注:A:TUNEL检测移植瘤组织细胞凋亡;B:Western blot检测凋亡相关蛋白的表达。Note:A:Apoptosis of transplanted tumor tissue detected by TUNEL;B:Expression of apoptosis-related proteins detected by Western blot.
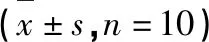
表2 三叶青黄酮对各组荷瘤小鼠移植瘤组织凋亡及相关蛋白的影响
2.5 三叶青黄酮对各组荷瘤小鼠外周血细胞因子的影响
与对照组相比,模型组、顺铂组、三叶青黄酮高、中、低剂量组外周血IL-2水平明显下降(P<0.05),IL-10和TGF-β水平明显升高(P<0.05);与模型组相比,顺铂组、三叶青黄酮高、中剂量组外周血IL-2水平明显升高(P<0.05),IL-10和TGF-β水平明显下降(P<0.05),且随着三叶青黄酮剂量升高,其作用明显增强(P<0.05);与顺铂组相比,三叶青黄酮高、中剂量组外周血IL-2、IL-10和TGF-β水平无明显变化(P>0.05)(见表4)。
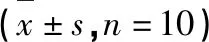
表3 三叶青黄酮对各组荷瘤小鼠胸腺指数和脾脏指数的影响
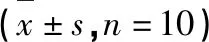
表4 三叶青黄酮对各组荷瘤小鼠外周血细胞因子的影响
2.6 三叶青黄酮对各组荷瘤小鼠外周血Treg细胞的影响
与对照组相比,模型组、顺铂组、三叶青黄酮高、中、低剂量组外周血CD4+CD25+Foxp3+Treg细胞所占比例明显升高(P<0.05);与模型组相比,顺铂组、三叶青黄酮高、中剂量组外周血CD4+CD25+Foxp3+Treg细胞所占比例明显降低(P<0.05),且随着三叶青黄酮剂量升高,其作用明显增强(P<0.05);与顺铂组相比,三叶青黄酮高剂量组外周血CD4+CD25+Foxp3+Treg细胞所占比例明显降低(P<0.05),三叶青黄酮中剂量组外周血CD4+CD25+Foxp3+Treg细胞所占比例明显升高(P<0.05)(见图3、表5)。
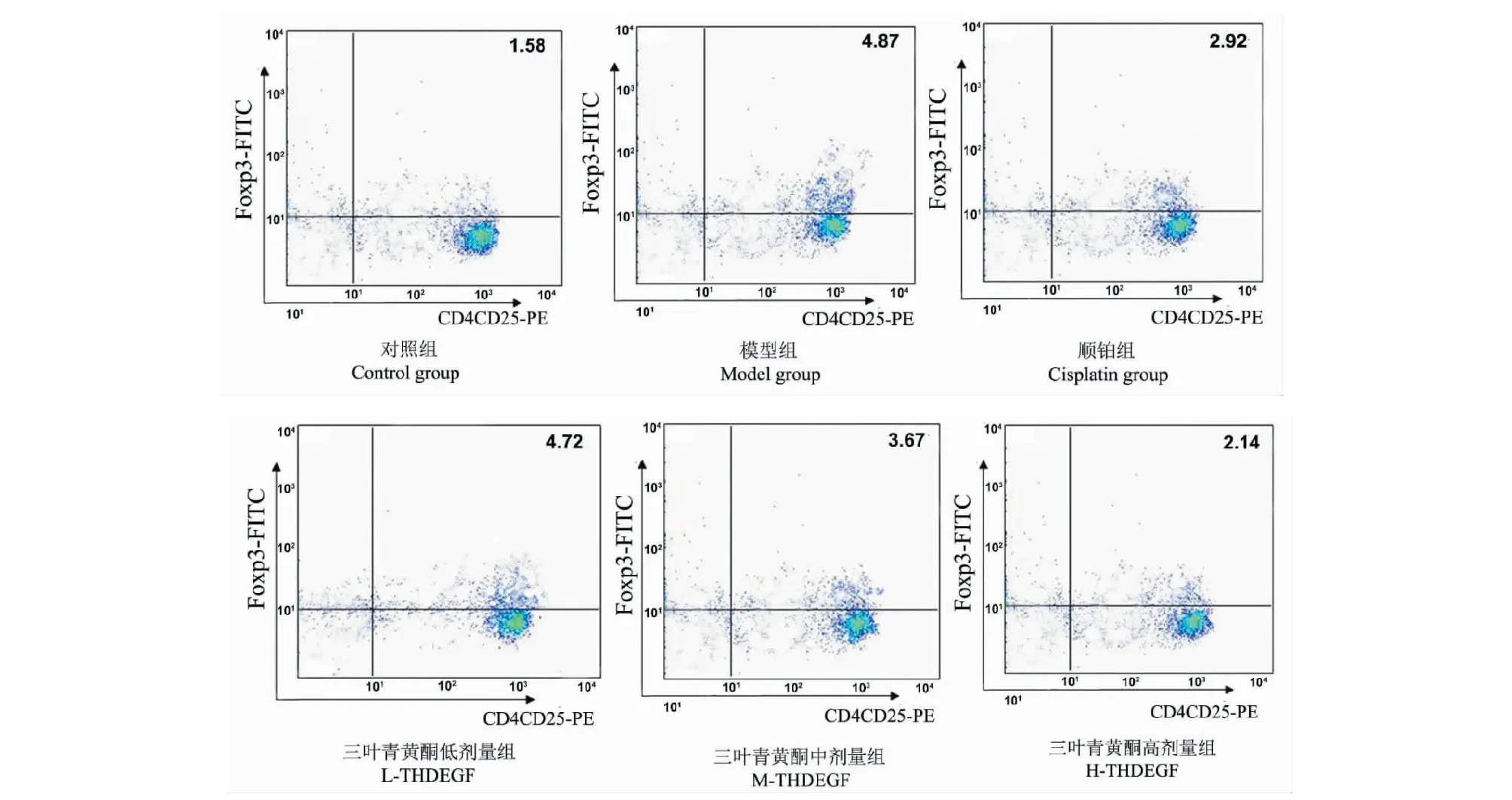
图3 三叶青黄酮对各组荷瘤小鼠外周血Treg细胞的影响Fig.3 Effect of flavonoids on Treg cells in peripheral blood of tumour-bearing mice in each group
表5 三叶青黄酮对各组荷瘤小鼠外周血Treg细胞的影响
3 讨论
Lewis肺癌细胞是小鼠来源的肺腺癌细胞,常用于临床试验,研究药物治疗的临床疗效[7]。顺铂是临床最常用的化疗药物之一,对于肺癌、恶性淋巴瘤、食管癌等多种恶性肿瘤均有一定的临床疗效,但顺铂的毒副作用大大限制了其临床应用。因此,本研究采用Lewis肺癌细胞建立荷瘤小鼠模型,以顺铂为阳性对照,来研究药物治疗的临床疗效。三叶青黄酮是从传统中药三叶青中提取的一种黄酮类化合物,研究显示[8],三叶青黄酮具有良好的抗肿瘤活性,可以提高机体的免疫力,发挥抗肿瘤的作用,但其具体的作用机制尚不清楚。本研究中,高、中剂量的三叶青黄酮可以明显降低移植瘤组织的体积和重量,诱导肿瘤坏死,且随着剂量的增加,其作用逐渐增强,但高剂量三叶青黄酮的抑瘤率仍低于顺铂,提示三叶青黄酮可以呈剂量依赖性的降低移植瘤组织的体积和重量,但其作用效果明显低于顺铂。Cheng等[9]的研究显示,三叶青黄酮具有抗炎、抗肿瘤、免疫调节等作用,有望应用于临床抗肿瘤治疗,提高化疗疗效,提示三叶青黄酮有望应用于临床辅助治疗。
本研究中,高、中剂量的三叶青黄酮可以明显上调移植瘤组织cleaved Caspase-3的表达,降低Bcl-2/Bax的表达,提高移植瘤组织细胞的凋亡率,且随着剂量的增加,其作用逐渐增强,但高剂量三叶青黄酮的促凋亡率仍低于顺铂,提示三叶青黄酮可以呈剂量依赖性的诱导肿瘤细胞凋亡。Bcl-2/Bax是一组调控线粒体途径介导的凋亡相关蛋白,一旦细胞接收到外部信号刺激时,胞质中的Bax会转位至线粒体细胞膜与Bcl-2形成异源二聚体,诱导细胞色素C的释放,激活Caspase凋亡级联反应,诱导细胞凋亡[10,11],提示三叶青黄酮可以调节凋亡相关蛋白的表达,诱导移植瘤组织凋亡。本研究中,高、中剂量的三叶青黄酮可以明显升高外周血IL-2水平,降低IL-10和TGF-β水平,随着剂量的增加,其作用逐渐增强,且高剂量的三叶青黄酮与顺铂作用后疗效相当。IL-2是由辅助性T细胞(Th)1细胞分泌的细胞因子,可以介导细胞免疫反应,IL-10是由Th2细胞分泌的细胞因子,主要调节体液免疫反应[12]。Zhang等[13]的研究显示,IL-10是由Th2细胞分泌的细胞因子,在维持机体正常的免疫应答中发挥着重要的作用,当其水平升高可拮抗Th1功能,抑制细胞免疫,提示三叶青黄酮可以降低IL-10水平,升高IL-2水平,提高机体的细胞免疫功能。TGF-β是由Treg细胞分泌的细胞因子,具有免疫抑制作用,可以促进肿瘤的发生发展。Kindlund等[14]的研究显示,TGF-β和IL-10是肿瘤细胞免疫逃避的主要调控因子,可以抑制细胞免疫功能,抑制肿瘤细胞凋亡,提示三叶青黄酮可以调节相关因子的表达,提高细胞免疫功能,发挥抗肿瘤效应。
本研究中,高、中剂量的三叶青黄酮可以明显降低Treg细胞比例,随着剂量的增加,其作用逐渐增强,且高剂量的三叶青黄酮作用效应强于顺铂。Treg是CD4+T细胞中的一类重要亚群,分为自然Treg(natural Treg,nTreg)和诱导Treg(induced Treg,iTreg),可以通过多种机制抑制免疫效应细胞的功能,是肿瘤免疫逃逸的关键[15]。nTreg主要通过直接接触发挥免疫抑制作用,iTreg主要通过分泌IL-10和TGF-β,发挥免疫负调控作用[16]。Foxp3是Treg细胞表面的一种分子标记蛋白,Foxp3+Treg可以表达CD4、CD25及转录因子Foxp3[17]。多项研究均表明[18,19],Foxp3基因可影响Treg细胞发育、分化和功能,Foxp3+Treg对可以调节免疫系统中的多种免疫细胞,发挥其免疫抑制作用。Miyabe等[20]研究发现,肿瘤细胞可以分泌趋化因子与其受体特异性结合,并趋化Foxp3+Treg至肿瘤局部,使肿瘤细胞逃脱宿主免疫系统监视,促进肿瘤的恶性发展,提示三叶青黄酮可以降低Treg细胞比例,抑制IL-10和TGF-β的分泌,抑制细胞免疫功能,发挥其抗肿瘤效应,且其免疫调节作用效应强于顺铂,有望应临床于临床辅助治疗,提高机体的免疫力,发挥其抗肿瘤效应。
综上所述,高、中剂量的三叶青黄酮可以明显降低外周血Treg细胞比例,升高IL-2水平,降低IL-10和TGF-β水平,调节移植瘤组织凋亡相关蛋白的表达,诱导移植瘤组织凋亡,抑制移植瘤的生长,有望应用于临床抗肿瘤治疗。但本研究尚处于基础研究阶段,尚需大量的临床试验来验证其临床疗效。
