基于网络药理学探讨丹参-丹皮配伍抗脑缺血损伤的作用机制
2021-02-01张娟利王文军黄少杰文爱东
张娟利,李 骅,王文军,黄少杰,马 阳,丁 一*,文爱东,*
1空军军医大学第一附属医院药剂科,西安710032;2陕西中医药大学药学院,咸阳712046
脑卒中(stroke)是一种突然起病的脑血液循环障碍性疾病,以发病率、死亡率及致残率高为特点,严重威胁着人类健康及生活质量[1]。目前治疗方法以早期溶栓恢复血流、实现血管再通为主,但大多数患者因受治疗时间窗或其他禁忌症的限制不能获得溶栓治疗。而以往针对单一靶点、单一环节的治疗药物由于不能完全、有效地阻断脑卒中的缺血级联反应,致使其在临床试验中屡遭失败[2]。中药具有多组分、多靶点及整体调节的优势特点,恰可以作用于脑卒中的多个病理环节,通过调整机体的自身修复功能而起到治疗作用,是研发抗脑缺血损伤药物新的突破点[3]。丹参(Salviae Miltiorrhizae,SM)、丹皮(Cortex Moutan,CM)药对,源自《施今墨对药临床经验集》,其中丹参善于活血化瘀,祛瘀生新,丹皮长于清热凉血,活血散瘀。两者相须为用,同气相求,是活血化瘀的经典药对。临床研究表明,丹参-丹皮药对及其组成的多种制剂(双丹口服液,丹膝颗粒等)在防治脑血管疾病方面发挥着重要作用,但至今丹参-丹皮治疗脑卒中的药效物质基础及作用机制尚未完全阐明,限制了其临床推广和二次开发。
近年来网络药理学(network pharmacology)在国际上兴起,它通过运用各大数据库进行药物与疾病相关靶点信息的搜集、预测与筛选,构建“药物-基因-靶点-疾病”网络,从整体的角度去揭示药物与疾病的关联性,这与中医药整体观与辩证论治的原则不谋而合,因而被广泛应用于中药药效物质筛选和作用机制的研究[4]。分子对接技术(molecular docking)通过模拟小分子配体与蛋白受体的相互作用方式、结合能等预测药物与受体之间结合的稳定性,是药物虚拟筛选的重要手段[5]。基于此,本研究采用网络药理学和分子对接方法探讨丹参和丹皮有效成分配伍抗缺血性脑损伤的作用机制,为该药对的药效成分筛选和进一步研究提供理论依据。
1 材料
本研究使用的数据库、分析平台及软件相关信息见表1。

表1 数据库、分析平台及软件相关信息
2 方法
2.1 丹参-丹皮化学成分的构建与筛选
登录中药系统药理学分析平台TCMSP,分别以“丹参”和“牡丹皮”为关键词检索其所有的化学成分,在此基础上,以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-like,DL)≥0.18作为活性成分的筛选条件,将符合条件的化合物信息录入Excel表格。此外,《中国药典》对两味药的质量控制成分以及明确的生物活性报道的化合物也被作为候选成分纳入分析。最后,采用ChemBioDraw Ultra软件绘制上述候选成分的化学结构,并以mol2格式保存。
2.2 丹参-丹皮相关靶点收集
将得到的候选成分去除重复后,在TCMSP分析平台检索候选成分的相关靶点,并通过UniProt数据库将候选成分的靶点名称转换为基因名称。
2.3 脑卒中靶点获取
以“stroke”为检索词分别在CTD、TTD和GeneCards数据库中检索疾病相关靶点,为了筛选高可信度的蛋白作为候选靶点,分别将CTD和GeneCards数据库的筛选条件设置为inference score≥70和relevance score≥20。合并3个数据库的检索结果,去除重复靶点后,最后通过UniProt数据库将脑卒中相关靶点名称标准化。
2.4 药物-疾病共同靶点的筛选与PPI网络构建
将丹参-丹皮成分靶点与脑卒中疾病靶点分别导入在线韦恩图Venny 2.1,可获得在线韦恩图和共有靶点信息。再将共同靶点导入STRING数据库,限定物种为“Homo sapiens”,minimum required interaction score≥0.7。获取蛋白质相互作用(PPI)信息,并导入Cytoscape软件进行拓扑分析和PPI网络图的构建。
2.5 基因富集分析
为了进一步了解共有靶点的功能以及在信号通路中的作用,利用R语言中的“ClusterProfiler包”对筛选的共有靶点进行GO功能和KEGG通路富集分析(P<0.05)。
2.6 网络的构建
准备候选成分及其对应靶点的数据文件,导入Cytoscape软件构建成分-靶点网络图,以探究丹参-丹皮活性成分的药理学作用机制;基于KEGG富集的前15条通路,反向筛选得到其对应的脑卒中靶点和活性成分,制作“成分-靶点-通路”的网络关系表,将其导入Cytoscape软件,构建丹参-丹皮治疗脑卒中的“成分-靶点-通路”图,以分析丹参-丹皮药对治疗脑卒中的作用机制。
2.7 分子对接验证核心成分和靶点
以“成分-靶点-通路”网络中度值较大的靶点及靶向成分为研究对象,进行分子对接验证。对接步骤如下:①从PDB数据库下载核心靶蛋白3D结构,运用PyMoL软件移除靶蛋白中的配体和非蛋白分子(如水分子),配体和蛋白均保存为pdb格式文件;②采用AutoDock Vina将靶蛋白、配体和mol2格式的化合物均转换为pdbqt格式文件;③以配体为中心寻找靶蛋白活性位点,记录设置Grid Box坐标和盒子大小,采用AutoDock Vina进行分子对接;④选取与靶蛋白对接结合能最高的成分,采用PyMoL软件可视化结果。
3 结果
3.1 “丹参-丹皮”活性成分的筛选
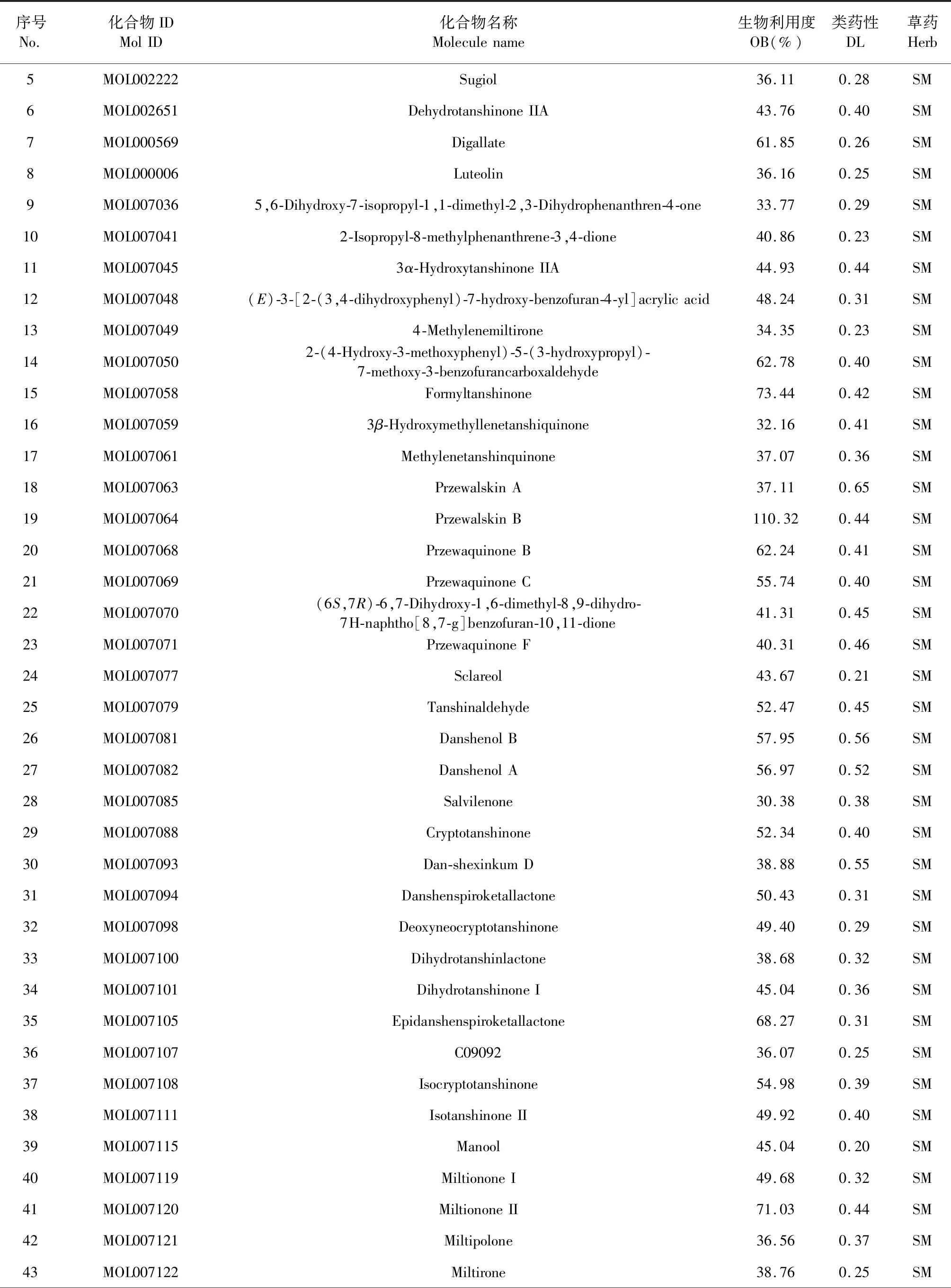
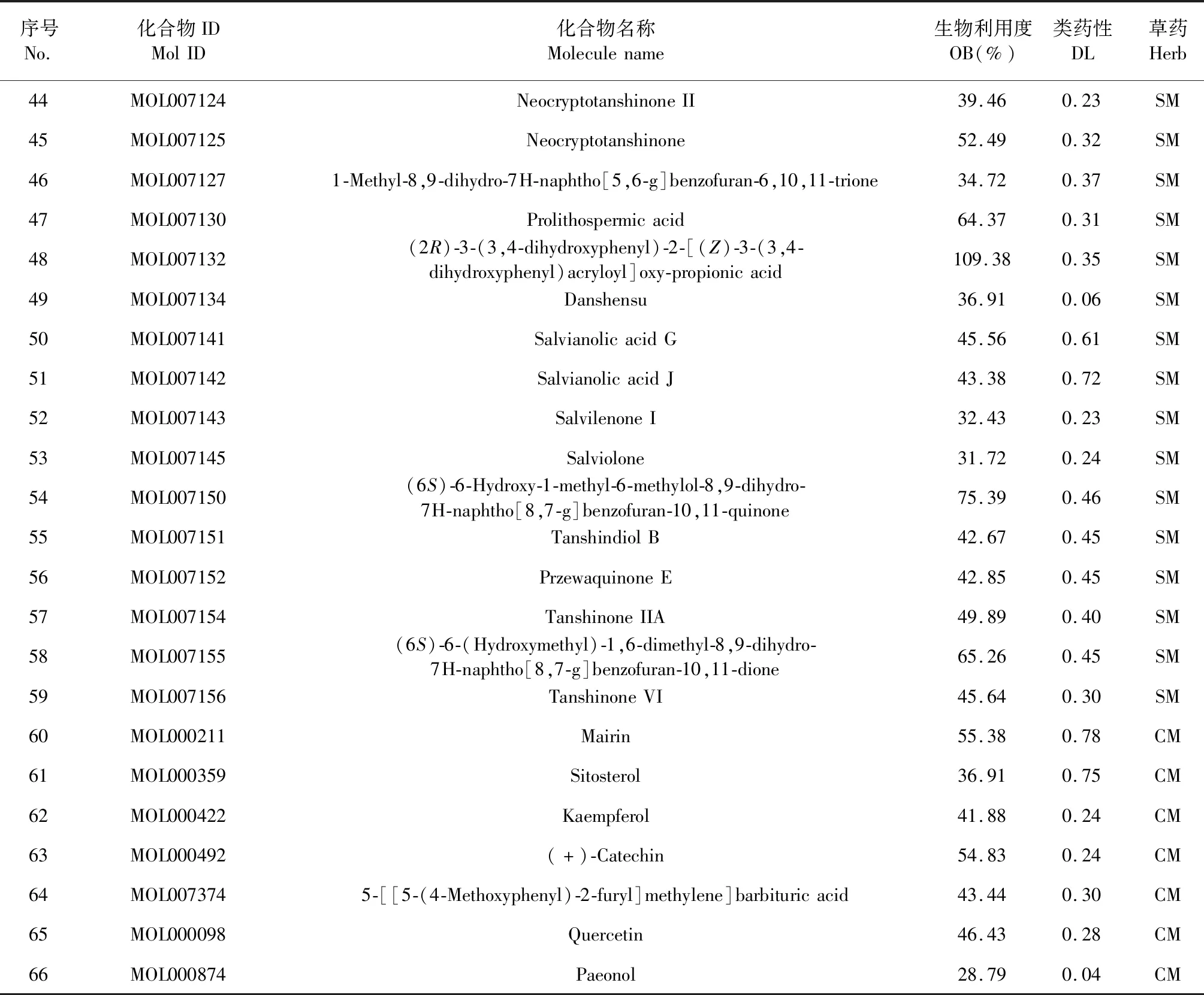
本实验共检索出丹参化学成分202个,牡丹皮化学成分55个,去除3个重复成分(咖啡酸、齐墩果酸和油酸)后,共得到丹参-丹皮相关成分254个。经OB≥30%,DL≥0.18筛选和《中国药典》检索质控成分,剔除无靶点成分后,总共得到66个丹参-丹皮候选成分,其中59个来自丹参,7个来自丹皮(表2)。

表2 “丹参-丹皮”经筛选得到的66个候选成分信息
续表2(Continued Tab.2)
续表2(Continued Tab.2)
3.2 “丹参-丹皮”成分靶点的筛选
通过对TCMSP数据库进行检索,共得到66个候选成分的相关靶点。其中56个丹参活性成分获得118个潜在作用靶点,7个丹皮活性成分获得160个潜在作用靶点,去除两药77个共有靶点,共得到“丹参-丹皮”成分靶点201个。最后通过Uniprot数据库将预测出的靶点蛋白名转换为基因名。
3.3 “丹参-丹皮”成分-靶点网络分析
如图1所示,丹参-丹皮药对成分-靶点网络共含有267个节点(66个候选成分和201个相关靶点)和921条边。运用Cytoscape中的NetworkAnalyzer功能进行网络拓扑分析,节点的度值(degree)为描述网络节点的重要指标。每个化合物的平均靶点为13.95个,每个靶点平均与3.05个化合物相互作用。从化合物角度分析,有17个成分的作用靶点≥20个,其中排名前10的分别是槲皮素(MOL000098)、山柰酚(MOL000422)、木犀草素(MOL000006)、丹参酮IIA(MOL007154)、丹皮酚(MOL000874)、隐丹参酮(MOL007088)、4-亚甲丹参新酮(MOL007049)、鼠尾草酚酮(MOL007145)、二氢丹参内酯(MOL007100)和异隐丹参酮(MOL007108)。从靶点的角度分析,有24个靶点与10个以上的化合物相互作用,其中排名前10的分别是PTGS2、ADRB2、NCOA1、SCN5A、CHRM1、PTGS1、ACHE、OPRM1、ADRA1A和RXRA。因此,丹参-丹皮药对存在单个成分与多个靶点相互作用,同时也存在单个靶点与多个成分相互作用的现象,进一步证实了丹参-丹皮药对具有多组分、多靶点协同增效的作用。
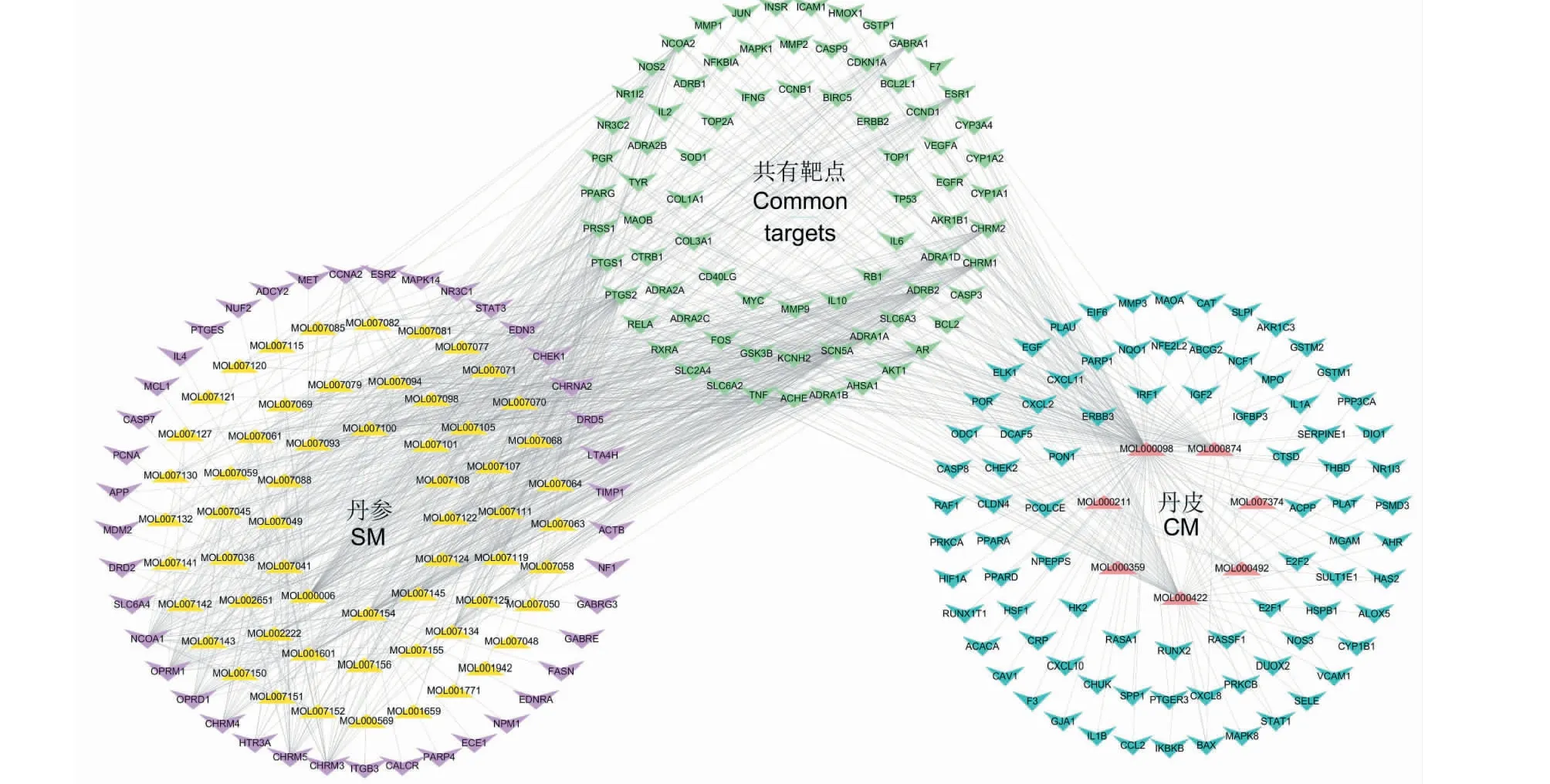
图1 “丹参-丹皮”成分-靶点网络Fig.1 The component-target network of SM-CM注:图中紫色节点为丹参活性成分;黄色节点为丹参成分靶点;红色节点为丹皮活性成分;蓝色节点为丹皮成分靶点;绿色节点为丹参和丹皮的共有靶点。Note:The purple nodes are the active components of SM;The yellow nodes are the targets of SM;The red nodes are the active components of CM;The blue nodes are the targets of CM;Green nodes are the common targets between SM and CM.
3.4 “丹参-丹皮”治疗脑卒中的靶点筛选及PPI网络分析
以“stroke”为关键词检索脑卒中相关靶点,从CTD数据库得到靶点152个,从TTD数据库得到靶点29个,从GeneCards数据库得到靶点112个,去除重复靶点后,最终得到脑卒中相关靶点222个。再将201个丹参-丹皮候选成分的靶点与222个脑卒中相关靶点取交集,得到67个共有靶点,证实丹参、丹皮可能通过多个潜在作用靶点协同发挥抗脑缺血损伤的作用(图2)。为了进一步探讨丹参-丹皮的成分靶点与脑卒中靶点在蛋白水平上的作用机制,将67个共同靶点导入STRING数据库进行PPI网络分析,再将分析结果导入Cytoscape 3.7.2绘制PPI网络(图3)。PPI网络图中共涉及66个节点(node),586条边(edge),PPI网路图中,节点根据度值从最低点以顺时针排列为圆形,节点越大、颜色越深代表其度值越大。其中,共有29个蛋白度值高于平均值,度值较大的靶点为AKT1、TNF、IL6、MAPK8、MMP9、TP53等,表明这些蛋白在网络中与其他蛋白相互作用较多,在PPI网络中扮演着重要的角色。
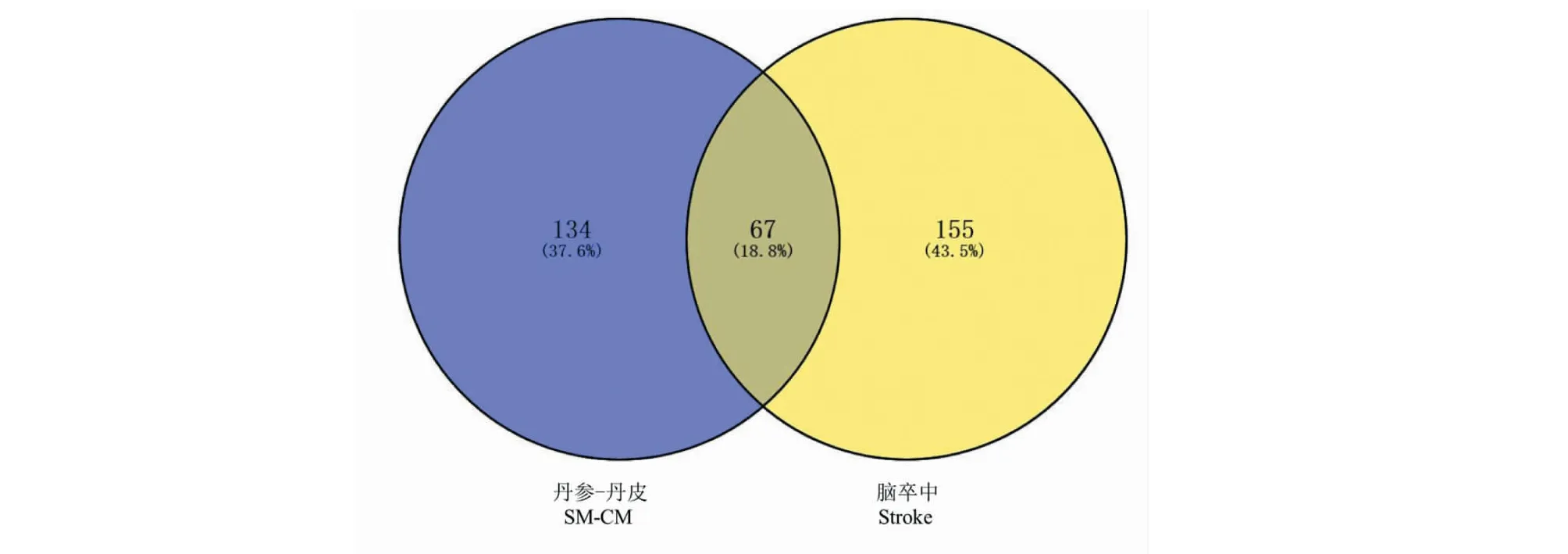
图2 “丹参-丹皮”靶点与脑卒中靶点Venn图Fig.2 Venn diagram of targets for SM-CM and stroke
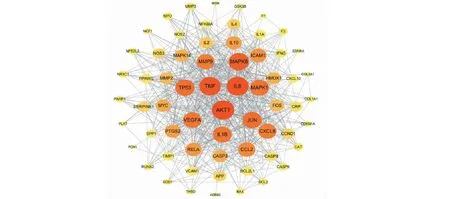
图3 “丹参-丹皮”共有靶点的PPI网络Fig.3 The PPI network of the common targets between SM and CM注:靶点度值随图形大小和颜色深浅变化。Node:The value of target degree changes with the size and color of the figure.
3.5 GO功能和KEGG通路富集分析
GO富集分析中共得到生物学过程(biological process,BP)1891个、分子功能(molecular function,MF)76个、细胞组分(cellular component,CC)31个。根据校正后P值进行排序,选择GO富集排名前15的BP条目绘制气泡图,见图4。图中气泡大小代表BP条目富集基因数目的多少,气泡颜色差异代表靶基因在各BP条目富集程度的高低。富集程度高且富集基因数目较多的生物学过程主要涉及脂多糖应答(response to lipopolysaccharide),细菌来源的分子反应(response to molecule of bacterial origin),氧化应激(response to oxidative stress)和营养水平应答(response to nutrient levels)等。此外,KEGG富集分析筛选得到149条(P<0.05)信号通路,主要涉及AGE-RAGE信号通路(AGE-RAGE signaling pathway)、流体剪切应力与动脉粥样硬化信号通路(Fluid shear stress and atherosclerosis)、IL-17信号通路(IL-17 signaling pathway)和TNF信号通路(TNF signaling pathway)等(表3)。
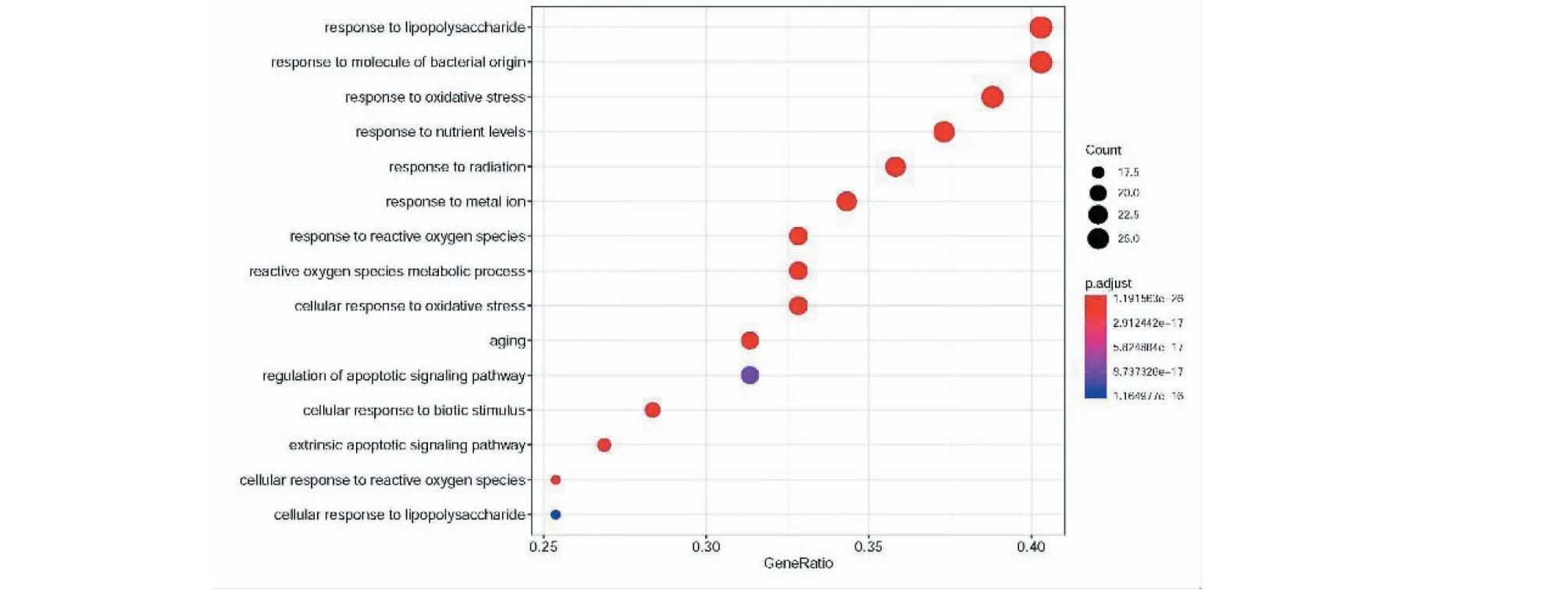
图4 “丹参-丹皮”GO富集分析中BP前15个功能Fig.4 TOP 15 function of BP in GO enrichment analysis of SM-CM
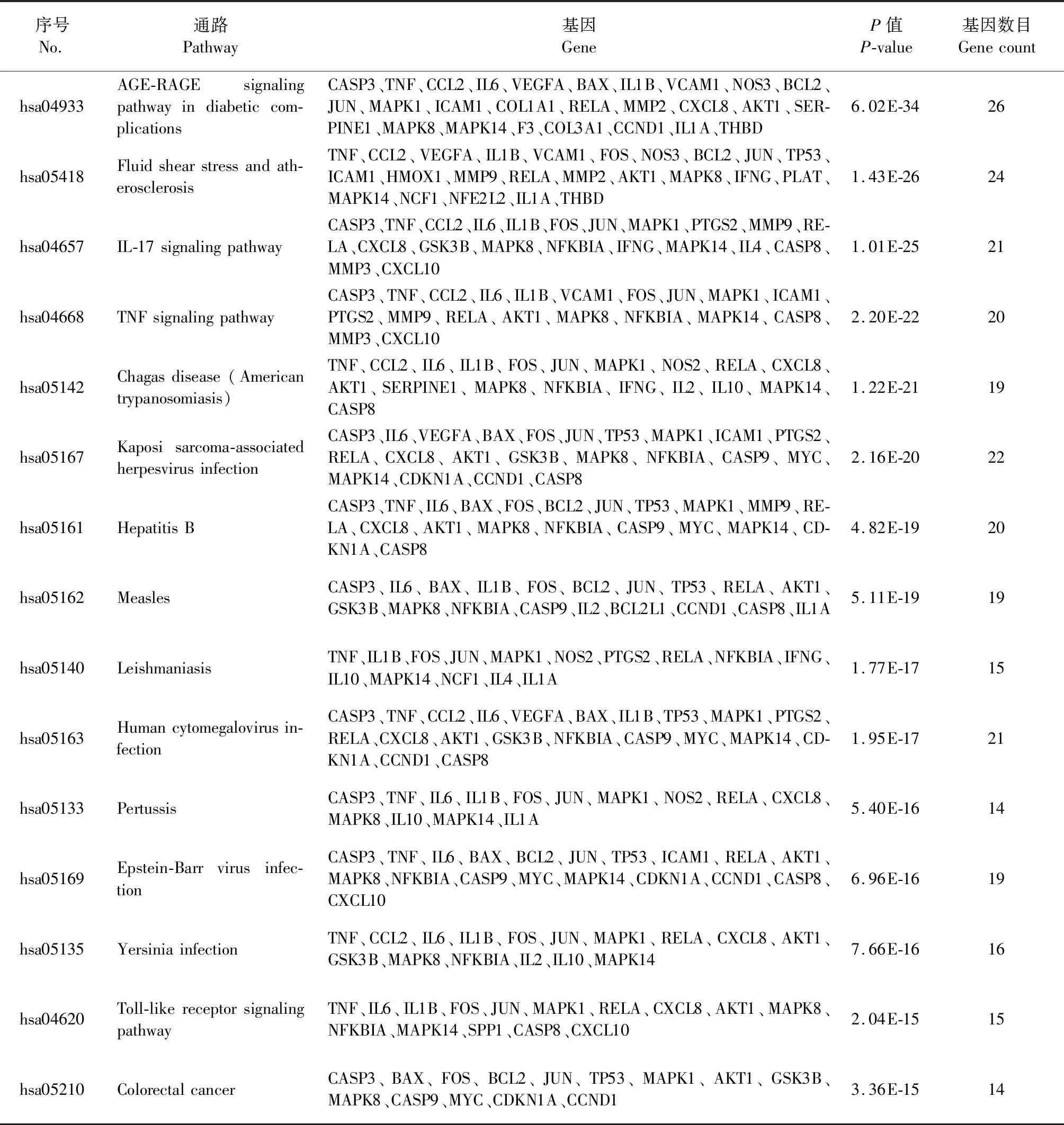
表3 KEGG通路富集分析排名前15的通路信息
3.6 丹参-丹皮“成分-靶点-通络”网络分析
基于KEGG富集分析的前15条通路,反向筛选得到其对应的49个脑卒中靶点和56个丹参-丹皮活性成分,制作“成分-靶点-通路”网络关系表,将其导入Cytoscape软件,构建丹参-丹皮治疗脑卒中的“成分-靶点-通路”图(图5)。其中度值较大的成分为槲皮素、木犀草素、山柰酚、丹参酮IIA、丹皮酚和隐丹参酮等,度值较大的靶点为PTGS2、RELA、TNF和AKT1等,提示这些成分和靶点可能为丹参-丹皮治疗脑卒中的关键成分和蛋白,表明丹参-丹皮可通过“多成分-多靶点-多通路”起到抗脑缺血损伤的作用。
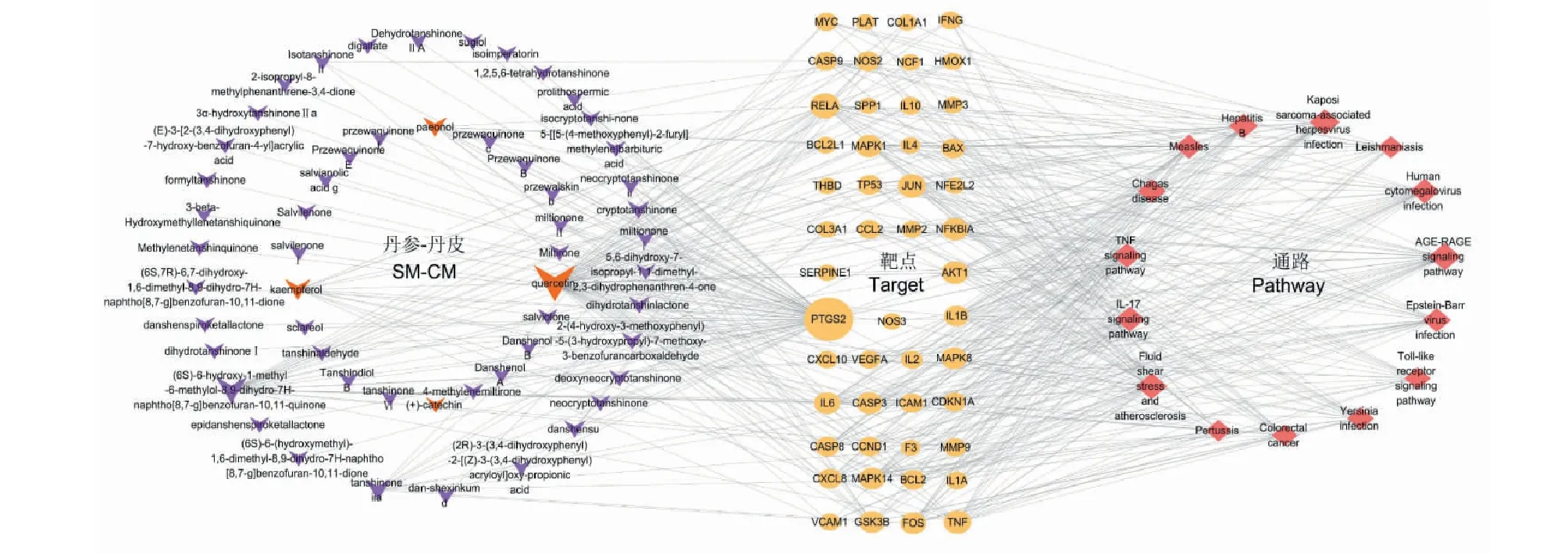
图5 “丹参-丹皮”成分-靶点-通路网络图Fig.5 The ingredient-target-pathway network of SM-CM注:图中紫色梭形节点为丹参活性成分;红色梭形节点为丹皮活性成分;橙色圆形节点为关键靶蛋白;玫红色菱形节点为关键信号通路。Note:Purple fusiform nodes are the active components of SM;The red fusiform nodes are active components of CM;The orange circular nodes are the key target proteins;The rose diamond nodes are the key pathways.
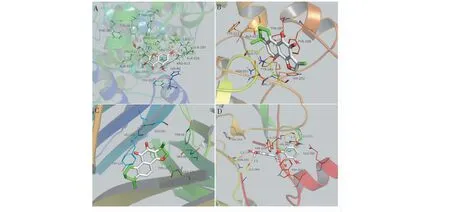
图6 “丹参-丹皮”核心成分与关键靶点的分子对接示意图Fig.6 Molecular docking pattern of main ingredients with key targets of SM-CM注:图6中A-D分别为山奈酚与PTGS2,丹参酮IIA与RELA,隐丹参酮与TNF,木犀草素与AKT1的分子对接图。Node:A-D in Figure 6 are kaempferol and PTGS2,tanshinone IIA and RELA,cryptotanshinone and TNF,luteolin and AKT1,respectively.
3.7 “丹参-丹皮”关键靶点的分子对接验证
一般认为配体与受体结合能越低,结合的构象越稳定,≤-4.25 kcal/mol说明两者有一定的结合活性,≤-5.0 kcal/mol说明两者有较好的结合活性,≤-7.0 kcal/mol说明两者有强的结合活性[6]。为验证本研究网络分析结果的准确性,选取“成分-靶点-通路”网络中度值较大的靶点PTGS2、RELA、TNF、AKT1为受体,分别以6个核心成分和4个靶蛋白的原始配体为对象,采用AutoDock Vina进行分子对接验证。对接结果如表3所示,丹参-丹皮6个核心成分与关键靶点的结合能均≤-5 kcal/mol,其中81%的成分与其靶点的结合能<-7.0 kcal/mol,表明成分与其靶点均具有较强的结合活性,特别是隐丹参酮和丹参酮IIA与RELA,木犀草素和槲皮素与AKT1比其与原始配体的结合活性还强。对接结果也进一步证实了网络药理学分析结果的可靠性(表4)。最后,我们利用Pymol软件对核心成分与PTGS2、RELA、TNF和AKT1靶点对接结合能较高的结果进行可视化处理,结果见图6。
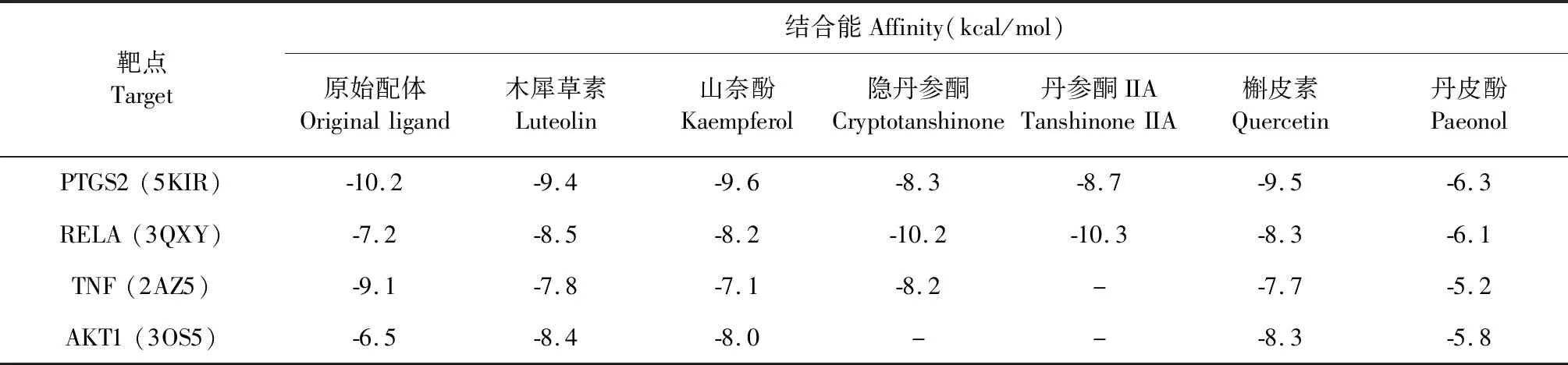
表4 “丹参-丹皮”核心成分与关键靶蛋白的对接结果
4 讨论
脑卒中属中医学“中风”范畴,中医认为中风之证有风、火、痰、瘀、虚之别,但瘀阻脑络是贯穿中风病始终的病理核心,故常用活血化瘀类中药治疗脑卒中,以消散体内瘀血,使新血复生、血脉畅通[7]。丹参、牡丹皮均为临床常用活血化瘀类药物,二者配伍具有活血化瘀、通络止痛的功效,由其组成的多种方剂在脑血管疾病的治疗中取得了较好的疗效,但具体药效物质和作用机制仍不清楚。本研究基于网络药理学和分子对接方法对丹参-丹皮治疗脑卒中的药效物质、潜在作用靶点和作用通路进行深入探究。
在“丹参-丹皮”成分-靶点网络中,筛选得到了66个候选活性成分,包括44个丹参酮类、13个酚酸类(含4个黄酮类)、3个甾醇类、3个萜类、呋喃香豆素类2个、巴比妥酸类1个,其中靶点较多的成分为丹参酮类(丹参酮IIA、隐丹参酮等)和酚酸类成分(槲皮素、山奈酚、丹皮酚等),这与文献报道丹参、丹皮的主要药效物质基础相一致[8-10]。同时,筛选得到了201个丹参-丹皮成分靶点,其中两药的共有靶点77个,涉及多个抗氧化、炎症、凋亡因子,证实了丹参-丹皮可通过多成分、多靶点发挥协同增效作用。
PPI网络分析表明,AKT1、TNF、IL6、MAPK8、PTGS2及RELA等炎症相关蛋白,均具有较高的度值,处于网络的中心位置,可能是丹参-丹皮发挥抗脑缺血损伤作用的关键靶点。其中,AKT1(丝氨酸/苏氨酸蛋白激酶),又称Protein Kinase B,在控制细胞增殖、存活和凋亡中发挥至关重要作用,能被多种上游细胞因子(如血管内皮生长因子等)激活,进而对缺血性损伤后的神经元发挥保护作用[11]。TNF(肿瘤坏死因子α)和IL6(白介素6)是两个非常重要的促炎因子,参与了机体免疫应答和炎症反应等多种病理过程,其与脑血管疾病的炎症过程密切相关,同时也是IL-17和TNF等信号通路的重要信号分子[12]。MAPK8(丝裂原活化蛋白激酶8,又称JNK1),属于MAP激酶和JNK家族成员,激活的JNK信号通路对细胞分化、凋亡、应激反应、炎症反应、缺血再灌注损伤等生理病理过程起着至关重要的调节作用[13]。PTGS2(前列素内环氧化物合成酶2),又称COX-2,作为重要的炎性介质存在于炎症初期到炎症形成的全过程,PTGS2的过表达可破坏内环境平衡,参与脑损伤后的炎症反应,并促进脑梗死面积的扩大[14]。RELA(转录因子p65)是NF-κB的一个亚单位,其翻译后修饰能够有效地调控NF-κB的转录激活,进而在炎症反应及其相关疾病的发生和发展过程中发挥重要的作用[15]。
为了进一步说明这些关键作用靶点在基因功能和信号通路中的作用,本研究进行了GO功能和KEGG通路富集分析。结果发现丹参-丹皮可能通过参与脂多糖应答、炎症反应、抗凋亡及氧化应激等生物学过程,在细胞膜、细胞质、细胞器部位,发生蛋白结合、磷酸化、转录因子激活等分子反应,进而调控AGE-RAGE信号通路、流体剪切应力与动脉粥样硬化信号通路、IL-17和TNF信号通路等发挥抗脑缺血损伤的作用。其中,IL-17和TNF均是重要的促炎症细胞因子,二者所介导的信号通路与脑卒中后的炎症反应密切相关[16]。而炎症反应在脑卒中的发生、发展以及后期恢复中均扮演着重要的角色,参与脑卒中病理损伤的全过程;同时,PTGS2、RELA、TNF、IL6、AKT1等关键靶点,大部分也显著富集在TNF信号通路和IL-17信号通路上,充分表明丹参-丹皮具有多靶点、多通路协同增效作用。
基于成分-靶点-通络网络,发现槲皮素、木犀草素、山柰酚、丹参酮IIA、丹皮酚和隐丹参酮等可能通过PTGS2、RELA、TNF和AKT1等关键靶点发挥抗脑缺血损伤的作用。研究表明槲皮素、山柰酚可通过抗脑缺血、抗自由基氧化、抑制炎症反应和细胞凋亡等对脑卒中患者起到神经保护作用[17,18]。丹参酮IIA和隐丹参酮对缺血再灌注脑损伤也具有保护作用,其机制可能与减轻缺血再灌注损伤炎症反应,减轻氧化性损伤和改善血脑屏障有关[19,20]。Liao等[21]研究发现,在大鼠MCAO模型中,丹皮酚表现出保护缺血脑组织的作用,其机理可能与抗自由基损伤有关。为了进一步验证网络药理学结果的可靠性,我们利用分子对接考察了核心成分和关键靶点的结合活性。结果表明筛选的6个核心成分与关键靶点PTGS2、RELA、TNF和AKT1的结合能均<-5 kcal/mol,表明它们具有较好的结合活性。其中槲皮素、山奈酚与PTGS2,隐丹参酮、丹参酮IIA与RELA,隐丹参酮与TNF-α,木犀草素、槲皮素与AKT1的结合能均<-7 kcal/mol,部分核心成分与靶蛋白甚至比其与原始配体的结合活性还强,表明这些成分与其对应靶点具有强的结合活性。
综上所述,本研究运用网络药理学和分子对接技术揭示了丹参-丹皮抗脑缺血损伤的药效物质、关键靶点及作用通路,并通过分子对接技术对筛选出的关键靶点进行了验证。发现丹参-丹皮可能通过槲皮素、木犀草素、山柰酚、丹参酮IIA、丹皮酚和隐丹参酮等活性成分,作用于PTGS2、RELA、TNF、IL6、AKT1等关键靶点,调节炎症反应、凋亡及氧化应激等生物学过程,进而调控IL-17和TNF等信号通路发挥抗脑缺血损伤的作用。研究结果不仅可为下一步研究丹参-丹皮药对抗脑缺血损伤的作用机制提供依据,也可为该药对及其组成方剂的临床应用与开发提供技术支撑。
