兔干眼细胞模型的建立与生物学特征评价
2021-02-01朱梦晨杨婷婷
李 玲,朱梦晨,李 点,杨婷婷,邱 婷,王 健
0引言
随着现代生活计算机、手机的普及,外界环境风沙、烟尘的侵袭,隐形眼镜和冷暖空调的广泛使用,干眼的发病率呈逐年升高趋势[1-2]。因此,对干眼发病机制与药物防治的研究具有重要的现实意义。基于泪腺细胞原代培养构建稳定的干眼细胞模型成为本课题组研究的首要工作,然而,干眼细胞模型虽有报道,但不尽详细,模型的稳定性也有待考究,不利于以原代泪腺细胞为工具的相关的基础和临床研究。因此,本研究使用原代培养兔泪腺上皮细胞,采用脂多糖(LPS)和肿瘤坏死因子-α(TNF-α)干预的方式构建干眼细胞模型,并通过免疫荧光、流式和ELISA方法,对原代细胞进行活性和纯度检测,并对比两种建模方式的差异,为进一步筛选干眼防治药物和评价药效学奠定基础。
1材料和方法
1.1材料新西兰白兔,雄性,12只,90日龄,1~1.2kg,普通级,由湖南中医药大学动物实验中心提供(SPF级)。湖南许可证号:SCXK(湘)2013-0004。饲养温度20~25℃,湿度50%~70%。所有动物实验操作均经过湖南中医药大学实验动物伦理委员会审议并通过。流式细胞仪(美国Beckman,coulter-cytexpert),细胞培养箱(美国Thermo,3111),台式高速冷冻离心机(美国Thermo),ELX800-酶标仪(美国Bio-tek,ELX800),微量移液器(德国Eppendorf);FBS、DMEM/F12的培养液购自美国Gibco,Ⅱ型胶原酶(V900892)、LPS(Sigma,L2880),TNF-α因子(美国Immunochemistry,6519),Pan-cytoeratin抗体(bs-1712R)、FITC-羊抗兔IgG(bs-0370R)、Annexin V-FITC细胞凋亡检测试剂盒(BA00101)、CCK-8细胞增殖-毒性检测试剂盒(Biosharp,BS350A)。
1.2方法
1.2.1完全培养液的配置取10mL FBS、40mL DMEM/F12基础培养基混合,配成含20%FBS的DMEM/F12完全培养液。Ⅱ型胶原酶:0.01gⅡ型胶原酶粉溶于基础培养基中定容至5mL,配制成2g/L应用液。
1.2.2泪腺上皮细胞的原代培养[3-4]随机选取1只雄兔,选用20%乌拉坦1.5g/mL耳缘静脉注射,在超净工作台上常规无菌操作,用眼科剪取出泪腺组织。置于培养皿中用含双抗的PBS清洗两遍,换成DMEM/F12基础培养基,剥离小血管及纤维结缔组织,并剪碎泪腺小组织块,整个过程在冰上操作。转移至15mL BD管中,1500r/min,离心5min去上清,加入5mLⅡ型胶原酶,置于摇床80r/min消化20~30min后加入完全培养液终止消化。1500r/min离心5min,弃部分上清,加入5mL 0.25%胰蛋白酶后于培养箱消化5min。终止消化后进行吹打并吸走絮片状组织块,经200目筛网过滤,1500r/min,离心5min去上清。加入含20% FBS的DMEM/F12完全培养基,制备细胞悬液。细胞按(4~6)×104cells/mL的密度接种于培养瓶,常规培养,12h后换液,以去除没有贴壁的细胞及碎片。此后每12h换液一次。
1.2.3免疫荧光法检测Pan-cytoeratin蛋白取第二代细胞,接种于预置在12孔板的爬片上,当细胞基本融合,及时取出作4%多聚甲醛固定30min。冷0.01mol/L PBS洗5min×3次,5%BSA封闭30min后,每孔加入一抗兔源Pan-cytoeratin(1∶200)50μL,4℃孵育过夜。PBS洗爬片5min×3次,吸水纸吸干多余液体后加入FITC标记抗兔IgG(1∶200),室温避光孵育1h,弃液,PBS洗5min×5次。细胞骨架罗丹明(1∶100)染色,避光孵育20min,弃液,PBS洗5min×5次。滴加DAPI(1∶200)避光孵育5min,弃液,PBS洗5min×8次。防荧光淬灭剂封片。检测泪腺上皮细胞特异性蛋白Pan-cytoeratin表达情况。
1.2.4干眼细胞模型[5]根据LPS和TNF-α的IC50值,结合预实验结果,分别选取LPS(10μg/mL)和TNF-α(2.5ng/mL)作为干预泪腺细胞的施加因素,干预12h后,处理细胞,收集样本,对相关炎性因子的细胞损伤关键元件进行检测,拟构建泪腺细胞的炎症微环境,模拟干眼的生物学特征,同步设空白对照组。
1.2.4.1药物IC50的测定泪腺细胞接种于96孔板(6000cells/well)。分别用不同浓度(0、5、10、20、40μg/mL)的LPS和TNF-α(0、2.5、5、10、20ng/mL)孵育12h。根据试剂盒说明书,使用CCK-8测定细胞毒性。在450nm处测量光密度(OD)。根据光密度(OD)计算细胞抑制率IR(%)=(对照-干预)/(对照-空白)×100%,以及IC50。选取半数IC50值作为干预浓度。
1.2.4.2流式细胞术检测各组细胞的凋亡情况泪腺原代细胞接种于6孔板(10000cells/well)中,采用上述细胞模型建立的不同干预方式处理12h后,收集各组细胞,按照Annexin V-FITC/PI试剂盒说明书,使用流式细胞仪检测各组细胞凋亡率。

图1 兔泪腺上皮原代细胞提取与培养 A:兔泪腺取材;B:兔泪腺上皮原代细胞镜下观察(×40);C:兔泪腺上皮原代细胞镜下观察(×100)。
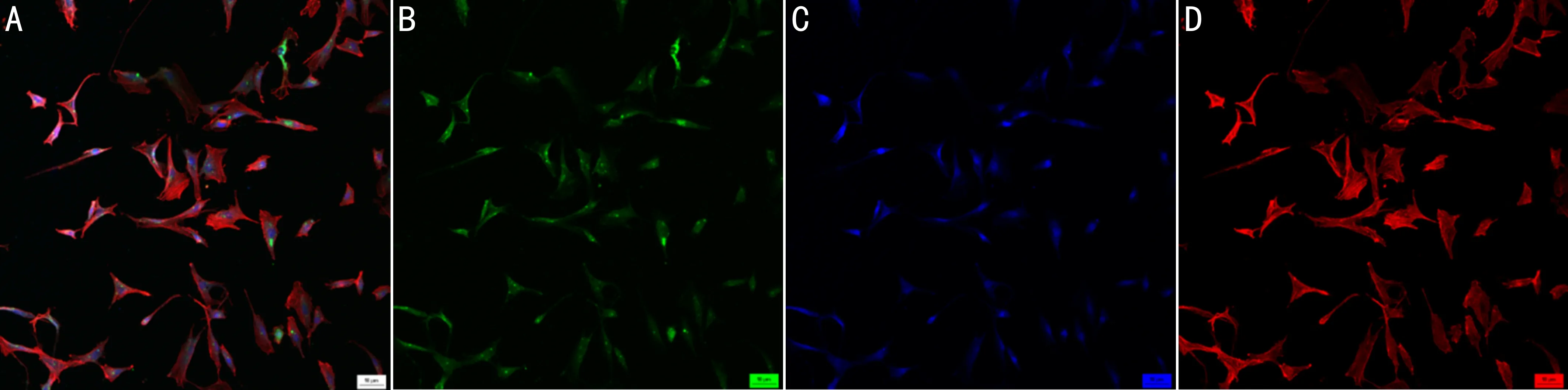
图2 兔泪腺上皮原代细胞标志蛋白Pan-cytoeratin的表达(×200) A:合成B+C+D;B:FITC标记Pan-cytoeratin蛋白;C:DAPI标记细胞核;D:罗丹明标记细胞骨架。
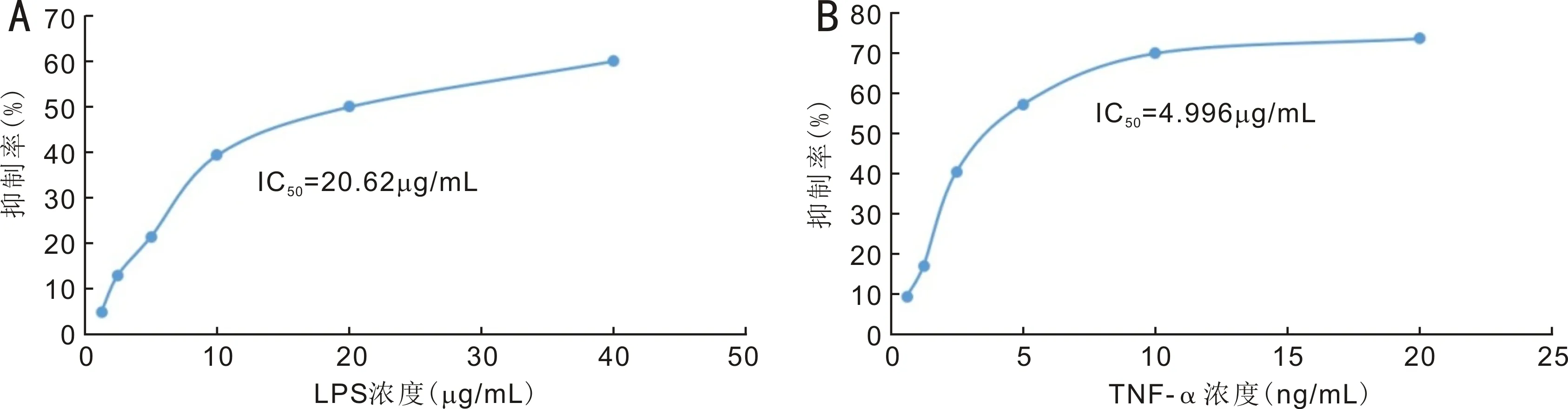
图3 LPS和TNF-α干预兔泪腺原代上皮细胞12h的IC50 A:LPS的IC50;B:TNF-α的IC50。
1.2.4.3 ELISA检测各组细胞上清液中相关炎性因子的含量泪腺原代细胞接种于6孔板(8000cells/well)中,采用上述细胞模型建立的不同处理方法,收集各组细胞上清液,按照ELISA试剂盒说明书,测定白细胞介素1β(IL-1β)和白细胞介素6(IL-6)的含量。

2结果
2.1兔泪腺上皮原代细胞培养情况原代培养12h后细胞基本贴壁,48h可见细胞形态舒展,呈长三角形。待细胞增殖至覆盖培养瓶70%~80%时进行胰蛋白酶消化传代。用CCK-8法检测细胞活性,达92%以上,见图1。
2.2免疫荧光法检测兔泪腺上皮原代细胞标志蛋白Pan-cytoeratin的表达免疫荧光结果显示:兔泪腺上皮原代细胞标志角化蛋白(Pan-cytoeratin)主要表达在细胞质,且阳性率>90%,符合实验要求,见图2。
2.3 LPS和TNF-α的IC50结果CCK-8结果显示:LPS和TNF-α干预兔泪腺上皮细胞12h的IC50分别为20μg/mL、4.996ng/mL,拟后续两种方法制备兔干眼细胞模型时,选择LPS的0.5倍,即10μg/mL和TNF-α的0.5倍IC50,即2.5ng/mL进行后续实验,见表1,图3。
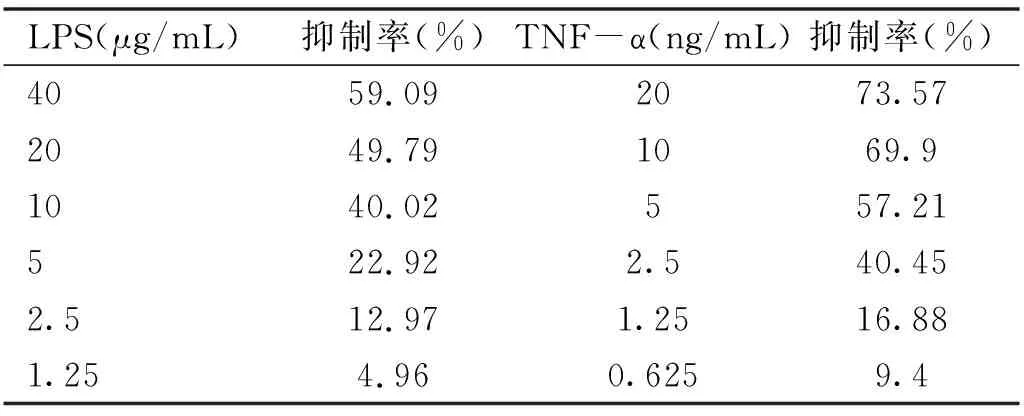
表1 不同浓度LPS和TNF-α干预兔泪腺原代上皮细胞的抑制率
2.4流式细胞术检测各组细胞的凋亡情况流式细胞术结果显示:三组细胞凋亡率比较,差异有统计学意义(F=225.30,P<0.01)。LPS(10μg/mL)和TNF-α(2.5ng/mL)组细胞凋亡率明显高于空白对照组,差异具有统计学意义(t=12.34,P<0.01;t=16.53,P<0.01)。两种造模干预组组间比较,TNF-α组细胞凋亡率高于LPS组,差异具有统计学意义(t=4.18,P<0.01),提示TNF-α模拟干眼的炎症反应效果优于LPS,见表2,图4。
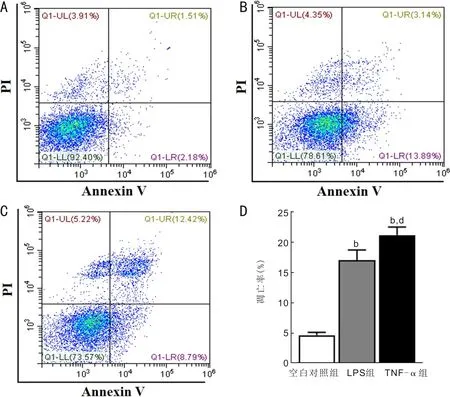
图4 两种干预方式细胞凋亡情况的比较 A:空白对照组;B:LPS组;C:TNF-α组;D:各组凋亡率比较。b P<0.01 vs空白对照组;d P<0.01 vs LPS组。

表2 各组细胞凋亡率和细胞上清液中IL-1β、IL-6的含量比较
2.5 ELISA检测各组细胞上清液中炎性因子的含量ELISA结果显示:三组细胞上清液中IL-1β和IL-6的含量比较,差异有统计学意义(均P<0.01)。LPS(10μg/mL)和TNF-α组(2.5ng/mL)细胞上清液中IL-1β和IL-6的含量均明显高于空白对照组,差异具有统计学意义(P<0.01)。两种造模干预组组间比较,TNF-α组IL-1β和IL-6的含量明显高于LPS组,差异具有统计学意义(P<0.01),提示TNF-α模拟干眼的炎症反应效果优于LPS,见表2。
3讨论
干眼是眼表的一种多因子疾病,特征是泪膜稳态的丧失并伴有眼表症状,其病因包括泪膜不稳定、泪液高渗性、眼表炎症与损伤和神经感觉异常,其中泪腺上皮炎症浸润和病变是干眼的重要病理生理过程[6-7]。近几年有研究发现,眼表的慢性炎症是干眼重要的病理机制[8]。人体内的炎症因子如TNF-α具有免疫调节、参加炎症反应的功能,生理状态下炎症因子表达较低[9],当分泌量加大时,能够激活单核细胞和中性粒细胞,促进白细胞聚集,诱发机体产生一系列炎症反应[10]。炎症在延续和维持干眼中起着关键作用[11]。因此,通过离体兔泪腺并分离泪腺上皮细胞作为研究干眼的对象,有助于在体外模拟干眼。
本研究中兔泪腺上皮细胞的体外基础培养基为DMEM/F12,含有更为丰富的营养成分和多种微量元素,并加以15%~20%的FBS,能尽可能模拟体内机体环境,有利于细胞的生长和代谢。本研究对获取的兔泪腺上皮细胞进行活性和纯度检测结果显示:兔泪腺上皮原代细胞标志角化蛋白(Pan-cytoeratin)主要表达在细胞质,且阳性率>90%,符合实验要求。
目前研究表明,干眼发生的主要机制为炎症反应、细胞凋亡等,众多炎症细胞因子、促炎因子的交互作用参与了干眼的发病过程[12-13]。常规细胞炎症模型的干预方法以LPS刺激为主,LPS是革兰氏阴性菌细胞外膜的主要成分,与其受体结合后启动细胞内信号传递链,促使核因子-κB(nuclear factor-kappa B,NF-κB)活化,从而启动炎症介质、黏附分子等转录,介导炎症反应[14]。而TNF-α是干眼炎症反应中活跃的炎症因子,通过激活NF-κB通路诱导炎症介质的产生,介导细胞凋亡。我们前期研究也证实兔干眼动物模型血清和泪腺组织匀浆液中TNF-ɑ表达与正常组差异最为显著,而且干眼患者泪液中TNF-α的含量与角膜上皮的损伤程度呈正相关[15],由此可推测,在一定程度上TNF-α干预泪腺上皮细胞更具备干眼模型的特征。因此,本研究采用LPS和TNF-α构建干眼模型,并对两者构建干眼模型的IC50,细胞凋亡和炎性因子分泌等进行检测和比较,结果表明LPS和TNF-α干预兔泪腺上皮细胞12h的IC50分别为20μg/mL和4.996ng/mL,两者的0.5倍IC50,即10μg/mL和2.5ng/mL干预下细胞凋亡和炎性因子分泌水平TNF-α高于LPS。由此可见,LPS和TNF-α皆可以构建干眼模型,但是在相同IC50的干预下,TNF-α的造模效果优于LPS。
本研究成功建立了一种细胞纯度较高、相对简便、快速,模型稳定的兔干眼细胞模型,为兔泪腺上皮细胞功能及干眼的基础研究提供了更稳定的体外实验模型。
