直肠腔内三维超声和MRI 对中下段直肠癌壁外血管侵犯程度的评估效果
2021-01-31陈海涛李支尧冉凤明钏志睿唐诗聪罗晓茂
陈 东, 陈海涛, 李支尧, 冉凤明, 张 曦, 钏志睿, 唐诗聪, 罗晓茂
(1. 云南省肿瘤医院 昆明医科大学第三附属医院超声医学科,云南 昆明 650118;2.云南省肿瘤医院昆明医科大学第三附属医院病理科,云南 昆明 650118;3. 云南省肿瘤医院 昆明医科大学第三附属医院检验科,云南 昆明 650118;4. 云南省肿瘤医院 昆明医科大学第三附属医院乳腺外一科,云南 昆明 650118)
结直肠癌是最常见的消化系统肿瘤,其发病率和死亡率逐年升高[1]。目前,局部晚期的直肠癌患者先行新辅助放化疗后再行手术治疗,可将直肠癌局部复发率降低至5%[2],但仍有15%直肠癌患者发生远处转移。发生远处转移的直肠癌患者预后相对较差,可能与直肠癌壁外血管侵犯(extramural vascular invasion,EMVI) 程 度 有 关[3]。研 究[4-6]显示:EMVI 是直肠癌淋巴结转移、局部复发、远处转移和低生存率的主要危险因素。因此,术前应用影像学检查方法评估直肠癌壁外血管是否侵犯具有重要的临床价值。目前,只有核磁共振成像(magnetic resonance imaging,MRI)可用于评估直肠癌术前EMVI,术前MRI 诊断为EMVI 阳性是直肠癌患者预后不良的主要危险因素[7-8]。直肠腔内三维超声(three-dimensional endorectal ultrasound,3D-ERUS) 主 要 用 于 评 估 直 肠 癌 的TN 分 期[9],对评估直肠癌术前EMVI 的研究报道较少。3D-ERUS 可多方位多角度观察直肠癌病灶周围系膜内的血管走行,彩色多普勒超声还可显示肿瘤周围异常走行的血管内血流充盈情况。本研究旨在探讨3D-ERUS 和MRI 对中下段直肠癌患者术前EMVI 的诊断价值,为直肠癌患者的临床诊疗提供理论依据。
1 资料与方法
1.1 临床资料
回顾性分析2019 年1-6 月昆明医科大学第三附属医院结直肠外科收治的94 例中下段直肠癌患者,其中男性55 例、女性39 例,年龄35~80 岁,平均年龄(60.38±10.81)岁。入选标准:①经病理确诊为直肠癌的患者;②术前未接受任何治疗;③术前10 d 内均行3D-ERUS 和MRI 检查;④术后病理标本是4 点或多点取材;⑤所有患者临床资料完整。排除标准:①肛门狭窄患者;②拒绝手术治疗的患者。
1.2 仪器和方法
1.2.1 3D-ERUS 检查 采用丹麦BK Pro focus2202彩色多普勒超声诊断仪,腔内3D 探头(探头频率分别为6、9 和12 MHz)。3D-ERUS 检查由同一名经验丰富的超声科医师完成。检查方法:检查前2 h 清洁灌肠,待患者肠道清洁后先行左侧卧位肛门指检,观察病灶的方位、质地及有无肠道狭窄等,再用专用灌注器注入50~100 mL 医用超声杀菌耦合剂,3D 直肠探头套2 个保护套。缓慢进入肛门后找到病灶,动态观察并记录病变位置、大小、浸润深度、周围淋巴结个数和大小。三维立体成像后在多切面上观察病灶周边部有无异常走行或扩张的血管,并采用彩色多普勒超声观察其内血流充盈情况。
1.2.2 MRI 检查 采用飞利浦Ingenia 3.0T 超导型磁共振成像仪及腹部相控阵线圈。扫描前无需特别肠道准备。平扫顺序依次为轴位TSE T1WI 序列扫描(FOV 360 mm×320 mm,矩阵320×288,层厚5 mm,间距0.5 mm),矢状位、冠状位及轴位的TSE T2WI序列扫描(FOV 250 mm×250 mm,矩 阵320×288),轴 位DWI 序 列 扫 描(FOV 280 mm×280 mm,矩阵140×140),层厚和间距均分别为3.0 mm和0.3 mm。增强后再行轴位、矢状位和冠状位mDIXON FFE 序列扫描(FOV 380 mm×320 mm,矩阵288×224,层厚2.5 mm,间距0 mm)。
1.3 诊断标准
3D-ERUS 图像和盆腔MRI 图像均分别由2 名高年资医师采用双盲法阅片,出现不一致意见时共同协商统一诊断意见。3D-ERUS 和MRI 检查判断直肠癌EMVI 的标准:均按照SMITH 等[10]提出的EMVI 影像学评分系统评估。0 分:肠壁内有非结节状肿瘤侵至肌层;1 分:肿瘤呈结节状或条状侵出肠壁;2 分:肿瘤周边区域有血管走行,但是血管轮廓和管径大小无异常和其内无异常实性的信号;3 分:病灶周围系膜内走行的血管内有异常的回声或信号,且血管轮廓和直径稍有扩大;4 分:病灶周边系膜内异常血管内见异常回声或信号,血管轮廓呈不规则或呈结节样扩张。评分为3 分和4 分的病例需联合彩色多普勒超声观察血管内的血流充盈情况。0~2 分判定为EMVI 阴性,3 和4 分判定为EMVI 阳性。病理诊断标准:直肠癌周围系膜内的脉管内可见癌栓。
1.4 统计学分析
采用R3.6.2 统计软件进行统计学分析。患者临床基线特征为分类变量,组间比较采用χ2检验。3D-ERUS 和MRI 检查对EMVI 的诊断效果采用受试者工作特征(receiver operating characteristic,ROC)曲线进行评价,计算3D-ERUS 和MRI 检查诊断中下段直肠癌患者术前EMVI 的准确率,并计算ROC 曲线下面积(area under curve,AUC) 及对应曲线下的灵敏度(sensitivity,Se)、特异度(specificity,Sp)、阳性预测值(positive predictive value,PPV) 和 阴 性 预 测 值(negative predictive value,NPV)。采用Kappa 系数评价3D-ERUS 和MRI 检查对EMVI 的诊断结果与病理结果的一致性,Kappa 系数使用irr 软件包计算,二者诊断EMVI 的准确率比较采用χ2检验,AUC 比较采用Delong 检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 患者临床资料和病理诊断结果
94 例患者最终病理诊断结果均为直肠癌。其中16 例直肠癌患者周围系膜内可见脉管内癌栓,78 例未见脉管癌栓,脉管内癌栓的发生率为17.02%。不同年龄、T 分期、N 分期、分化程度和癌胚抗原(CEA) 水平直肠癌患者EMVI 阳性率比较差异有统计学意义(P<0.05)。见表1。
2.2 3D-ERUS 和MRI 检查对直肠癌患者EMVI的诊断结果与病理结果比较
与术后病理结果比较,78 例EMVI 阴性的直肠癌患者中3D-ERUS 正确诊断72 例,误诊6 例;16 例EMVI 阳性的直肠癌患者中3D-ERUS 正确诊断13 例,误诊3 例;75 例评 分为0~2 分(EMVI阴 性),19 例 评 分 为3 或4 分(EMVI 阳 性);3D-ERUS 检查诊断直肠癌患者EMVI 的准确率为90.43%(Kappa=0.685,P<0.01)。与术后病理结果比较,78 例EMVI 阴性的直肠癌患者中MRI正确诊断70 例,误诊8 例;16 例EMVI 阳性的直肠癌患者中MRI 检查正确诊断12 例,误诊4 例;74 例评分为0~2 分(EMVI 阴性),20 例评分为3 或4 分(EMVI 阳性);MRI 检查诊断直肠癌患者EMVI 的 准 确 率 为87.23% (Kappa=0.589,P<0.01)。3D-ERUS 和MRI 检查诊断直肠癌患者EMVI 的准确率比较差异无统计学意义(χ2=0.214,P=0.643)。见表2 和图1。
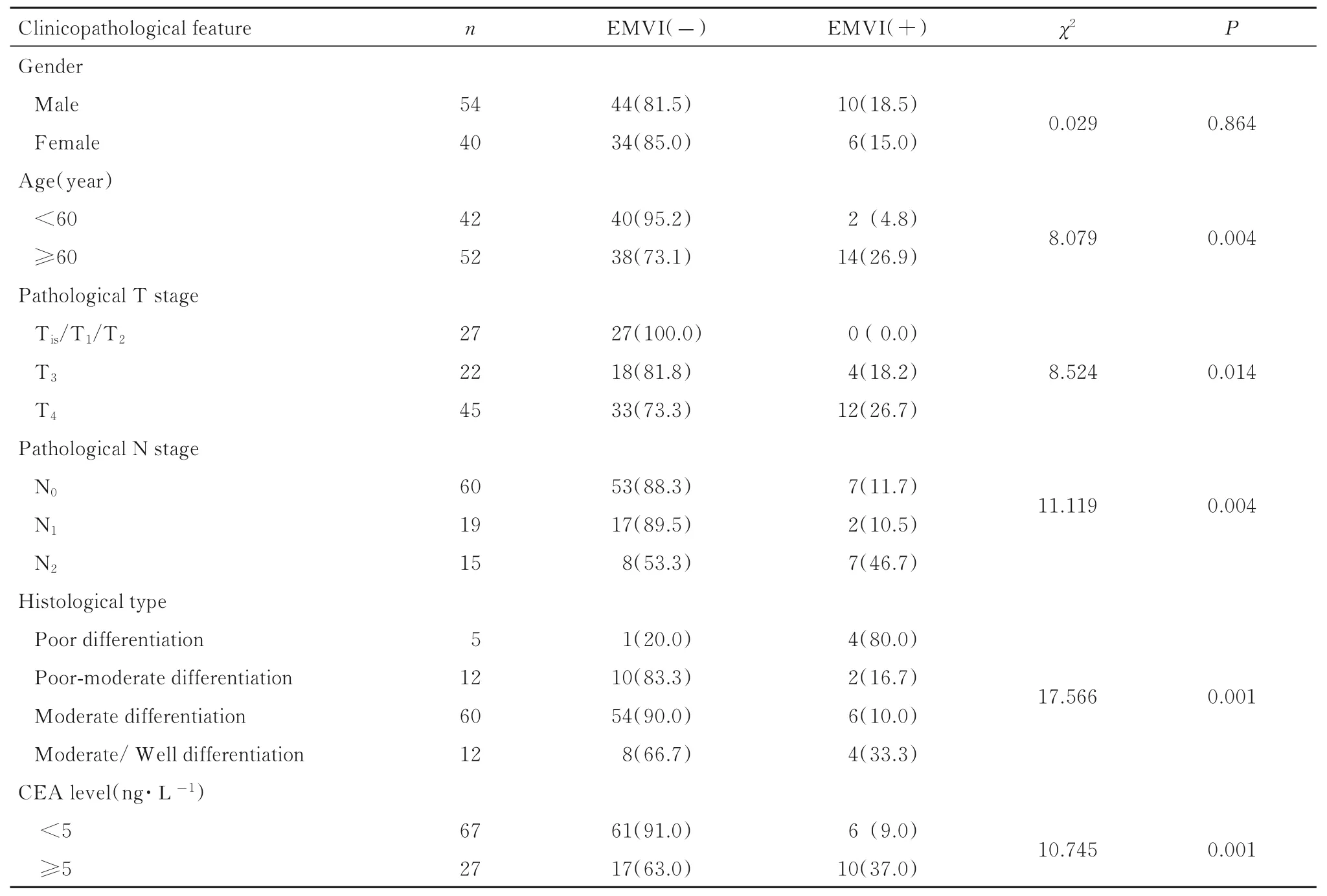
表1 不同临床病理特征直肠癌患者EMVI 阳性率Tab.1 Positive rates of EMVI of rectal cancer patients with different clinicopathological features [n(η/%)]
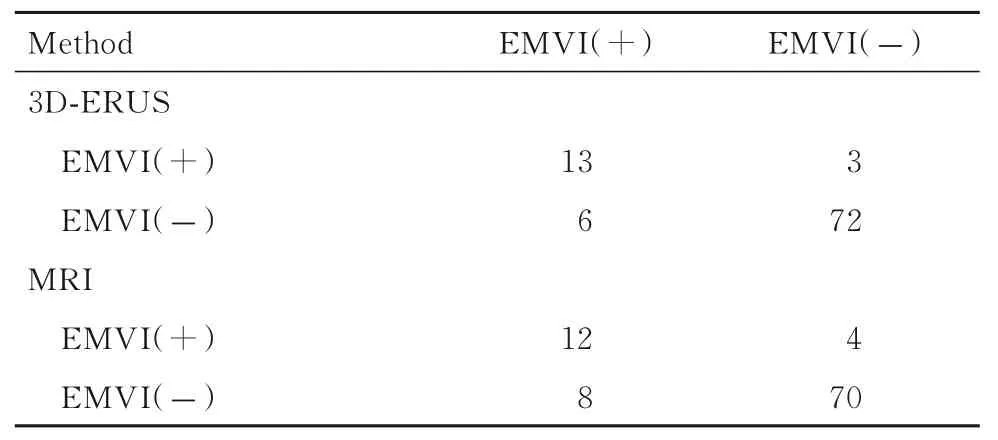
表2 3D-ERUS 和MRI 检查对直肠癌患者EMVI 的诊断结果与病理结果Tab. 2 Results of 3D-ERUS and MRI in diagnosis of EMVI of patients with rectal cancer and pathological results
2.3 3D-ERUS 和MRI 检查对直肠癌患者EMVI的诊断效能
3D-ERUS 和MRI 检查对直肠癌患者EMVI 的诊断效能见表3。3D-ERUS 和MRI 检查诊断直肠癌 患 者EMVI 的AUC 分 别 为0.868 (95%CI:0.765~0.971) 和 0.824 (95%CI: 0.709~0.938),两者之间比较差异无统计学意义(Z=1.355,P=0.175)。见图2。
3 讨 论
1980 年TALBOT 等[11]首 次 明 确 了 壁 外 血 管与壁内血管的区别,并提出了EMVI 是指在固有肌层以外的脉管系统内存在肿瘤细胞,肿瘤侵犯壁外血管的患者5 年生存率仅为33%。研究[12]表明:直肠癌EMVI 阴性的患者行新辅助化疗后5 年的无复发率和总生存率较阳性患者高。目前,MRI 检查是术前评估EMVI 的主要影像学方法。研究[13]显示:采用高分辨MRI 检查于术前评估18 例直肠癌患者的EMVI,在术前正确诊断了15 例直肠癌患者的EMVI。SMITH 等[10]进一步提出基于采用高分辨MRI 的5 级评分评估术前的EMVI 情况,MRI术前检出EMVI 的Se 和Sp 分别为62%和88%,评分为0~2 分的患者预后优于评分为3 或4 分的患者。CHAND 等[14]研 究 发 现:MRI 检 出EMVI 的患者明显多于组织病理学,治疗后MRI 检查EMVI仍为阳性的患者无病生存率明显低于治疗后EMVI呈阴性的患者。本研究中MRI 检查对直肠癌患者EMVI 的评估基于SMITH 等提出的5 级评分系统,其对EMVI 的Se 和Sp 分别为75.00%和89.74%。
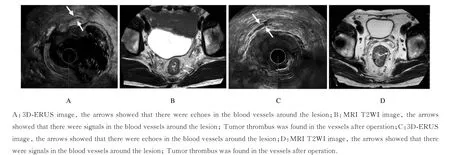
图1 EMVI 阳性直肠癌患者的3D-ERUS 和MRI 图像Fig.1 3D-ERUS and MRI images of patients with positive rectal cancer
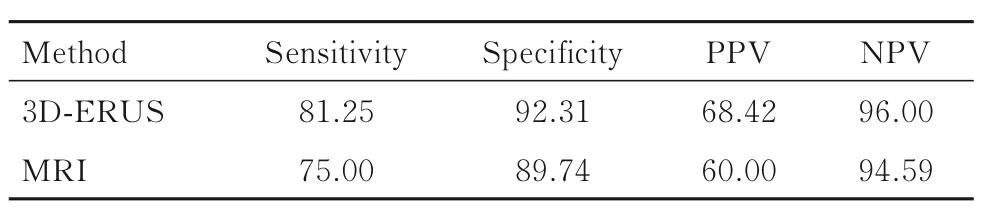
表3 3D-ERUS 和MRI 检查对直肠癌患者EMVI 的诊断效能Tab. 3 Efficiencies of 3D-ERUS and MRI in diagnosis of EMVI in patients with rectal cancer
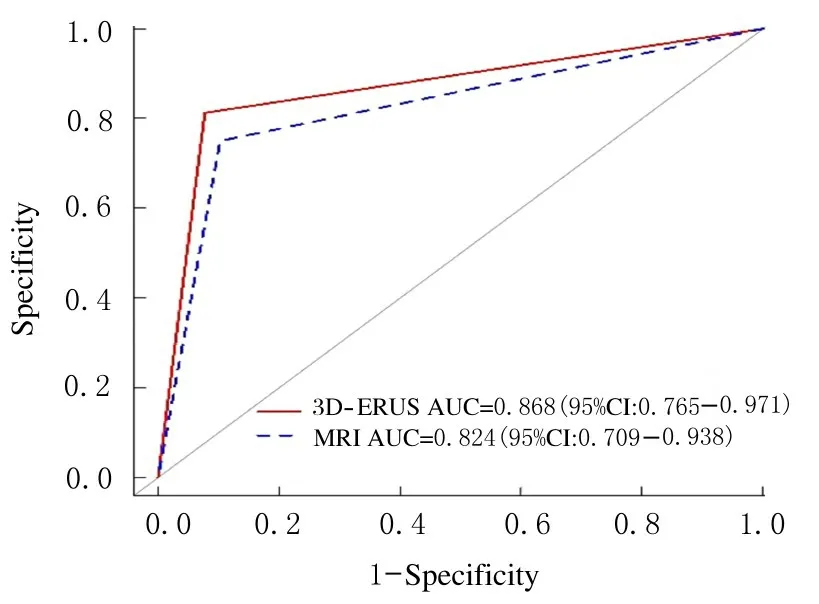
图2 3D-ERUS 和MRI 检查对直肠癌患者EMVI 诊断效能的ROC 曲线Fig.2 ROC curves of efficiencies of 3D-ERUS and MRI in diagnosis of EMVI in patients with rectal cancer
目前,3D-ERUS 检查多用于评估直肠癌患者的TN 分期[15-17],且对早期直肠癌的T 分期准确性较高[18],作为MRI 检查的补充用于评估中下段直肠癌的环周切缘[19-20]。本研究首次应用3D-ERUS评估中下段直肠癌患者术前的EMVI,多方位多角度观察肿瘤周围系膜内的血管走行情况,联合应用彩色多普勒超声观察肿瘤系膜内小血管的血流充盈情况。参照SMITH 等[10]提出的5 级评分系统进行评分,直肠3D-ERUS 评估EMVI 的准确率、Se、Sp 及AUC 分 别 为90.43% (Kappa=0.685,P<0.01)、 81.25%、 91.23% 和 0.868 (95%CI:0.765~0.971),3D-ERUS 和MRI 检查诊断直肠癌患者术前EMVI 的准确率和AUC 比较均差异无统计学意义。
本研究中3D-ERUS 和MRI 检查评估中下段直肠癌患者术前EMVI 的NPV 较高,而PPV 均较低,可能是因为本研究中入组的EMVI 阳性的患者例数偏少。本研究中有1 例EMVI 阳性患者发生在小于3 mm 的小血管内,MRI 检查未检出,主要是MRI 检 查 无 法 评 估 小 于3 mm 的EMVI 程 度[21-22],而直肠3D-ERUS 检出该例小于3 mm 的小血管内EMVI 阳性患者;直肠3D-ERUS 术前未检出的3 例EMVI 阳性患者的主要是受限于肠道的清洁度。本研究中3D-ERUS 和MRI 检查诊断为EMVI阳性的直肠癌患者分别为6 例和8 例,其病理诊断为EMVI 阴性。由于直肠3D-ERUS 和MRI 检测的EMVI 需与病理的金标准“血管侵犯”作对比,病理学固有肌层以外的脉管系统内存在肿瘤细胞需加做CD34 免疫组织化学以确认是否存在血管侵犯,同时病理取材时需至少取4 个方位才能够达到评估EMVI 的要求。3D-ERUS 和MRI 检查误诊病理EMVI 阴性为EMVI 阳性的可能原因是误判了肿瘤周边走行的正常血管为EMVI 阳性,同时病理标本是4 点取材评价EMVI 而不是大标本观察。
本研究的局限性:回顾性研究,入组的EMVI阳性病例数偏少;本研究中病理标本是4 点取材评价EMVI,而不是大切片评估,同时未加做CD34免疫组织化学染色进一步评估;本研究未观察患者整体生存率和局部复发率。后续将进一步分析3D-ERUS 检测的EMVI 与直肠癌患者远处转移、局部复发和总体生存率的相关性。
综上所述,3D-ERUS 和MRI 检查在评估中下段直肠癌患者术前EMVI 情况中具有较高的临床应用价值,3D-ERUS 检查可作为MRI 检查的补充用于评估术前中下段直肠癌患者的EMVI。
