CRISPR/Cas9系统在基因编辑和疾病治疗中的应用
2021-01-30张思桐黄妙惠
张思桐,黄妙惠
(福建师范大学南方生物医学研究中心 福建省天然免疫生物学重点实验室,福建 福州 350117)
CRISPR/Cas9技术是一种新型基因编辑工具,是以RNA导向的DNA识别系统,可在不同生物体中高效和特异性地进行基因编辑和调控。CRISPR技术以其易于操作,可多重编辑,能够进行高通量筛选,更强的可扩展性等成为生物医学研究革命性的新工具。
1987年,Ishino等率先在大肠杆菌中发现29nt串联间隔重复序列,2002年Ruud等人首次使用CRISPR(clustered regulatory interspaced short palindromic repeat)来描述该间隔重复序列。随后,在2005年三个研究小组发现CRISPR中的间隔序列与感染细菌和古细菌的病毒高度同源,2007年Barrangou等提供了Ⅱ型CRISPR/Cas9系统介导的适应性免疫的第一个实验性证据。2012年Martin等发表了与反式激活的crRNA(tracr RNA)配对的crRNA,形成了2个RNA结构并介导Cas9将DNA双链断裂(double strand break,DSB)引入靶DNA中。2013年Cong和Mali等人同时发表的开创性研究表明CRISPR系统首次完成对哺乳动物细胞的基因编辑。2016年,研究人员在CRISPR/Cas9活体细胞目标识别和利用CRISPR/Cas9引起癌症突变的失活方面取得了重大突破[1]。2017年,张峰等人证明CRISPR/Cas13可以靶向哺乳动物细胞中的RNA和功能,并可以作为研究哺乳动物细胞中RNA和促进治疗发展的灵活平台[2]。2018年,首次启动CRISP/Cas9临床试验。2020年,首例患者接受了直接将CRISPR注射人体内的基因编辑疗法[3];同年,诺贝尔化学奖颁发给Emmanuelle Charpentier和Jennifer Doudna以表彰他们对CRISPR/Cas9基因编辑技术的贡献(CRISPR/Cas9系统发展时间线见图1)。 CRISPR/Cas9技术以其具有较强的特异性和高效率,并能准确、快速地筛选全基因组的能力,使它在基因突变、改造、特定疾病模型建立、癌症治疗等方面成为可能,为疾病治疗提供新的手段。
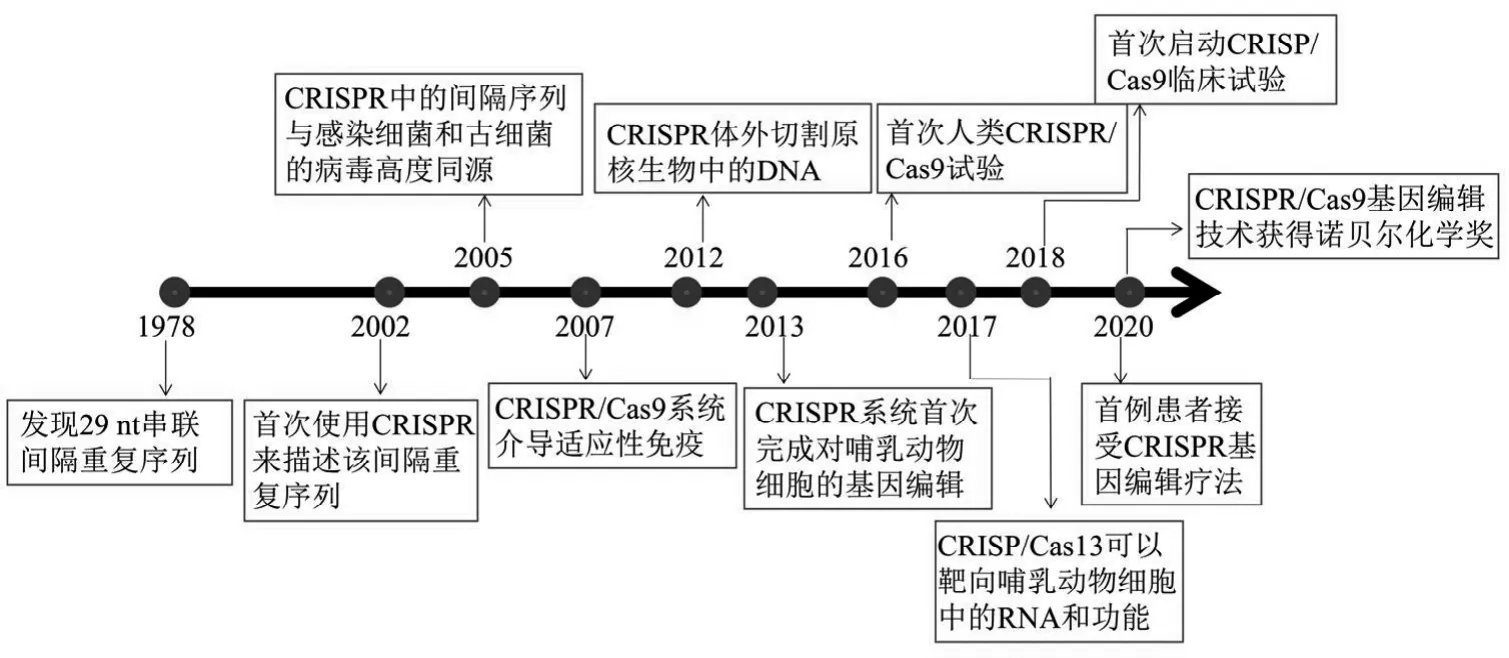
图1 CRISPR/Cas9系统发展时间线
1 CRISPR:细菌和古细菌的适应性免疫机制
CRISPR/Cas系统是细菌和古细菌体内的获得性免疫系统[3],可对抗侵略细菌的外源DNA、质粒和噬菌体。含有CRISPR的生物从侵入物(噬菌体或质粒)中获得DNA片段,将其转录到CRISPR RNA(crRNA)中以指导切割侵入的RNA或DNA[4],这种CRISPR免疫系统通过许多不同的Cas蛋白协作完成。根据其组件和作用机制的差异,CRISPR系统分为2大类:Class 1(包含Ⅰ、Ⅲ和Ⅳ型)和Class 2(包含Ⅱ、Ⅴ和VI型)[5]。其中,Ⅰ型系统是RNA引导目的基因的切割,这类系统需要几个较大的复合体作为效应蛋白;但在Ⅱ型系统中,只需要一种RNA引导的内切核酸酶(例如,类型Ⅱ中的Cas9和Cpf1)来介导侵入物遗传物质的切割[6]。
系统分三个阶段对侵入的外源DNA进行全面的免疫应答[7]。第一阶段,即获取阶段,入侵质粒或噬菌体的DNA片段被整合到宿主的CRISPR位点作为crRNA重复序列之间的间隔物。在第二阶段,Cas蛋白被表达,包含获得间隔区的CRISPR阵列被转录成pre-crRNA,pre-crRNA被Cas蛋白和宿主其它因子切割并加工为成熟的crRNA。成熟crRNA起到引导作用,crRNA 5'端区域能够与侵入物基因组互补配对,而其3'端能够与非编码反式激活CRISPR RNA(tracr RN)及Cas9 蛋白形成复合物。在Ⅱ型CRISPR系统中tracr RNA与crRNA重复序列的杂交,对于crRNA加工、Cas9结合和Cas9介导的靶向切割至关重要。第三阶段,Cas蛋白在crRNA指导下识别特定靶向序列,并介导入侵基因组的切割,从而保护宿主细胞免受感染。大部分CRISPR系统依赖存在于侵入基因组中与crRNA靶位点相邻,特异性的PAM 序列[8]。由于宿主基因组中CRISPR位点不存在这种PAM序列,从而帮助其避免Ⅰ型和Ⅱ型CRISPR系统自我剪切[9]。
2 CRISPR/Cas9系统在哺乳动物细胞中的作用机制
CRISPR/Cas9是细菌防止外来DNA分子入侵的适应性免疫系统,科学家将该系统作为一种靶向基因编辑技术。目前应用于哺乳动物细胞的CRISPR/Cas9系统主要由Cas9蛋白和guide RNA两个部分组成。
guide RNA组件是大约100个核苷酸长度的引导RNA。Cas9蛋白结合到guide RNA最后约80个核苷酸位置,之后guide RNA的前20个核苷酸处于游离状态,通过碱基互补配对与DNA双链结合,此时Cas9与双链DNA在PAM基序位置进行交互交联并介导DNA双链分离,形成蛋白质、RNA和DNA三重复合物。其中guide RNA的前20个核苷酸将Cas9蛋白引导到特定的基因组位点,通过改变这20个核苷酸序列,就可以重新定向CRISPR/Cas9打靶基因组中不同位点。复合物形成后,Cas9引发DNA双链断裂。DSB可以通过HDR和非同源末端连接(non-homologous end joining, NHEJ)修复[10]。在同源修复模板存在的情况下,CRISPR/Cas9系统通过同源定向修复(homology directed repair, HDR)产生精确的序列修饰(例如突变、插入或更正),NHEJ则可以介导随机插入或缺失突变。如果DBS存在于编码外显子区域时,NHEJ修复可能导致基因开放阅读框移位或过早形成终止密码子,破坏正常翻译,造成阅读框架紊乱和相应蛋白灭活。研究表明NHEJ是哺乳动物细胞中DSB修复最主要的途径且它不依赖于细胞周期[11]。机体通过HDR和NHEJ修复机制从而实现基因编辑作用。
随着研究深入,CRISPR / Cas9系统已经广泛应用在基因敲除、敲入、疾病模型建立以及基因治疗;因其高效性和易操作性,在生物医学界引起一阵研究狂潮。
3 应用Cas9介导的基因组编辑技术研究基因功能
Cas9介导的基因编辑系统已广泛用于遗传学研究,通过对基因进行定点编辑,了解特定基因作用,建立基因编辑动物模型。通过简单地构建一个sgRNA,与邻近PAM基序NGG靶向位点配对,Cas9即可定位到指定DNA位点实现靶向剪切。有研究表明Sp Cas9基因组内平均每8 bp就有一个PAM基序,可靶向编辑几乎任何感兴趣的基因[12]。CRISPR/Cas9技术的使用大大提高了转基因效率:从真菌和植物到各种动物。这项技术也使得建立疾病模型变得更加容易,推进了遗传性疾病和癌症等疾病研究,有助于理解这些病理过程的分子机制[13]。通过引入Cas9和几个sgRNAs可以很容易地同时编辑多个基因位点,这可以应用于生产大规模的染色体重排。例如在同一染色体内的邻近区域创建一个DSB可能会导致DNA中间片段的靶向缺失或倒位,而在不同染色体中产生两个DSB可能导致靶向的染色体易位[14]。这类由Cas9介导的靶向重排,模仿了人类疾病状态(例如癌症)中发生的重排,对研究疾病模型和遗传性疾病具有重要作用。
CRISPR/Cas9系统在治疗许多疾病中也越来越重要,包括艾滋病、遗传性疾病和癌症等。当Cas9与含有病毒关键基因组sgRNA的载体一起感染细胞时,病毒基因组会被灭活或清除,从而防止感染HIV、乙肝病毒、人乳头瘤病毒和Epstein-Barr病毒[15,16]。有研究显示,通过CRISPR/Cas9靶向宿主基因组中编码HIV共同受体共趋化因子受体5(co-receptor chemokine receptor 5,CCR5)使细胞产生HIV-1病毒抗性,从而有助于抵抗HIV感染。更具临床意义的是,该系统还应用于多种体细胞类型,如原代T细胞和造血干细胞等免疫细胞的基因治疗性改变[17]。
以上证据均表明CRISPR/Cas9可通过基因编辑,修复突变或敲除特定基因,探讨肿瘤发生机制,进而达到推进肿瘤治疗的目的。
4 应用CRISPR/Cas9技术修正基因突变
治疗遗传性疾病最直接方法是通过基因治疗纠正导致该疾病的突变。众多研究表明,CRISPR/Cas9系统可准确有效地编辑细胞基因组从而达到修正基因突变的目的。
囊性纤维化是一种主要影响肺部和消化系统的遗传性疾病,主要是由囊性纤维化跨膜传导调节因子(C F T R)突变引起。有研究发现,通过CRISPR/Cas9编辑技术可纠正囊性纤维化患者肠干细胞中CFTR位点突变[18]。被校正的基因能够正常表达,恢复了因CFTR突变引起的肠干细胞类器官肿胀。
β-地中海贫血症是常见的单基因遗传病,由人血红蛋白beta(HBB)基因突变引起,突变抑制红细胞产生足够的含氧血红蛋白分子从而导致贫血。有研究发现利用CRISPR/Cas9技术和piggy-Bac转座子将校正DNA序列定位到HBB突变位点,有效修正两种不同的β-地中海贫血突变,而且经过校正的iPSC分化成红细胞时,HBB表达恢复[19]。
这些研究表明CRISPR/Cas9技术可以给未来疾病治疗方面提供一个新的策略。最近的几项研究也证明了CRISPR/Cas9系统可用于来纠正小动物模型的遗传性疾病。
胶质瘤是一种常见但原发性颅内恶性肿瘤,主要由机体携带端粒酶基因(TERT)启动子区域的致癌突变引起,有研究发现,以腺相关病毒(AAV)作为载体,通过CRISPR/Cas9技术进行有效编辑,可以有效抑制小鼠移植瘤的生长,并延长了小鼠的生存时间,从而实现精准修正胶质瘤细胞端粒酶基因启动子区域的致癌突变[20]。
利用Cas9 mRNA和sgRNA共注射到杜氏肌营养不良(DMD)小鼠体内,成功拯救了具有肌营养不良蛋白突变的小鼠[21]。同时有研究利用CIRSPR/Cas9技术通过HDR纠正了小鼠肝细胞中的Fah突变[22],通过脾脏注射将校正后的肝细胞移植到HT1小鼠模型中,并证明编辑后的肝细胞可以在体内广泛增殖。该研究证明CRIPR/Cas9编辑在治疗HT1以及其他形式的遗传性代谢性肝病中的潜力。
这些研究都表明CRISPR/Cas9技术在修正基因突变,治疗遗传性疾病方面具有可行性,为未来疾病治疗研究提供一个可靠的技术支持。
5 CRISPR/Cas9的风险和局限性
CRISPR/Cas9基因编辑技术的出现给基因治疗带来了新的蓝图,人们希望通过人为地敲除或改造基因,从而达到改善或治疗疾病的目的。但在目前CRISPR/Cas9技术还存在一些不足,主要有以下几个问题。
5.1 脱靶影响
CRISPR/Cas9技术最主要挑战就是脱靶现象。非目标突变对CRISPR/Cas9技术的使用提出了不确定性,特别是在基因治疗的情况下。在过去几年,研究人员试图通过优化sgRNA或人工修饰来改善Cas9的蛋白质结构,如PAM结构[23]。此外,通过对抗CRISPR蛋白进行研究,旨在能设计出一种有用的Cas9开关,限制Cas9在细胞核中的活跃时间,从而避免不必要的脱靶影响。
5.2 错义敲除或插入
Cas9切割后DNA靶向修复,观察到很少发生小的插入和缺失(<20 bp)。然而,在一些研究中出现了600 bp序列缺失和高达1500 bp不需要的序列缺失,这可能导致不必要的病理损害,也会导致正常组织或细胞表达出现障碍[24]。
5.3 传递效率
Cas9在细胞或组织中的传递效率是影响CRISPR基因编辑成功的另一关键原因。CRISPR/Cas9技术主要通过包含有Cas9和sgRNAs的质粒或病毒载体进行编辑。腺相关病毒载体是Cas9载体中最常用的载体,可以促进基因转移,然而AAV载体会因为所包装转基因的大小而受到限制[25]。此外,mRNA和蛋白质在体内的传递方式,例如未能如期到达靶细胞,或者触发人和动物体内RNA敏感的先天免疫反应继而产生细胞毒性[26]。已有研究表明,通过改进CRISPR组分和传递方式的性能,如使用能携带sgRNA和Cas9蛋白的纳米粒子作为载体,可以提高体内基因编辑的效率[27]。
另一个亟需解决的重要问题是与人类使用CRISPR技术有关的伦理安全,不管是现在还是未来,CRISPR/Cas9系统仍然是人们用于体内外研究疾病治疗相关一种重要的技术和平台,因此必须制定适当的伦理和监管准则来严格把控这项技术的合理使用。
6 展望
基因编辑被认为是在基因组水平上治疗疾病的一种有力的现代科学工具。CRISPR/Cas9技术以其操作简单、更具成本效益,可在体内外不同物种进行特异性基因敲除、插入和替换等优势,被人们广泛地应用于疾病的诊断、治疗和预防上,是生物医学研究和基因治疗一次巨大的技术革新。
目前,利用CRISPR/Cas9技术建立遗传性疾病模型已成趋势,对细胞基因功能、癌症和其他疾病基因组变化研究有着重要意义。已有科学家利用CRISPR/Cas9技术构建出老鼠、猴子和猪等多种动物模型进行研究,CRISPR/Cas9技术在作物遗传育种、植物基因改造和农作物品种改良等多个方面也发挥着重要作用。
尽管CRISPR/Cas9技术在多个领域运用效果显著,但还是存在一些需要克服的困难,比如减小脱靶效应、提高编辑效率和临床治疗中安全伦理等问题仍然是该技术在未来实际应用中最需要解决的事情。近来已有研究表明,载体或质粒的大小对CRISPR内切酶对靶基因的有效性和传递有显著影响[28]。因此,选择具有良好穿透性和较低宿主免疫激活性的载体,有利于将CRISPR/Cas9技术运用于更多疾病的治疗。
接下来科学家们将继续研究以提高基因靶向的准确性和效率,提高向特定细胞、组织或器官的传递性能,增强体内Cas9活性时间和区域,加强对基因编辑引起不良突变的预测和治疗效率。我们有理由相信,CRISPR/Cas9基因编辑技术可以在现有技术手段下进一步改进医学、遗传学、胚胎学以及生物信息等领域的发展,对研究各种遗传疾病的生物学和病理生理机制起到巨大的推动作用,对人类健康发展更来更多的福音。
