兔出血症病毒2型TaqMan探针荧光定量RT-PCR检测方法的建立及应用
2021-01-29陈萌萌,仇汝龙,范志宇,胡波,宋艳华,魏后军,朱伟峰,徐为中,王芳
陈萌萌,仇汝龙,范志宇,胡波,宋艳华,魏后军,朱伟峰,徐为中,王芳


摘要:以新发生的兔出血症病毒2型(RHDV2)SC 2020/04株VP60基因序列为参考,设计出1对特异性引物和TaqMan探针,建立了一种快速、灵敏且特异的用于检测新型病毒的荧光定量RT-PCR检测方法。试验结果显示:本研究建立的方法,标准曲线线性关系良好,R2值达到0.999;其特异性较好,与兔出血症病毒1型(RHDV1)、仙台病毒(SV)和轮状病毒(RRV)病原均无交叉反应;灵敏性高,最低检出量为1μl 1×10 拷贝;且重复性良好,批内和批间试验的变异系数平均值均小于2%。临床检测结果表明,利用该方法对108份临床病料进行检测,检出RHDV2阳性样品72份,检出率为66.7%,明显高于常规的RT-PCR方法(62.0%)。结果证明,新建立的TaqMan荧光定量RT-PCR方法适合于RHDV2感染的特异性诊断。
关键词:兔出血症病毒2型;TaqMan探针;荧光定量RT-PCR;敏感性;特异性
中图分类号:S855.3文献标识码:A文章编号:1000-4440(2021)06-1476-05
Establishment and application of a TaqMan-based fluorescence quantitative real-time PCR assay for detection of rabbit hemorrhagic disease virus type 2
CHEN Meng-meng,QIU Ru-long,FAN Zhi-yu,HU Bo,SONG Yan-hua,WEI Hou-jun,ZHU Wei-feng,XU Wei-zhong,WANG Fang
(Institute of Veterinary Medicine, Jiangsu Academy of Agricultural Sciences/Key Laboratory for Veterinary Bio-Product Engineering, Ministry of Agriculture, Nanjing 210014, China)
Abstract:A rapid, sensitive and specific fluorescence quantitative real-time PCR (RT-qPCR) method for the detection of rabbit hemorrhagic disease virus type 2 (RHDV2) was established. A pair of specific primers and TaqMan probes were designed in the conserved region of VP60 gene of the new variant strain SC 2020/04. The results showed that the standard curve had a good linear relationship, the R2 was 0.999. The TaqMan-based RT-qPCR method had good specificity and no cross reactions with rabbit hemorrhagic disease virus type1 (RHDV1), sendai virus (SV) and rotavirus (RRV). The method established in this study had high sensitivity, and the minimum detectable amount was 10 copies per microlitre. Moreover, the repeatability was good, and the mean coefficient of variation was less than 2%. The TaqMan-based RT-qPCR method was used to detect 108 clinical samples. The detection rate was 66.7%, which was higher than that of conventional RT-PCR. To sum up,the newly established TaqMan-based RT-qPCR method is suitable for the specific diagnosis of RHDV2 infection.
Key words:rabbit hemorrhagic disease virus type 2;TaqMan probe;fluorescence quantitative real-time PCR;sensitivity;specificity
兔出血症病毒(Rabbit hemorrhagic disease virus,RHDV)感染家兔可引起兔病毒性出血症(Rabbit hemorrhagic disease,RHD)。这是一种致死率高达90%的毁灭性传染病,该病首次于1984年在中國报道,随后在全球范围内大肆传播,给世界养兔业带来巨大的经济损失。
RHDV目前分为2种基因型:RHDV1(基因型GI.1)和RHDV2 (基因型GI.2)。自1984年中国首次报道RHD暴发之后的30多年里,中国主要流行RHDV1的GI.1a 和GI.1c基因型毒株[1-2]。2010年,法国首次发现RHDV新的基因型RHDV2,该毒株具有独特的遗传和抗原特征[2-3],在欧洲、澳大利亚和非洲等多个国家广泛传播[4-7]。目前,在国外RHDV2具有取代RHDV1的趋势,并且出现了高致病性RHDV2毒株,对中国兔养殖业的健康发展存在潜在的威胁。
我们新近分离报道了一株新的RHDV毒株,该株于2020年4月在中国四川省的养殖场兔子身上采集。经系统发育分析,该新分离株与RHDV2在同一分支, 与荷兰NL2016株核苷酸序列同源性最高(98.3%;MN061492), 属于RHDV2 GI.2基因群。这是在中国首次发现的RHDV2 毒株[8],我们将该分离株命名为SC2020/04 (登陆号:MT383749)。在致病性方面,与RHDV1相比,RHDV2更具危害性,不仅能够感染不同日龄的家兔,还能感染不同种的野兔,感染兔病死率可达80%。在遗传特性及抗原性方面,RHDV2与RHDV1也存在较大差异。兔病毒性出血症1型疫苗对RHDV2的交叉保护较差,不能有效抵抗 RHDV2 的感染[9]。可以预测,RHDV2倘若在中国流行,将会给兔养殖业带来灾难性的危害。
RHDV2与RHDV1感染引起的家兔临床症状极为相似,所以通过临床症状难以进行鉴别诊断,需要分子生物学检测手段进行诊断。目前通过实验室检测发现已有的用于检测RHDV1的RT-PCR、胶体金试纸条和ELISA等方法并不适用于RHDV2的特异性检测。因此急需建立一种快速有效的诊断方法持续监测临床发病情况。荧光定量RT-PCR方法通过荧光信号的积累实时监测整个PCR过程,具有高效、特异和灵敏等特点,在临床疾病的诊断方面广泛应用。而已报道的基于国外RHDV2流行毒株建立的实时荧光定量RT-PCR方法,能否用于对国内流行毒株的检測还有待于进一步确认[10-12]。本研究选取中国2020年4月分离的四川株SC2020/04 VP60基因序列,通过分析设计一组引物和探针,旨在建立一种可检测RHDV2的TaqMan荧光定量 RT-PCR方法。
1材料与方法
1.1材料
1.1.1病毒株与样品兔出血症病毒2型SC2020/04分离株(RHDV2)、兔出血症病毒1型GI.1a和GI.1c株(RHDV1)、仙台病毒(SV)和轮状病毒(RRV)cDNA由本实验室保存。临床待检样品为来自全国多地养兔场送检的病死兔肝脏。
1.1.2主要试剂pMD19-T、2×Taq Master Mix、DNA Marker DL2000、RNAiso Plus(病毒RNA提取试剂)均购自TaKaRa公司。Hiscript III RT SuperMix for qPCR (反转录试剂)、Ace UniversalU+ probe Master Mix V2(探针法荧光定量试剂盒)均为诺唯赞生物有限公司产品。
1.1.3主要仪器设备普通PCR扩增仪,购自Eppendorf公司。凝胶成相仪,购自Tanon公司。Q-one Real-Time PCR仪,购自Applied Biosystems公司。
1.2方法
1.2.1引物和探针根据RHDV2分离株SC2020/04 (GenBank No. MT383749)中保守VP60基因序列, 利用Primer Express 3.0.1软件设计荧光定量RT-PCR引物和探针, 上游引物为5′-CGGTTTGCCGCCATTG-3′,下游引物为5′ -CCAAAGCTCAAGCACGTTTG-3′,TaqMan探针序列为5′ -FAM- AACGCAAGTTTCCCTGGAAGCAGTTC-BHQ1-3′,引物和探针由生工生物工程(上海)股份有限公司合成。使用无菌水将引物和探针稀释至10 μmol/L,-20 ℃保存备用。
1.2.2标准质粒制备用RHDV2分离株SC2020/04 VP60基因全长引物克隆目的基因, 将扩增到的VP60基因序列连接到pMD19-T载体上,筛选并测序后获得阳性pMD19-T-SC2020-VP60重组质粒。将重组质粒用Nano drop进行浓度测定并计算拷贝数,用去离子水将重组质粒稀释成1 μl 1×103拷贝~1×108拷贝, 作为模板标准品。
1.2.3标准曲线的建立20 μl反应体系:采用Ace Universal U+ probe Master Mix V2试剂盒,2×Ace Universal U+ probe Master Mix V2 10.0 μl ,上、下游引物(10 μmol/L)各 0.4 μl,探针 0.2 μl,标准品质粒2.0 μl,DEPC水7.0 μl。反应条件为:37 ℃ 2 min;95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,45个循环,使用Q-One Real-Time PCR System 进行检测,并生成标准曲线。
1.2.4特异性试验将1 μl 1×106拷贝的标准品质粒作为阳性对照模板,以兔出血症病毒1型GI.1a株和GI.1c株(RHDV1)、轮状病毒(RRV)、仙台病毒(SV)的cDNA为检测模板,将水作为模板设立阴性对照,进行特异性试验。
1.2.5敏感性试验10倍倍比稀释质粒标准品,选取8个不同的梯度(1 μl 1×101~1×108拷贝),取2 μl作为模板进行敏感性试验,以水为阴性对照。
1.2.6重复性试验选取1 μl 1×104~1×108拷贝稀释度的质粒标准品为模板,进行3批重复性试验,批次内设3个重复。通过计算变异系数来评价建立方法的稳定性。
1.2.7临床样品检测用建立的TaqMan荧光定量RT-PCR方法检测临床疑似RHDV2感染的家兔肝脏组织病料108份。
2结果
2.1质粒标准品的构建
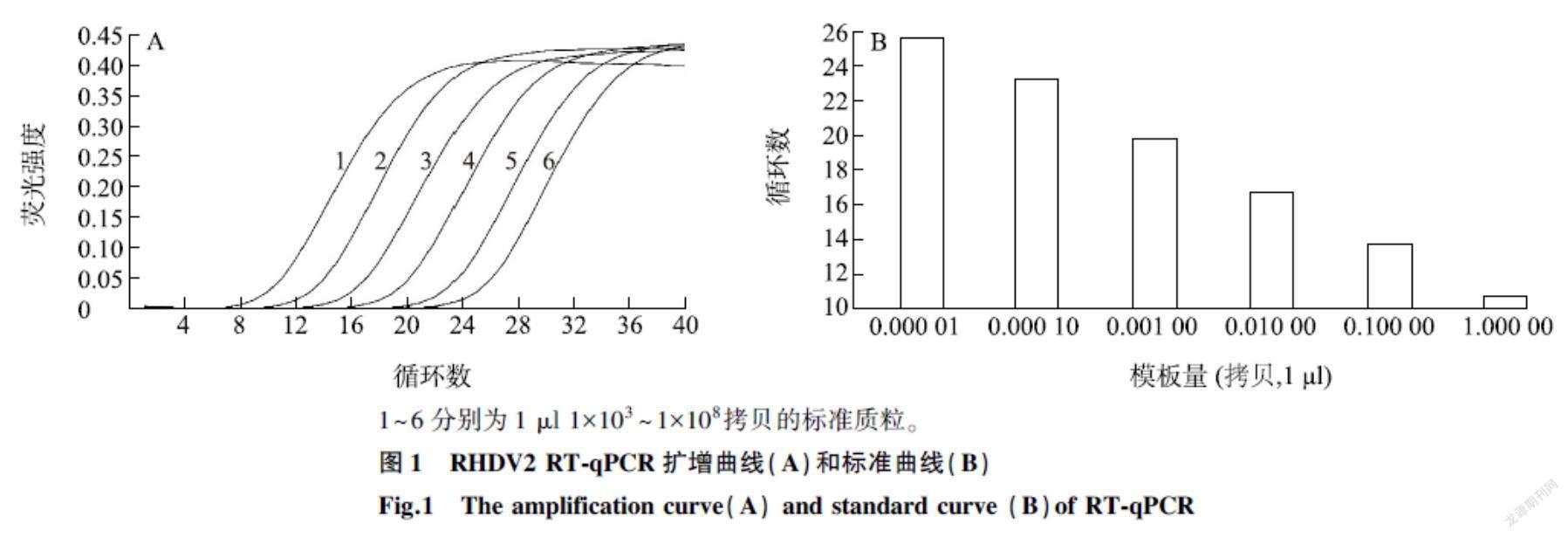
利用RHDV2分离株SC2020/04 VP60全长的引物进行PCR扩增,用实验室储存的RHDV2- SC2020 cDNA 为模板,将扩增得到的目的片段克隆到pMD19-T载体上,构建pMD19-T-SC2020-VP60质粒。经过测序鉴定,获得阳性质粒。测定DNA浓度,计算拷贝数,10倍倍比稀释,梯度为1 μl 1×103~1×108拷贝,将其作为荧光定量RT-PCR的标准品。
2.2标准曲线的绘制
利用优化的反应条件和反应体系对质粒标准品进行扩增,当质粒标准品含量在1 μl 1×103~1×108拷贝时,获得较好的扩增动力学曲线,如图1所示,标准曲线斜率为-3.072,截距为10.72 ,R2为0.999,扩增效率为111.6%,即标准曲线 Y=-3.072 x+10.72 。
1~6分别为1 μl 1×103~1×108拷贝的标准质粒。
2.3TaqMan荧光定量RT-PCR方法的特异性
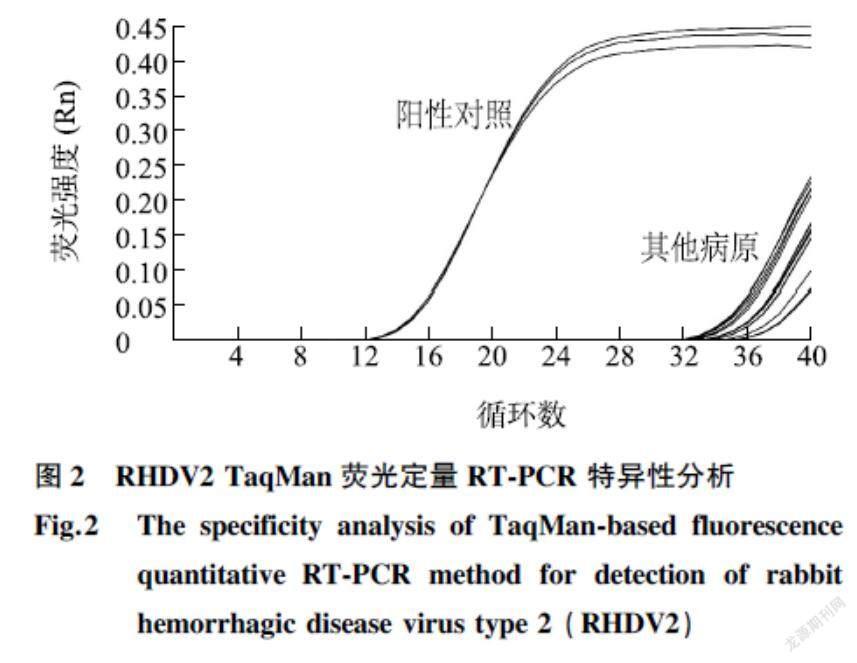
以1 μl 1×106拷贝标准质粒作为模板设阳性对照,保存的RHDV1(GI.1a株和GI.1c株)、仙台病毒(SV)和轮状病毒(RRV)cDNA为模板,检测所建立的TaqMan荧光定量RT-PCR方法的特异性。如图2所示,RHDV2 cDNA组出现特异性扩增曲线,而其他病毒cDNA样品检测结果均为阴性,说明本试验设计的引物和探针以及建立的检测方法特异性较好。
2.4TaqMan荧光定量RT-PCR方法的敏感性
对标准品质粒进行10倍梯度稀释,使其含量依次为1 μl 1×101~1×108拷贝。选取该梯度的标准品质粒进行敏感性试验。试验测得最低检出量为1 μl 10 拷贝(图3),对应Ct值约为 31.79,敏感度约为常规RT-PCR方法的100倍。
2.5TaqMan荧光定量RT-PCR方法的重复性
选取含量为1 μl 1×104~1×108拷貝的质粒标准品进行重复性试验,结果如表1所示,组内变异系数为0.23%~0.65%,组间变异系数为0.67%~1.57%,说明本试验建立的方法稳定性良好。
2.6临床病料检测
利用已建立的TaqMan荧光定量RT-PCR和常规RT-PCR方法分别对2020年4月至2020年11月份之间所接收的全国不同兔场疑似RHDV2感染的108份临床样品进行检测。结果表明,常规RT-PCR方法检测出RHDV2阳性样品67份,检出率为62.0%;TaqMan荧光定量RT-PCR方法检测出RHDV2阳性样品72份,检出率为66.7%,经核苷酸序列测定,所有阳性样品与RHDV2的同源性达99.4%以上,表明TaqMan荧光定量RT-PCR方法检测临床样品更加敏感。
3讨论
自2020年4月RHDV2被报道以来,本实验室陆续收到全国各地疑似RHDV2感染的临床样品108份,RHDV2的阳性检出率高达66.7%,充分显示出RHDV2在中国兔场已形成流行态势,这将给家兔养殖产业带来严重的威胁。但是,目前中国已建立的用于检测RHDV1型的诊断方法,如RT-PCR方法[13]和胶体金免疫层析试纸条[14]无法应用。因此,急需建立一种快速、高效和敏感的检测方法来监测和防控RHDV2的发生。
与常规RT-PCR方法相比,实时荧光定量RT-PCR技术更加便捷和灵敏,能够进行高通量和精准的定量[15-16]。在实时荧光定量PCR中常使用的荧光标记染料有SYBR Green I和TaqMan探针两种,其中TaqMan探针法是根据病毒序列特异设计的,所以TaqMan探针能靶向目的基因,在准确性和灵敏度方面明显优于SYBR GreenⅠ法,可以精准检测病原[17]。目前已建立的针对RHDV2的诊断方法有RT-PCR和基于SYBR Green I的荧光定量RT-PCR。
针对RHDV2 保守的VP60基因,本试验应用软件Primer Express设计了引物和探针,通过试验筛选引物和探针优化反应条件,成功建立了RHDV2的TaqMan荧光定量RT-PCR方法。通过绘制标准曲线和线性回归分析,可见线性关系良好(R2达到0.999);利用建立的TaqMan荧光定量RT-PCR方法检测RHDV2时,与RHDV1、SV和RRV等均无交叉反应,说明该方法具有良好的特异性;灵敏度能够达到1 μl 10 拷贝,比常规RT-PCR灵敏100倍,说明该方法灵敏度高。通过对108份临床样本进行检测,发现建立的方法阳性检出率为66.7 %,高于常规RT-PCR方法的阳性检出率,说明该方法具有较高的灵敏性。重复试验结果表明,批间和批内试验变异系数均小于2%,说明该方法有良好的重复性。
综上所述,本研究建立了基于VP60基因的TaqMan荧光定量RT-PCR 检测RHDV2的方法,此方法具有特异性强和敏感度高等优点。在临床疾病诊断中,可为RHDV2早期流行的监测和病原的诊断定量,提供一种快速、简便、有效的检测方法。
参考文献:
[1]HU B, WANG F, FAN Z, et al. Recombination between G2 and G6 strains of rabbit hemorrhagic disease virus (RHDV) in China[J]. Arch Virol, 2017, 162(1): 269-272.
[2]HU B, FAN Z, WANG F, et al. A new variant of rabbit hemorrhagic disease virus G2-like strain isolated in China[J]. Virus Res, 2016, 215: 20-24.
[3]LE GALL-RECULE G, LAVAZZA A, MARCHANDEAU S, et al. Emergence of a new lagovirus related to rabbit hemorrhagic disease virus[J]. Vet Res, 2013, 44: 81.
[4]ABRANTES J, LOPES A M, DALTON K P, et al. New variant of rabbit hemorrhagic disease virus, Portugal, 2012-2013[J]. Emerg Infect Dis, 2013, 19(11): 1900-1902.
[5]LOPES A M, ROUCO C, ESTEVES P J, et al. GI.1b/GI.1b/GI.2 recombinant rabbit hemorrhagic disease virus 2 (Lagovirus europaeus/GI.2) in Morocco, Africa[J]. Arch Virol, 2019, 164(1): 279-283.
[6]MAHAR J E, HALL R N, PEACOCK D, et al. Rabbit hemorrhagic disease virus 2 (RHDV2; GI.2) is replacing endemic strains of RHDV in the Australian Landscape within 18 months of its arrival[J]. J Virol, 2018, 92(2): e01374.
[7]PUGGIONI G, CAVADINI P, MAESTRALE C, et al. The new french 2010 rabbit hemorrhagic disease virus causes an RHD-like disease in the Sardinian Cape hare (Lepus capensis mediterraneus)[J]. Vet Res, 2013, 44: 96.
[8]魏后軍,胡波,范志宇,等. 兔出血症病毒2型的分离鉴定与序列分析[J]. 江苏农业学报, 2020, 36(2): 404-409.
[9]LE GALL-RECULE G, LAVAZZA A, MARCHANDEAU S, et al. Emergence of a new lagovirus related to rabbit haemorrhagic disease virus[J]. Vet Res, 2013, 44: 81.
[10]宋艳华,魏后军,范志宇,等. 兔出血症病毒经典毒株和变异毒株的RT-PCR鉴定[J]. 江苏农业学报, 2016, 32(5): 1117-1121.
[11]王波. 用SYBR Green Ⅰ实时荧光定量RT-PCR方法检测RHDV、RHDV2的初步研究[D]. 雅安:四川农业大学, 2016.
[12]谭永贵,刘腾,朱杰,等. SYBR Green II荧光定量PCR结合熔解曲线鉴别不同亚型兔病毒性出血症病毒方法的建立[J]. 中国动物传染病学报, 2017, 25(1): 7-11.
[13]胡波,魏后军,王芳,等. 兔出血症病毒RT-PCR检测方法的建立及其临床应用[J]. 畜牧兽医学报, 2010, 41(11): 1442-1446.
[14]蔡少平,王芳,贾华敏,等. 兔出血症病毒胶体金免疫层析试纸条诊断方法的建立及初步应用[J]. 畜牧兽医学报, 2012, 43(11): 1795-1801.
[15]吴双,姜勇,徐建生,等. 鸭坦布苏病毒、鸭肠炎病毒和番鸭细小病毒TaqMan三重实时荧光定量PCR检测方法的建立与临床应用[J].江苏农业学报,2020,36(3):626-633.
[16]温书香,安利民,赵协,等. 猪伪狂犬病毒实时荧光定量PCR检测方法的建立及初步应用[J]. 江苏农业科学,2019,47(7):50-53.
[17]蒙正群,李桂黎,周丽军,等. 兔出血症病毒TaqMan荧光定量PCR检测方法的建立[J]. 中国兽医科学, 2017, 47(6): 694-700.
(责任编辑:张震林)
收稿日期:2020-12-28
基金项目:国家自然科学基金项目(31702274);现代农业产业技术体系建设专项资金项目(CARS-43-C-1)
作者简介:陈萌萌 (1987-) ,女,连云港人,博士,助理研究员,主要从事家兔疾病防治与兽医生物技术研究。(E-mail)moonchen2010@yeah.net
通讯作者:王芳,(E-mail)rwangfang@126.com
