临沧市古茶园土壤细菌和真菌群落组成与多样性研究
2021-01-28奎玲王子君李国荣张广辉周玲
奎玲,王子君,李国荣,张广辉,周玲*
1. 云南农业大学生物大数据学院,云南 昆明 650201;2. 江苏大学药学院,江苏 镇江 212013;3. 云南聚乐文化投资有限公司,云南 昆明 650220;4. 临沧市茶叶科学研究所,云南 临沧 677000;5. 云南农业大学龙润普洱茶学院,云南 昆明 650201
土壤微生物生态是在一定时间和空间范围内由微生物的个体、种群、群落与它们所在的土壤环境通过能量流动和物质循环所组成的一个自然体。土壤和作物管理因素(例如施肥)被认为是影响土壤质量的最重要因素(Hanet al.,2007;顾松松,2019)。茶园土壤特性、土壤微生物量及其活性之间的关系研究发现,茶树的种植强度和持续时间对微生物群落结构、生物量及其功能有很大影响,其很可能是通过土壤酸化和添加肥料来实现的(Li et al.,2016;毛迎新等,2019;王海斌等,2020)。由于受到茶园土壤中微生物数量庞大、作用复杂、土壤本身的多变性与研究方法不完善等原因的限制,以往人们对茶园土壤微生物多样性的研究相对较少。近年来,随着分子生物学、宏基因组学与高通量测序技术的快速发展与完善,人们对茶园生态系统中土壤微生物群落的结构组成和生物多样性与生态因素之间复杂的相互作用有了更深入的了解。同时,也有越来越多的研究者更加关注茶园土壤微生物多样性的研究和保护(Zhao et al.,2012;Raaijmakers et al.,2016;Arafat et al.,2019;Tan et al.,2019)。有研究发现已建立的茶树根际可能含有某些抑制微生物活性的物质,相对于放线菌与真菌来说细菌似乎是最敏感的一类(Pandey et al.,1996)。在酸性茶园土壤(pH<6.0)中,土壤微生物的生长活性随 pH的降低而下降(Koga et al.,2003),但也有研究发现茶园土壤微生物通常不受土壤pH的影响,并且还发现40年和90年历史的茶树土壤中的细菌和放线菌数量仅为 10年历史的茶树土壤中的一半,细菌在根层土壤的微生物群落中占主导地位(Yu et al.,2004)。
临沧市因毗邻澜沧江而得名,是世界著名的“红茶之乡”、“黑茶之都”。自古以来,是“南方丝绸之路”和“西南丝绸茶叶之路”的重要节点,是茶马古道上的咽喉要道,也是古茶树遗产存量最大、最具代表性的地区之一。目前关于茶树土壤微生物的绝大多数研究中只关注了细菌多样性(16S),而很少关注真菌多样性(ITS),并且在海拔驱动因素上的研究更少。同时据我们所知,目前还没有关于茶树土壤微生物种群的大样本和跨区域研究数据。并且随着高通测序技术的普及,16S和ITS扩增子测序技术已成为研究环境样品中微生物群落组成结构的重要手段(毛迎新等,2019;杨广容等,2019)。在本研究中,我们对临沧市8个区县的101个具有代表性的古茶园的土壤细菌与真菌群落动态进行了研究,通过测定茶园土壤pH值,明确不同茶园的pH梯度,通过分析不同经纬度和海拔的土壤样品,研究不同种植地区中茶园土壤微生物多样性、结构与分类学组成,探讨导致土壤微生物群落产生变化的可能环境因子。另一方面,我们通过微生物分类来确定不同地区的茶园是否存在核心微生物组,并进一步确定这些核心类群的相对丰度及其在茶园微生物组中作为枢纽类群的潜在作用。本研究揭示了临沧市古茶园土壤微生物的组成结构和多样性,有利于进一步探索茶叶与其根际微生物的相互作用,为地方资源保护及茶树育种提供理论基础。
1 材料和方法
1.1 样本采集
采集云南省临沧市8个县区(临翔、双江、耿马、沧源、镇康、永德、云县、凤庆)内的101个不同海拔、不同经纬度古茶园(图 1)的根际土壤样本,每个茶园采集6个样本。首先,使用GPS仪对所采样地点茶园的经纬度、海拔进行测定;然后使用地图和无人机对采样的古茶园进行勘察,根据采样地的形状和大小,确定适当的采样方法,比如梅花形采样法、棋盘式采样法、蛇形采样法等;随后,使用事先已经消毒灭菌处理的器具进行取样,采集离地面深20 cm左右的土样并去除其中的茶树根、石头及其他杂质,每个样本采集 3份:2 mL无菌保菌管两份,50 mL无菌离心管一份,将采集的样品放于液氮罐中速冻保存。
1.2 土壤pH值的测定

图1 临沧市101个古茶园的地理分布Fig. 1 Geographical distribution of 101 ancient tea plantations in Lincang City
用0.20 mm(50目)的尼龙筛将风干处理的土壤进行筛分,然后使用分辨率为0.001 g的天平称取 (4.000±0.02) g土壤样品于25 mL离心管,加入超纯水 10 mL[土壤∶水=1∶2.5 (m/V)],随后利用旋涡混匀器最大振荡频率10 min,使土壤充分分散,室温放置 30 min。这期间使用 pH标准溶液:pH=4.01、pH=6.86、pH=9.18、pH=12.46对pH仪进行矫正,随后使用玻璃电极对处理后的土壤进行pH测定,每个样品重复测定5次(Yan et al.,2020;Arafat et al.,2019)。
1.3 DNA提取、文库制备和测序
根据Omega Biotek公司的E.Z.N.A.®Soil DNA试剂盒的操作说明对全部的土壤样品进行总 DNA的提取。之后利用琼脂糖凝胶电泳检测DNA的纯度,同时使用安捷伦Bioanalyzer 2100系统(Agilent Technologies,美国)测量DNA的浓度,取适量的样本 DNA于离心管中,使用无菌水稀释样本至 1 ng·μL-1。以稀释后的基因组DNA为模板,根据测序区域的选择,使用引物 F341(5′-CCTAYGGG RBGCASCAG-3′)和 R806(5′-GGACTACNNGGG TATCTAAT-3′)对16S rRNA的V3—V4区域进行扩增(Wanyonyi et al.,2017;Jousselin et al.,2016),引物 ITS-1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和 ITS-1R(5′-GCTGCGTTCTTCATCGA TGC-3′)对 ITS1 区域进行扩增(Gardes et al.,1993;Li et al.,2019),所有引物都带有Barcode。采用New England Biolabs公司的 Phusion®High-Fidelity PCR Master Mix with GC Buffe和高效高保真酶进行PCR,16S rRNA的V3—V4区域和ITS1区域扩增PCR反应体系为:Phusion Master Mix 15 μL,Primer(F/R)1.5 μL,gDNA 10 μL,ddH2O 2 μL,PCR 反应程序为:98 ℃ 1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃30 s(30个循环);72 ℃ 5 min。使用Qiagen凝胶提取试剂盒纯化PCR产物(Qiagen,Germany)。遵循制造商的建议,使用TruSeq®DNA PCR-Free样品制备试剂盒(Illumina,USA)制备测序文库,并添加索引代码。在 Qubit @ 2.0荧光计(Thermo Fisher Scientific,美国)和安捷伦Bioanalyzer 2100系统(Agilent Technologies,美国)上进行文库质控。最后,该文库在Illumina NovaSeq 6000平台上测序,并产生了250 bp的双末端读段。
1.4 测序数据处理
根据barcode序列和引物序列从下机数据中拆分出各样本数据,并截去其中包含的barcode序列和引物序列。先使用FLASH V1.2.7(Magoč et al.,2011)对每个样本的 reads进行拼接,得到的拼接序列为原始Tags数据(Raw Tags);再根据QIIME2 V2019.10(Caporaso et al.,2010;Bolyen et al.,2019)质量控制流程获得高质量的 Tags数据(Clean Tags);最后将 Tags数据与参考数据库(使用UCHIME算法的Silva数据库)(Quast et al.,2013)进行比较检测嵌合体序列,去除其中的嵌合体序列,并得到最终的有效数据(Effective Tags)。
使用 Uparse V 10.0.240(Edgar,R. C.,2013)软件进行序列分析,将所有的样品的有效数据根据相似度≥97%的一致性分配给相同的OTUs,最终筛选每个OTUs的代表性序列以作进一步分析。对于每个代表性序列,使用SILVA 132数据库(用于16S rRNA基因序列)和UNITE数据库(用于ITS基因序列)(Abarenkov et al.,2010)来指定分类学隶属关系。为了研究不同的OTUs系统发育关系以及不同样品(或者不同组)中优势种的差异,使用Muscle V 3.8.31(Edgar,2004)软件进行了多序列比对。以序列最少的样品为标准对OTUs的丰度信息进行归一化,随后基于归一化的数据对alpha多样性和beta多样性进行分析。
1.5 数据统计和生物信息学分析
使用QIIME 2软件计算样本Chao1和Shannon指数来反映样本内物种的复杂性与多样性(Li et al.,2016;Bolyen et al.,2019),并使用 agricolae包的 kruskal函数(alpha=0.05,p.adj=“bonferroni”)进行多组间的差异分析。Beta多样性分析用于评估样本在物种复杂度上的差异,使用R V3.6.3软件的vegan软件包进行NMDS,Anosim与MRPP分析,用QIIME 2计算Unifrac距离并构建UPGMA聚类树。使用psych包的corr. test函数计算微生物群落的相对丰度与环境和地理因子的 Spearman相关系数并检验其显著性,并用pheatmap包进行可视化。利用 vegan软件包进行冗余分析(RDA)和Mantel-test分析来比较茶园环境因子与微生物群落组成及结构的相关性。
2 结果
共采集了临沧市101个古茶园的606份土壤样本。但由于保存和运输过程中的不可控因素,失去了107份土壤样本;对剩余的土壤样本进行总DNA的提取检测、PCR扩增及文库构建等实验,最终从临沧市101个古茶园中共获得448份满足上机测序的样品。并且对这101个古茶园的地理位置进行统计分析发现,其分布于23—25°N和98—101°E之间,海拔介于900—2700 m间,每个古茶园含有3—6个不等的土壤样品(图1)。
2.1 101个古茶园土壤平均pH值
对上述448份土壤样品的pH值进行了测定,结果发现,所有古茶园土壤的pH平均值介于3.90—6.30之间,全市平均值为4.66。参照前人的研究(Ruan et al.,2007;Yan et al.,2020)我们将测定的茶园土壤的pH平均值分为小于4.5,介于4.5—5.5之间以及大于5.5g共3个不同梯度,对我们的数据进一步分析发现,pH平均值小于4.5的采样地有31个,pH平均值介于4.5—5.5的采样地有68个,pH平均值大于5.5的采样地有2个。
2.2 细菌和真菌群落的组成
经过拼接、质控与嵌合体过滤后,最终从 448份土壤样品中共获得84691条属于16S rRNA基因V3—V4区域的有效序列与53228条属于ITS区的有效序列。在 97%的序列相似度基础上(Hume et al.,2019),将获得的有效序列进行 OTU聚类,最终的数据集由主要隶属于 65个细菌门的 21293个细菌的以及隶属于17个真菌门的14978个真菌的可操作分类单元(OTU)组成。当OTUs的稀疏曲线逐渐趋于平缓时,表明测序深度已经基本覆盖到样品中所有的物种,说明我们的数据可以进行下游分析。将获得的所有OTUs分别从门到种的水平上进行了物种注释,结果发现,在门分类水平上,占据主导地位的细菌主要包括 Proteobacteria(30.9%)、Chloroflexi(11.9%)、Bacteroidetes(6.4%),Acidobacteria(6.3%)、Actinobacteria(5.2%)、Firmicutes(4.6%),占到所有细菌和古细菌序列的65%以上,同时还有14.2%的OTUs不能被归类。在科分类水平上,不能被归类的 OTUs增加到53.1%,而那些被归类到的细菌 OTUs的优势科主要包括 Ktedonobacteraceae(4.7%)、unidentified_Gammaproteobacteria(3.5%)和Gemmatimonadaceae(1.9%)。对于真菌来说,在门分类水平上主要包括 Ascomycota(34.7%)、Basidiomycota(16.6%)、Glomeromycota (7.7%),未分类的OTUs占到36.9%。在科分类水平上,优势类群为 Archaeorhizomycetaceae(4.8%),其次是 Glomeraceae(3.2%)、Clavariaceae(1.2%),未被分类的比例占到60.0%。
2.3 不同pH梯度下茶园土壤细菌和真菌群落组成及多样性分析
根据2.1的结果,我们按照6个pH值梯度对微生物群落组成进行分析发现,在门分类水平上,对前10个细菌群落来说(下同),pH值的变化与群落的相对丰度变化间没有明显的关系,其中Acidobacteria、Actinobacteria和Proteobacteria在6个分组中都是优势细菌门(相对丰度>10%),Acidobacteria和 Proteobacteria的相对丰度随土壤pH的升高而先降后升,与土壤pH的变化没有显著的相关性,同时Actinobacteria的相对丰度变化趋势与Acidobacteria的相反(图2a)。对前10个真菌群落来说(下同),随着pH值的升高群落的相对丰度逐渐下降,其中Ascomycota和Basidiomycota都是优势菌门,其相对丰度随着pH值的升高逐渐降低,Mortierellomycota的相对丰度随着 pH值的升高逐渐升高,在高pH组中为优势菌门,其相对丰度相对于低pH组差异显著(图2b)。

图2 不同pH梯度分组中土壤细菌和真菌群落的相对丰度和α-多样性指数Fig. 2 Relative abundance and α-diversity index of soil bacterial and fungal communities in different pH gradient groups
在属分类水平上,除在最高pH组外,前20个细菌和真菌(下同)中菌属的相对丰度与组成在其余组间均相似,其中Arthrobacter和Archaeorhizomyces在所有分组中分别是主要的细菌属和真菌属,Hygrocybe在除最高pH组外其余组中为主要的真菌属,Penicillium和Saitozyma在低pH组中为重要的真菌属,而在高pH组中变为Mortierella。
α多样性分析表明,pH为4.5—5.0组中土壤细菌群落的 Chao1指数和 Shannon指数均显著高于pH为3.5—4.0和4.0—4.5组(P<0.05),并且pH为5.0—5.5组中Shannon指数也显著高于pH为3.5—4.0和 4.0—4.5组。相比之下,土壤真菌群落的Chao1指数和Shannon指数在所有分组之间没有显著差异(图2c)。细菌和真菌群落的OTUs数在pH为4.5—5.0组中均最高,并且所有分组间细菌和真菌群落共有的OTUs数分别为6073、2260个。
此外,对不同梯度pH分组中茶园土壤微生物群落的 β多样性的分析发现,细菌和真菌群落的NMDS分析均无法将其从6个不同梯度分组中的区分开来(图3a、b)。但基于Anosim和MRPP函数对组间群落结构差异显著性进行检验发现,不同pH梯度分组间有存在差异且具有统计学显著性的分组,其中组间差异显著大于组内差异的分组在真菌中较细菌更多,但这些分组间的差异相关性都较低(表1)。基于UPGMA聚类结果发现(图4a、b),pH为4.5—5.0和5.0—5.5组间细菌群落结构相似性最高,真菌群落结构相似性在pH为4.0—4.5和4.5—5.0组间、5.0—5.5和5.5—6.0组间最高,并且最高pH组中细菌和真菌的组成与其它分组中其的组成差异最大,这些结果说明茶园土壤微生物群落的复杂化和多样化在一定的pH范围内趋于相对稳定的状态。
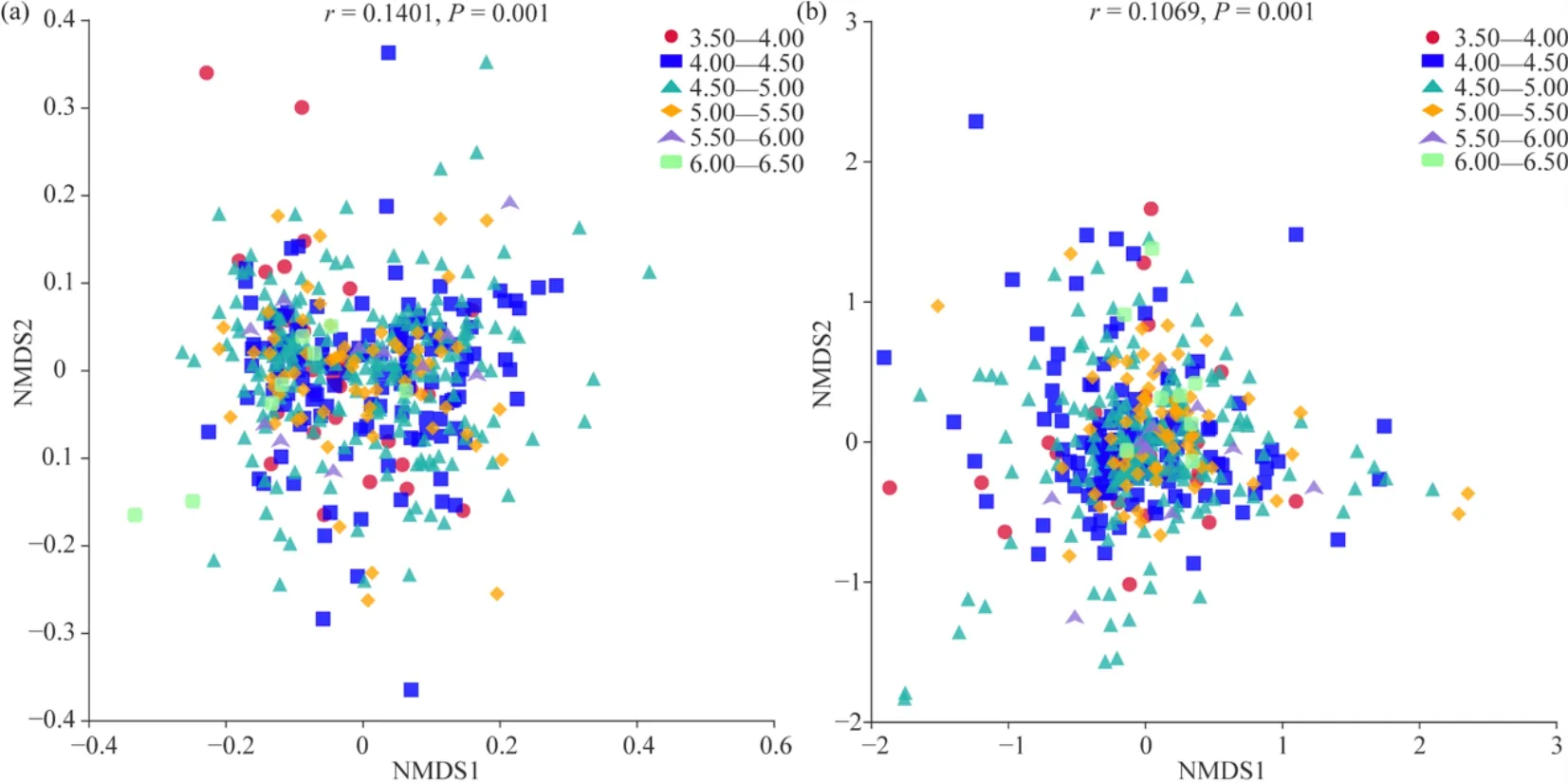
图3 不同pH分组中土壤细菌(a)和真菌(b)群落的NMDS分析Fig. 3 NMDS analysis of soil bacterial (a) and fungal (b) communities in different pH groups
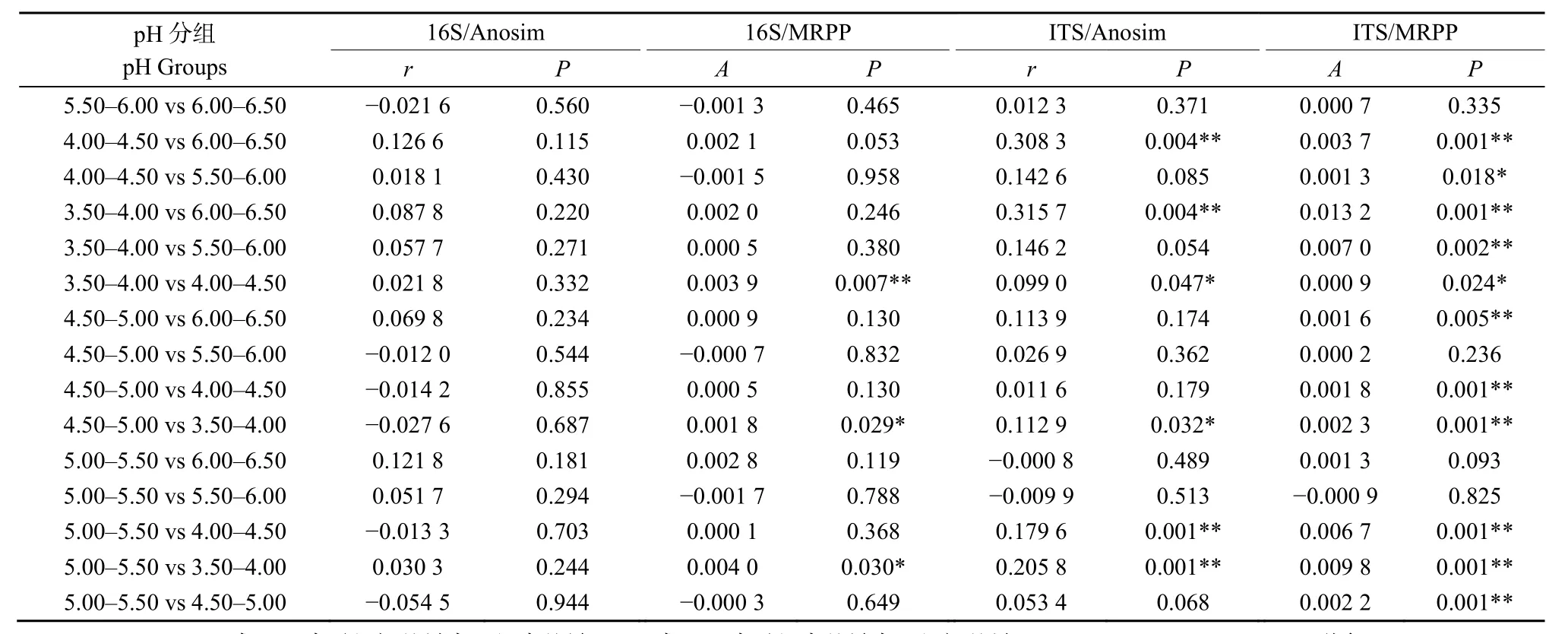
表1 Anosim和MRPP对不同pH梯度组的土壤细菌和真菌群落显著性检验结果Table 1 Significance test by Anosim and MRPP of soil bacterial and fungal community in different pH gradient groups
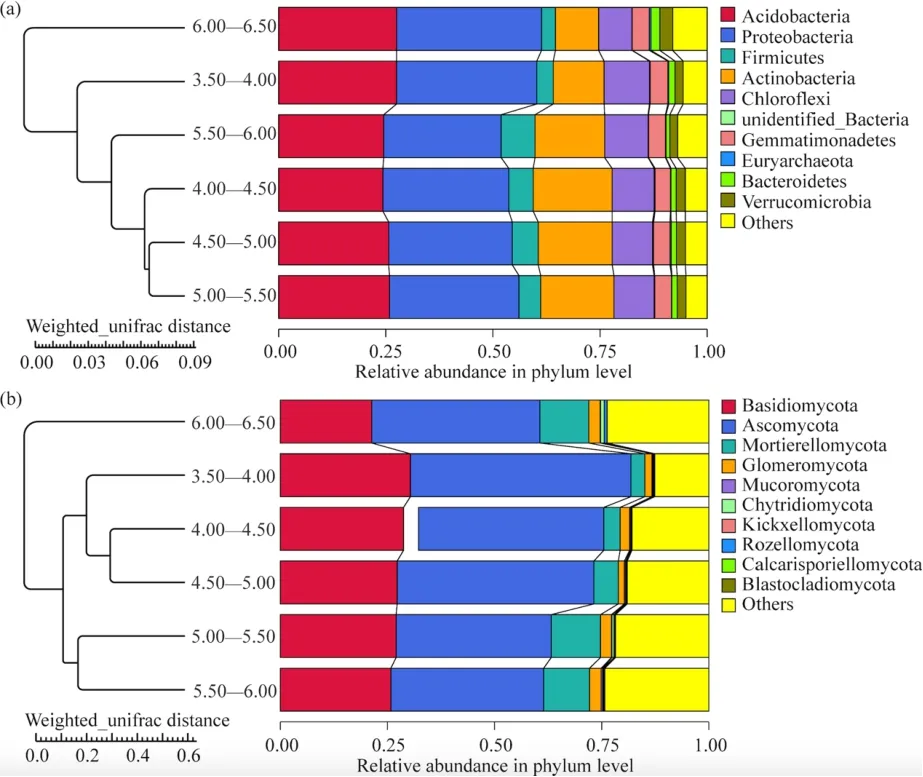
图4 不同pH分组中土壤细菌(a)和真菌(b)群落的UPGMA聚类树分析Fig. 4 UPGMA cluster tree analysis of soil bacterial (a) and fungal (b)communities in different pH groups
2.4 不同海拔地区茶园土壤细菌和真菌群落组成及多样性分析
根据前人对土壤微生物与海拔的研究结果(Shen et al.,2015;Tian et al.,2017;Nottingham et al.,2018;Wang et al.,2019),我们选择在这种大尺度海拔梯度上对茶园土壤细菌和真菌群落的组成及多样性分析进行了研究,结果发现14个不同海拔地区微生物群落的整体结构相近,在门分类水平上,海拔的变化与细菌群落的相对丰度变化没有直接的关系,其中Acidobacteria和Proteobacteria在所有分组中都是优势细菌门,其相对丰度随着海拔的升高基本呈现上升的趋势,Actinobacteria是除高海拔组外其他组中的优势细菌门,其与 Firmicutes的相对丰度随海拔的升高基本呈现相反的趋势(图5a)。随海拔的升高真菌群落的相对丰度呈现先升后降的趋势,其中Ascomycota和Basidiomycota在所有分组中都是优势真菌门,其中Ascomycota的相对丰度随海拔的升高基本呈现上升的趋势,而Basidiomycota则相反,其在最高海拔组中占绝对优势(52.4%)(图5b)。
在属分类水平上,细菌属的相对丰度随着海拔的升高呈现递减的过程,并且其在低海拔组中相对于高海拔组中差异显著,其中 Arthrobacter在除高海拔组外其余组间都是主要的细菌属,其与Tumebacillus在海拔 900 m组中占主要地位,而Massilia在海拔1200 m组中占主要地位。真菌属的相对丰度随海拔的改变没有明显的趋势改变,Archaeorhizomyces和Hygrocybe的相对丰度随着海拔的升高基本呈现先增再减的趋势,其在除低海拔组中都基本是主要的真菌属,而 Penicillium和Saitozyma在低海拔组中是主要的真菌属,并且在海拔2700 m组中占主要地位的优势菌属为Russula和Coprinellus。
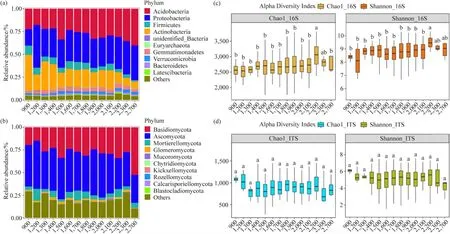
图5 不同海拔分组中土壤细菌和真菌群落的相对丰度和α-多样性指数Fig. 5 Relative abundance and α-diversity index of soil bacterial and fungal communities in different altitude groups
α多样性分析发现,海拔2200 m组中土壤细菌群落的Chao1指数(除2300 m组外)和Shannon指数(除2300 m和2700 m组外)显著高于其余组(图5c),土壤真菌群落的Chao1指数和Shannon指数在所有分组间没有显著差异,但它们在海拔900 m组中均最高(图5d),表明土壤细菌和真菌群落的α多样性最高的分别是海拔2200 m和900 m。细菌和真菌群落的OTUs数在海拔1400 m和1800 m组中分别最高,所有分组间共有2869个细菌OTUs序列,但仅共有453个真菌OTUs序列。
此外,对不同海拔分组中茶园土壤微生物群落的 β多样性分析发现,细菌和真菌群落的 NMDS分析均无法将其从不同海拔分组中的区分开来(图6a、b)。但基于Anosim和MRPP检验发现,不同海拔分组间有存在差异且具有统计学显著性的分组,其中细菌群落在海拔900 m相对于1300 m与2200 m组具有较高的显著相关性(表 2)。基于UPGMA聚类结果发现,海拔900 m与1200 m组中细菌的结构较其他分组差异依次增大,但真菌的结构较其他分组差异增大是在海拔2700 m组,并且其余分组间细菌和真菌的结构基本在临近海拔组中相似,这些结果说明随着海拔的不断升高,细菌和真菌群落趋于复杂化和多样化,并且当海拔升高的一定高度时,其复杂化和多样化水平又开始下降(图7a、b)。

图6 不同海拔分组中土壤细菌(a)和真菌(b)群落的OTUs分析Fig. 6 OTUs petal graph analyses of the soil bacterial (a) and fungal (b) communitiesin in different altitudes groups
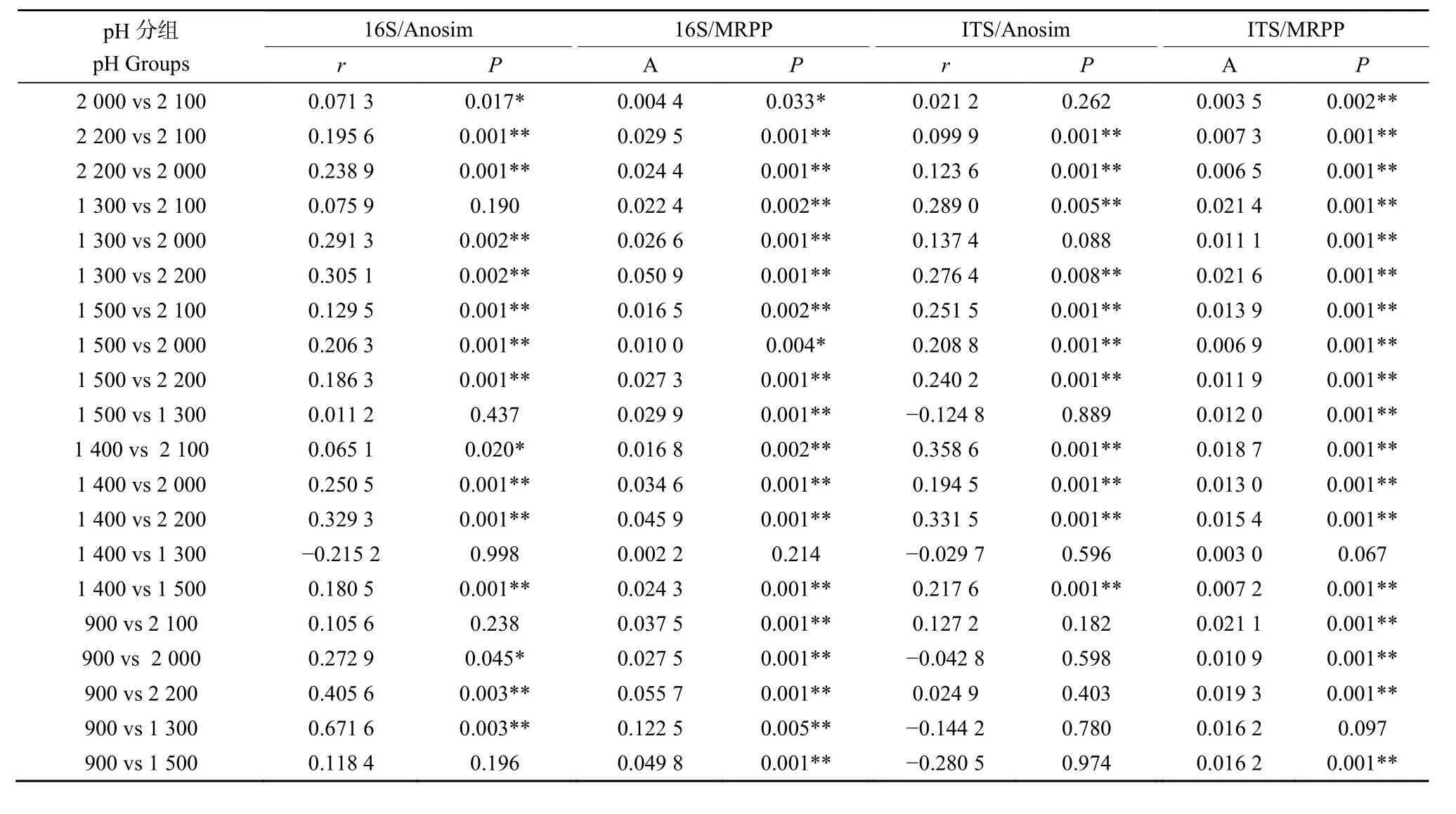
表2 Anosim和MRPP对不同海拔分组的土壤细菌和真菌群落显著性检验结果Table 2 Significance test by Anosim and MRPP of soil bacterial and fungal community in different altitudes groups
2.5 不同地区茶园土壤细菌和真菌群落组成及多样性分析
按照采样点的地理分布,我们对分布于8个县区的古茶园进行了分析,在门分类水平上,不同地区茶园土壤细菌和真菌群落的相对丰度没有明显变化,但其相对丰度组成有着一定的差别,Acidobacteria和Proteobacteria在所有县区都是优势细菌门,其中“CY”中 Acidobacteria的相对丰度显著高于“LX”和“SJ”,并且 Actinobacteria和Firmicutes的相对丰度在“LX”和“SJ”中相比于其它6个县区都差异显著,Chloroflexi在所有县区也占有7.7%—10.3%的相对丰度(图8a)。相对丰度占到绝对优势的Ascomycota和Basidiomycota在所有县区都是优势真菌门,其中 Basidiomycota的相对丰度在“CY”中最高且差异显著相对于其它7个县区(图8b)。

图7 不同海拔分组中土壤细菌(a)和真菌(b)群落的NMDS分析Fig. 7 NMDS analysis of soil bacterial (a) and fungal (b) communities in different altitudes groups
在属分类水平上,细菌群落的相对丰度在“LX”和“SJ”中没有显著差异,并且“LX”和“SJ”中细菌群落的相对丰度远大于其他 6个县区,其中Arthrobacter、Bacillus和Kitasatospora是占比较高的主要细菌属。同时也发现细菌群落的相对丰度在其它6个县区中也没有显著差异,其中Acidibacter为主要细菌属。真菌属的组成和丰度在所有县区中都存在差异,其中Amphinema和Inocybe是“CY”中最主要的真菌属,Archaeorhizomyces是其余7个县区中主要的真菌属,并且“FQ”、“GM”和“SJ”主要的真菌属还有Hygrocybe和Mortierell,Mortierell也是“LX”和“YX”的主要真菌属,同时Penicillium也是“SJ”的主要真菌属。
α多样性分析发现,“SJ”中土壤细菌群落的Chao1指数显著低于“YD”、“YX”和“ZK”,“LX”的Chao1指数也显著低于“YD”和“YX”,并且“LX”和“SJ”中土壤细菌群落的Shannon指数显著低于其余组,说明“YD”和“YX”中土壤细菌群落的α多样性最高(图8c)。土壤真菌群落的Chao1指数和Shannon指数在所有分组之间没有显著差异,与前面的分组类似(图8c)。细菌和真菌群落的OTUs数分别在“SJ”与“LX”中最多,所有分组间共有 4389个细菌和 1564个真菌的OTUs序列。

图8 不同地区分组中土壤细菌和真菌群落的相对丰度和α-多样性指数Fig. 8 Relative abundance and α-diversity index of soil bacterial and fungal communities in different regional groups
β多样性分析发现,细菌和真菌群落的NMDS分析均无法将其从 8不同县区组中区分开来(图9a、b)。但基于Anosim和MRPP检验发现,不同地区组间有存在差异且具有统计学显著性的分组,其中细菌和真菌群落在“LX”中相对于其余分组具有较高的显著相关性,并且真菌群落在“CY”中相对于其余分组也具有较高的显著相关性(表3)。基于UPGMA聚类结果发现,“LX”与“SJ”,“YD”与“YX”中细菌和真菌的结构较其它组都相似性最高,“CY”中真菌的组成与结构较其它分组差异最大,这些结果说明不同地区茶园土壤细菌和真菌群落的组成与结构存在着一定差异和相似(图10a、b)。
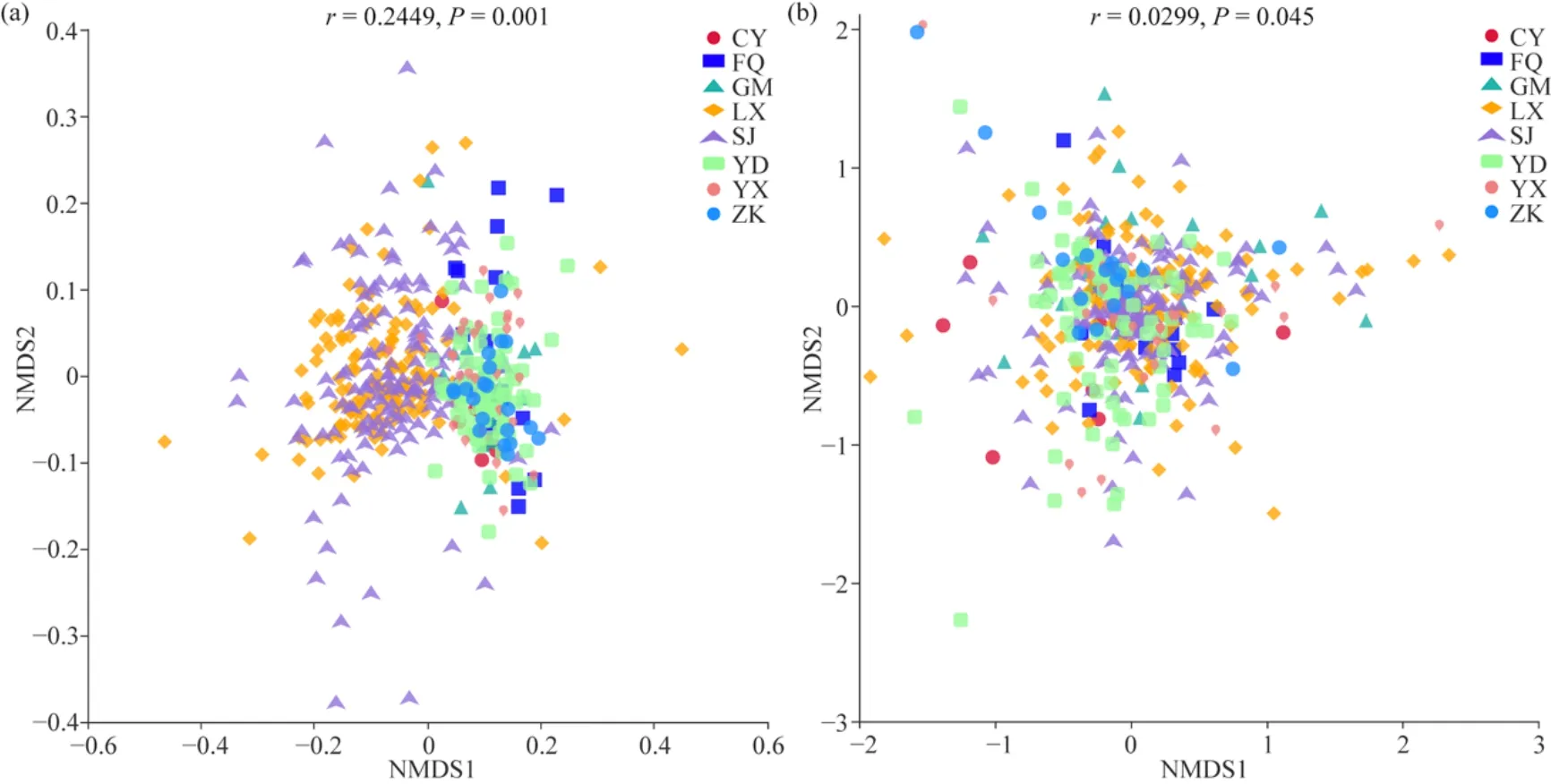
图9 不同区域分组中土壤细菌(a)和真菌(b)群落的NMDS分析Fig. 9 NMDS analysis of soil bacterial (a) and fungal (b) communities in different regional groups

表3 Anosim和MRPP对不同区域分组中土壤细菌和真菌群落显著性检验结果Table 3 Significance test by Anosim and MRPP of soil bacterial and fungal community in different regional groups

图10 不同区域分组中土壤细菌(a)和真菌(b)群落的UPGMA聚类分析Fig. 10 UPGMA cluster tree analysis of soil bacterial (a) and fungal (b)communities in different regional groups
2.6 茶园土壤微生物群落组成与环境和地理因子的冗余分析和相关性分析
冗余分析结果表明,前两个坐标轴仅分别解释了细菌和真菌群落与土壤环境和地理因子之间关系的17.11%和33.95%。经度,纬度与海拔是显著影响茶园土壤细菌群落的主要因素,同时海拔也是显著影响土壤真菌群落的主要因素(图11a、b)。Mantel-test分析进一步表明,在茶园系统中环境因子——pH值对群落作出的“选择”能力有限,地理因子——海拔与纬度对其的影响相对更强烈(表4)。Spearman相关性分析被用来确定细菌和真菌群落的相对丰度与环境因子和地理因子之间的关系,我们发现除细菌门中的Proteobacteria外,其余门类都与纬度呈现极显著正或负相关,并且经度与海拔对一些细菌门类也有类似的现象(图11c),同时在属分类水平上也发现,绝大多数细菌属与纬度,海拔呈现极显著正或负相关(图 11e),但在真菌门或属中都没有观察到类似的现象(图11d、f)。
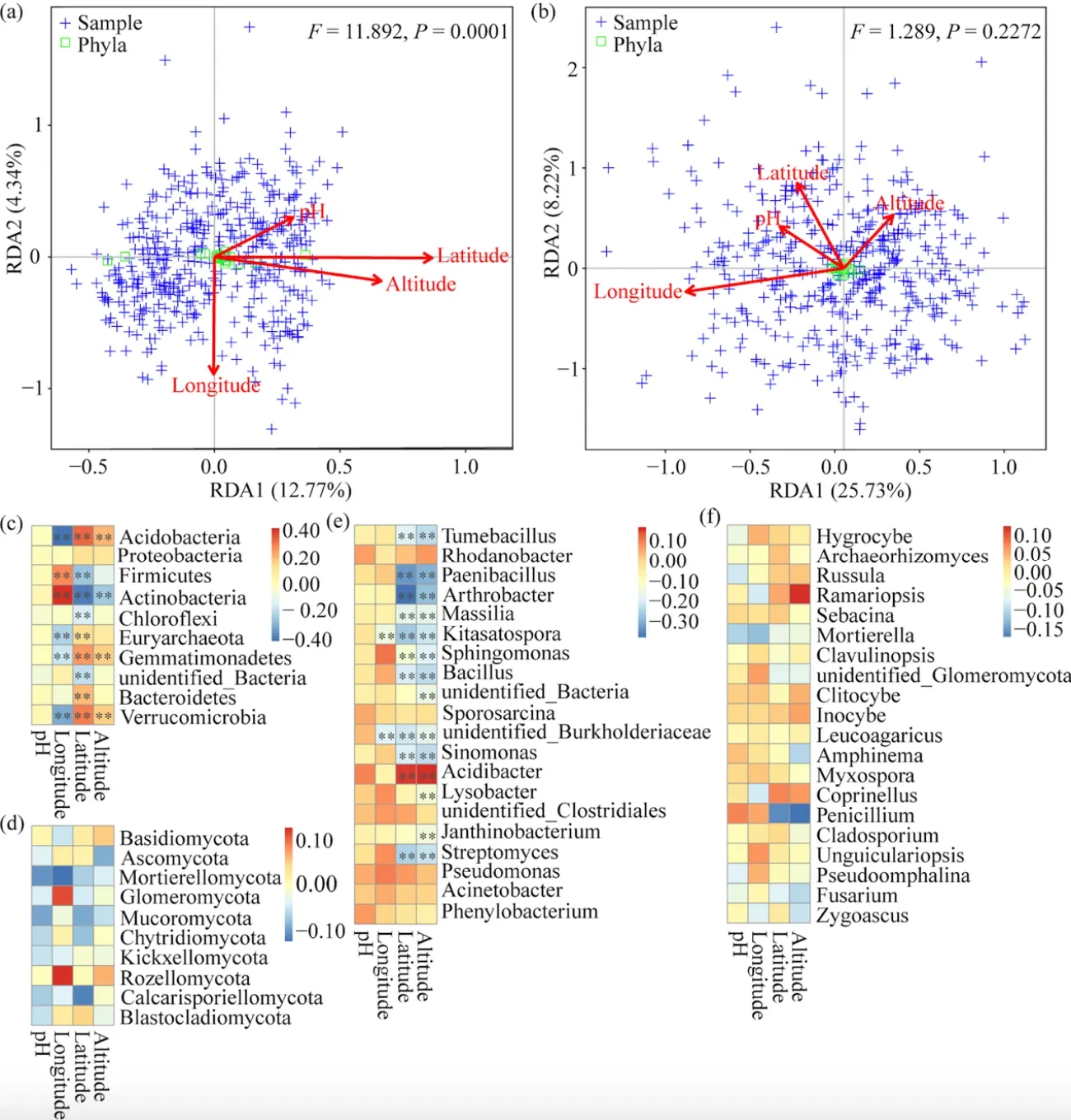
图11 茶园土壤细菌(a)和真菌(b)群落的组成与环境和地理因子的冗余分析Fig. 11 Redundant analysis of the composition of soil bacterial (a) and fungus (b) communities and environmental and geographic factors in tea plantations
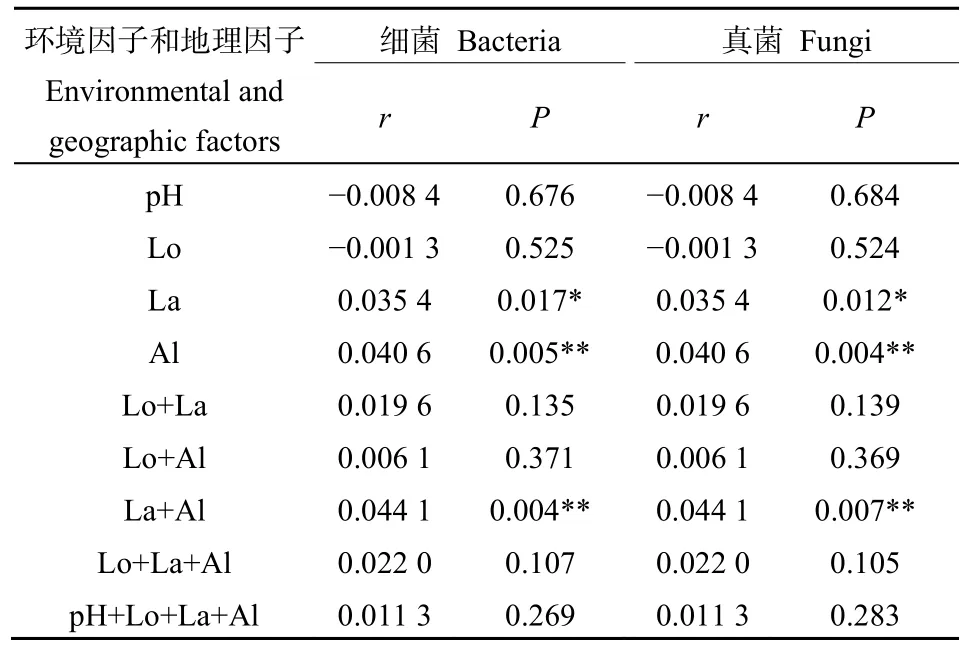
表4 环境和地理因子与细菌和真菌群落组成的Mantel-test分析Table 4 Mantel-test analysis of environmental and geographic factors and bacterial and fungal community composition
3 讨论
土壤-植物生态系统作为生物圈的基本结构单元,对全球性的能量、物质循环和转化具有中重要的作用,其中最活跃和具有决定性影响的土壤微生物在物质的循环与能量的交换,土壤的形成与发展、植物与土壤相互作用,系统中所有已知的生态学过程的驱动,以及系统的可持续发展等方面具有积极的作用(Urbina et al.,2018;Tan et al.,2019)。先前的研究发现,适宜茶树生长的土壤pH为4.0—6.5,其中最适的土壤pH值为4.5—5.5,当土壤pH值低于4.0时茶树的生长受到限制,土壤的理化性质将进一步的恶化;而当pH值高于6.5时茶树的生长逐渐停滞,同时还伴随着生长不良的现象,严重时甚至会导致植株的死亡(Ruan et al.,2007;Yan et al.,2020)。 中国茶园土壤酸化程度日益严重,茶园土壤的pH平均值为4.68,比森林土壤与经济作物土壤都低;同时对云南省内161个的土壤样本的pH值研究发现,其平均值为4.60,pH<4.5 的占到 53.2%(Guo et al.,2010;Yan et al.,2020)。我们的研究发现,临沧市内具有代表性的古茶园的土壤pH平均值为4.66,这与Yan et al.(2020)的研究结果相类似,其中有 30.7%的古茶园的土壤pH值小于4.5,只有67.3%的土壤对茶树的生长最适宜。
一些研究发现,相对于8年与90年的茶园来说,50年的茶园中具有相对较高的群落多样性(Xue et al.,2006);茶树的种植强度和种植年限对微生物群落结构,生物量及其功能有很大影响(Han et al.,2007);荒地、茶园和林地之间的微生物遗传多样性指数存在显着性差异,并且不同年龄的茶园,其土壤微生物遗传多样性指数,微生物生物量间也存在差异(Xue et al.,2007;Xue et al.,2008),这些结果表明茶园单一连作、茶龄、不同管理模式以及土地利用类型均对茶园土壤微生物群落多样性,及其组成与结构均有显着影响。本研究中,所有茶园采样地土壤中的 Acidobacteria和 Proteobacteria(Alpha、Delta、Gamma)都是优势细菌门,同时Ascomycota和Basidiomycota都是优势真菌门,这与前人的研究结果类似,但其中一些细菌和真菌群落的组成与结构与单一连作和不同管理模式下的茶园土壤中微生物群落间还是存在着一些显著区别(Zhao et al.,2012;Li et al.,2016;Arafat et al.,2019;Tan et al.,2019)。目前对Acidobacteria的生态学和新陈代谢尚无很好的了解,但这些细菌可能是生态系统的重要贡献者,因为它们在土壤中特别丰富,特别是在资源利用率非常低的土壤中最为丰富(Quaiser et al.,2003;Fierer et al.,2007);Alphaproteobacteria可以在非常低的营养水平生长,能够在与植物共生的过程中诱导固氮,并且其和Gammaproteobacteria与大量的可用营养物质有关,同时Gammaproteobacteria中的成员被证明通过非核糖体肽合成酶来控制疾病抑制活性(Mendes et al.,2011;Li et al.,2016);Deltaproteobacteria是硫循环厌氧过程的重要贡献者;Ascomycota能够促进土壤中动物和植物遗骸的腐烂,并分解其中的有机物使其被植物重吸收(Mendes et al.,2011);Basidiomycota是真菌中最高等的一门,与植物共生形成菌根,有利于作物的栽培和造林,并且其与人类的生活关系密切。
之前的研究已经证实,Bacillus的许多种对已建立的茶树的根面和根际都有很好的适应性,其中枯草芽孢杆菌(BacillusSubtilis)和芽孢杆菌(B.mycoides)与茶根关系密切,它们构成了细菌种群的主要部分,即使在不利时期也是如此;并且其作为茶树根际中的优势细菌通过抑制菌丝体的生长并引起其结构异常,而表现出对真菌分离物的拮抗活性(Pandey et al.,1997;Singh et al.,2007)。Bradyrhizobium、Mycobacterium和Sphingomonas的相对丰度随着茶树种植年限的增加逐渐降低,Granulicella则相反,但对其生理代谢功能知之甚少,其中Bradyrhizobium在促进植物生长方面至关重要(Antoun et al.,1998;Wang et al.,2010)。不同树龄茶树根际中有大量的固氮菌,其中青壮年茶树根际固氮菌的种类和数量都最为丰富。我们的研究发现,除Bacillus在所有的采样地占有一定比例外,没有发现其余菌属明显的存在。
茶园最适的土壤 pH值对土壤中微生物的生长和繁殖是有利的,但伴随着茶园茶树单一连续的种植,化肥(特别是氮肥)日积月累的使用,有机质的积累,以及受自身因素等方面的影响,使得茶园土壤酸化程度不断加深,进而导致土壤中绝大多数适宜生存的有益微生物的种类和数量大幅度减少,并且其生物活性也变得较低(Yu et al.,2004;Abe et al.,2006;Ruan et al.,2007;Li et al.,2016;Yan et al.,2018)。有研究表明虽然森林土壤和茶园土壤具有相似的酸性 pH值,但它们之间的群落是不同的,说明茶园土壤中独特的微生物群落组成与结构并不是仅仅由pH所塑造(Yao et al.,2000)。Koga et al.(2003)研究显示在酸性茶园土壤中,土壤微生物的生长活性随 pH的升高表现为先升后降低的趋势。施加石灰可以控制茶园土壤酸化的问题,石灰的施加对土壤微生物群落结构有显著影响,并且土壤中微生物群落的结构多样性随石灰浓度的增加而增加(Xue et al.,2010)。但Yu et al.(2004)对连续种植茶树引起的土壤酸化及其对根际微生物的种群分布和群落结构的研究发现土壤微生物通常不受土壤pH值的影响。本研究发现茶园土壤细菌和真菌群落的组成和结构与pH的变化呈现单峰模式,真菌相对丰度受pH的影响较细菌更明显,但其多样性与pH的相关性较细菌更弱,细菌最适宜生活的pH值范围为4.5—6.0,而真菌为4.0—5.5,这与茶树适宜生长的土壤pH值研究结果相呼应(Ruan et al.,2007;Guo et al.,2010;Yan et al.,2020)。Li et al.(2016)的研究发现,茶园土壤中只有Acidobacteria中的Granulicella随着 pH的降低而显著增加,而Acidobacteria的相对丰度与土壤pH没有显著的相关性,这与我们的研究结果一致。同时一些研究发现,土壤细菌群落通常与土壤pH密切相关,其相对丰度和多样性与pH呈正相关,这种模式既适用于总体细菌群落组成,也适用于单个细菌群的组成,但对真菌来说,其相对丰度不受pH的影响,并且其多样性仅与pH呈弱相关,这表明茶园生态系统与其它如农业生态系统相比具有一些相似性和特殊性(Jones et al.,2009;Rousk et al.,2010;Li et al.,2016)。此外,本研究还发现Archaeorhizomycetes在所有分组中均是优势真菌属,并且在低pH梯度组中的相对丰度较高。序列特征表明Archaeorhizomycetes在低pH和高养分转化的深层土壤中占据着植物根际,其相对丰度与真菌植物病原体Typhula,腐生真菌Exophiala,Suillus外生菌根家族,以及Tubeufia和Omphalotus均显着相关,它们都参与了植被的腐烂过程(Carrino-Kyker et al.,2016;Choma et al.,2016;Pinto-Figueroa et al.,2019)。
先前的研究发现,土壤微生物多样性,群落组成与结构,及其丰度与海拔具有显著相关性,土壤微生物多样性随海拔升高而下降(Tian et al.,2017;Li et al.,2018;Nottingham et al.,2018),但一些研究还发现,土壤微生物不遵循动植物的海拔多样性模式(Fierer et al.,2011),并且其中不同微生物类群呈现出不同的海拔分布规律;Bryant et al.(2008)发现细菌中的Acidobacteria的丰富度与多样性随海拔升高而单调降低;Wang et al.(2011)的研究发现细菌沿着海拔梯度呈现单调递增模式;Singh et al.(2012)发现土壤细菌多样性在海拔梯度上呈现单峰模式,但古细菌多样性则表现出双峰模式;Wang et al.(2019)发现各种固氮菌类群显示出不同的丰度-海拔关系;Tian et al.(2017)发现真菌的丰富度随着海拔的升高而降低,但其均匀度与海拔高度没有显着相关性;Shen et al.(2015)发现高海拔地区中的土壤细菌群落的组成是微生物中最复杂和多样化的。我们的分析发现,茶园土壤细菌的菌群丰度随海拔的升高呈现单峰模式,而菌群多样性呈现双峰模式,真菌的菌群丰度和菌群多样性随海拔的升高都呈现双峰模式,这表明茶园土壤中细菌和真菌的多样性,群落组成与结构存在一定差别,并且呈现出不同的海拔分布规律。序列组成分析发现,前 10个细菌门的相对丰度与海拔的变化没有显著相关性,而前 10个真菌门的相对丰度随着海拔的升高呈现先升后降的模式,其中Acidobacteria和Proteobacteria呈现单调递增趋势,而Actinobacteria和Basidiomycota则相反,Arthrobacter在低海拔中的相对丰度相对于高海拔更高,但Penicillium的相对丰度在低海拔中占绝对优势,这与前人的研究相类似(Widden,2018;Kumar et al.,2019)。
茶园土壤微生物所生存的环境和地理因子是土壤微生物群落的组成与结构的重要驱动因素。先前的研究发现,茶园土壤pH作为主导因子与大多数分类群呈高度正相关或负相关,是影响茶园土壤细菌和真菌群落结构的关键因素,并且NO3-N,SOC和TOC也是影响细菌群落结构的主导因素,SOM和AP也是影响真菌群落结构的主导因素(Li et al.,2016;Arafat et al.,2019;Tan et al.,2019;顾松松等,2019;毛迎新等,2019)。Zhao et al.(2012)发现基于有限的数据,不能得出环境因子(pH)与茶园土壤细菌群落的关系,同时发现环境变量越相似,细菌群落结构越相似。我们的结果发现,不同环境因子和地理因子中的细菌和真菌群落具有类似的模式,前两个坐标轴在门分类水平对细菌和真菌与土壤环境因子和地理因子之间关系的解释率细菌较真菌低,但Mantel-test和Spearman相关性分析进一步揭示了纬度与海拔对细菌群落的组成与结构较真菌的更明显(无论是在门分类水平还是属分类水平上),虽然其与纬度和海拔都具有显著相关性,但相关性普遍较低。
4 结论
临沧市是世界茶树最重要的地理起源中心和栽培起源中心地带之一,本研究选择临沧市具有代表性的古茶园土壤微生物为研究对象,分析茶树生长的地理环境因素对茶园土壤细菌和真菌群落的组成结构及多样性的影响。细菌最适宜生活的 pH值范围为 4.5—6.0,而真菌为 4.0—5.5,因此,茶树生长最适宜的土壤 pH值为 4.5—5.5;真菌相对丰度受pH的影响较细菌更明显,但其多样性与pH的相关性较细菌更弱。不同地区茶园土壤细菌和真菌群落的组成与结构存在着一定差异和相似,经度、纬度与海拔是显著影响茶园土壤细菌群落的主要因素,同时海拔也是显著影响土壤真菌群落的主要因素。在门分类水平上,海拔的变化与细菌群落的相对丰度变化没有直接的关系,而真菌群落相对丰度随海拔升高先升后降,在属分类水平上相反,真菌群落相对丰度随海拔变化没有明显差异,而细菌群落相对丰度随海拔升高而递减。但总体而言,随着海拔的不断升高,细菌和真菌群落趋于复杂化和多样化,并且当海拔升高的一定高度时,其复杂化和多样化水平又开始下降。对分布于人类活动区与非活动区的茶园的土壤细菌和真菌群落的相对丰度及其多样性分析发现,细菌和真菌群落的相对丰度和多样性在人类活动区与非活动区间并没有显著区别。基于我们现有的数据,研究结果表明,茶园千百年来长期处于茶农的管理与选择下,其土壤微生物群落的组成与结构,以及其丰度与环境和地理因子间的相关性被人为“驯化”,在茶园系统中,主要发生人为活动对真菌群落做出的“选择”,而不是环境或地理因子的限制;而细菌群落更多是“选择”对所生活的环境的适应,而不是对人为活动的适应,生活环境对细菌群落的“压力”相对于人为活动更强烈。
