丙泊酚对老年痴呆大鼠AMPK自噬通路及认知功能的影响
2021-01-27郑仲磊张万平苏玉强范晓英
郑仲磊,张万平,苏玉强,薛 沙,范晓英
(西安医学院第二附属医院手麻科,陕西 西安 710038)
老年痴呆患者记忆力和认知能力的下降是由于突触功能丧失,炎症信号增强,氧化应激,大脑中的突触损伤,老年性斑块增加和神经原纤维缠结的逐步沉积以及神经元变性所致[1]。自噬是一种细胞内分解代谢机制,在病理条件下(如阿尔茨海默病)自噬对神经元具有保护作用。腺苷酸活化蛋白激酶(AMPK)是一种普遍存在的丝氨酸/苏氨酸蛋白激酶[2,3]。AMPK的表达和激活在阿尔茨海默氏病患者的大脑中也增加,抑制AMPK的激活可通过减少β淀粉样蛋白(Aβ)的产生和调节真核延伸因子2(eEF2)来改善海马突触可塑性的损害[4]。参与记忆功能的大脑区域主要依赖于含有N-甲基-D-天冬氨酸受体2B(NR2B)亚基。在产后发育过程中,NR2B表达稳定下降,NR2B的受体失活更慢,因此与突触可塑性水平升高有关。小鼠中NR2B表达的下调改善了突触可塑性和记忆形成,通过改变合成、转运或降解而导致NR2B水平降低,其突触可塑性和记忆力均得到改善[5]。丙泊酚是最常用的静脉麻醉药,已显示出减弱含半胱氨酸的天冬氨酸蛋白水解酶(caspase)激活和凋亡而具有神经保护作用[6]。本研究拟探讨丙泊酚对老年痴呆大鼠AMPK自噬通路及认知功能的影响。
1 材料与方法
1.1实验动物及分组:清洁级SD(Sprague Dawley)大鼠100只,购自昆明医科大学实验动物中心,雌雄各半,96周龄,体重(520±40)g,动物生产许可证号:SCXK(云)2019-0006,动物使用许可证号:SYXK(云)2019-0008,动物质量合格证号:0019695849。饲养环境:温度(21±1)℃,湿度(55±5)%。大鼠随机分成5组:对照组、模型组、盐酸米诺环素组(50mg/kg)、丙泊酚低剂量组(50mg/kg)、丙泊酚高剂量组(100mg/kg),每组20只。
1.2主要药品、试剂与仪器:丙泊酚(原料药,南京科维思生物科技股份有限公司,纯度99.98%,批号HJ-1587);盐酸米诺环素胶囊(惠氏制药有限公司,规格100mg/粒,批号190513);β样淀粉蛋白1-42(β-amyloid protein1-42,Aβ1-42)(美国sigma公司,批号L2873);吖啶橙染料、化学发光(ECL)Western印迹检测试剂盒(碧云天生物技术研究所,批号D01339、P0018FM);聚偏二氟乙烯(PVDF)膜、PureLink Micro-toMidi总RNA分离试剂盒(美国Invitrogen公司,批号FFP36、RRK-10328);RIPA裂解液、TaqMan逆转录试剂盒(哈尔滨海基生物科技深圳有限公司,批号KL6379、106734);Bradford蛋白质检测试剂盒(南京建城生物工程研究所,批号GL1493);聚丙烯酰胺凝胶电泳(SDS-PAGE)(美国赛默飞世尔科技公司,批号SJ-394764);AMPK一抗、NR2B一抗、GAPDH抗体、HRP偶联二抗(美国Santa Cruz Biotechnology公司,批号ac41789、ac52987、ad33117、ak636548);PBS-Tween20洗液(上海泽叶生物科技有限公司,批号BD-8599);DM500型荧光显微镜(德国徕卡公司);3900型RNA TaqMan microRNA分析仪(美国Applied Biosystems公司);qTOWER型实时荧光定量PCR仪(德国耶拿分析仪器股份公司);Epson Perfection 2480型扫描仪(日本长野精工公司)。
1.3动物建模及给药:将Aβ1-42溶解在无菌蒸馏水中,浓度为5μg/L,并在37℃下孵育7d,以获得聚集形式。模型组、盐酸米诺环素组、丙泊酚低剂量组、丙泊酚高剂量组大鼠腹膜内注射戊巴比妥钠(50mg/kg)麻醉,将Aβ1-42(1μL=5μg)微量注射到双侧海马中。所有微注射均使用10μLHamilton注射器进行,将其用26号不锈钢针头缓慢放下。开始注射前,将针头留在原位3~5min,然后以0.1μL/min的速度缓慢注射,在缓慢拔出针头之前,将其再留置3~5min[7]。对照组进行相同的操作过程,以相同的立体定位法以0.1μL/min的速率将相同体积的载体溶液(1μLPBS)单次微量注射到海马的相应区域中。注射后,将头皮缝合,使大鼠从麻醉中恢复。模型建立成功后,盐酸米诺环素组、丙泊酚低、高剂量组以10mL/kg的灌胃体积给予相应药物灌胃,对照组、模型组灌胃10mL/kg的生理盐水。每天给药1次,持续4周。
1.4大鼠神经认知功能检测:Morris水迷宫试验测定逃避潜伏期时间、经过原平台位置的次数、原平台象限停留的时间[8]。
1.5大鼠海马神经元病理结构观察:颈椎脱臼处死大鼠,取大鼠海马组织,常规脱水、包埋,制作切片,苏木精-伊红(HE)染色,显微镜观察神经元病理结构变化。
1.6大鼠海马神经元自噬检测:吖啶橙(10mg/L)37℃染色海马组织,持续30min,于荧光显微镜下观察神经元自噬水平(细胞质内若出现酸性红色自噬小体说明发生自噬;随机计数200个细胞中自噬小体个数)。
1.7大鼠海马组织AMPK、NR2B mRNA表达水平的测定:使用PureLink Micro-toMidi总RNA分离试剂盒提取大鼠海马组织总RNA,使用TaqMan逆转录试剂盒在RNA TaqMan microRNA分析仪将(20 ng)RNA逆转录为cDNA,逆转录程序为16℃退火30min,然后在42℃延伸30min。采用实时荧光定量PCR法检测AMPK、NR2B的表达,引物由苏州泓迅生物科技股份有限公司合成。引物序列如下:AMPK正向引物:5'-CCTAAGGATCCAGGGAATCCCAT-3',反向引物:5'-CGGTATACGACCAAATCCGCCGA-3';NR2B正向引物:5'-CCGACGCCAATCTTGTCTCCTGGA-3',反向引物:5'-CGGATCCTGTTCGACAGTCACAAC-3';U6正向引物:5'-TGGAGTCCCTTGTGGTTCTGGAGTC-3',反向引物:5'-CGTGGGACTGACTGTTCGACCTGGA-3'。使用实时荧光定量PCR仪在一式三份的孔中进行循环PCR。程序为:95℃下变性15s,60℃下退火和延伸1min。使用SDS软件确定循环阈值(Ct)荧光值。采用2-△△Ct法计算AMPK、NR2B mRNA的相对表达量。以U6作为内参基因。
1.8大鼠海马组织AMPK、NR2B蛋白表达水平的测定:将海马组织样本在RIPA裂解液中进行裂解,然后在4℃下以12000×g离心20min。使用Bradford蛋白质检测试剂盒来计算蛋白质浓度。样品(每泳道60μg)通过8%SDS-PAGE分离并电转移到PVDF膜上。在室温下,用5%脱脂牛奶将膜封闭2h,并在4℃加入AMPK一抗(1∶500稀释)、NR2B一抗(1∶500稀释)、GAPDH抗体(1∶1000稀释)。GAPDH被用作对照。将膜在PBS-Tween20洗液中洗涤10min,将其与HRP偶联二抗(1∶4000稀释)孵育2h。通过增强的化学发光(ECL)Western印迹检测试剂盒将印迹的蛋白条带可视化,并用X射线胶片曝光。使用Epson Perfection 2480型扫描仪将冲洗过的胶片数字化,使用Glyko Bandscan软件获得光密度。所有实验重复3次。

2 结 果
2.1各组大鼠Morris水迷宫试验结果比较:模型组逃避潜伏期时间较对照组明显升高,经过原平台位置的次数、原平台象限停留的时间较对照组明显降低(P<0.05);盐酸米诺环素组和丙泊酚低、高剂量组逃避潜伏期时间较模型组明显降低,经过原平台位置的次数、原平台象限停留的时间较模型组明显升高(P<0.05);丙泊酚低剂量组逃避潜伏期时间较盐酸米诺环素组明显升高,经过原平台位置的次数、原平台象限停留的时间较盐酸米诺环素组明显降低(P<0.05);丙泊酚高剂量组与盐酸米诺环素组相比无明显改变(P>0.05)。见表1。

表1 各组大鼠Morris水迷宫试验结果比较

表2 各组大鼠海马组织神经元自噬小体水平比较
2.2各组大鼠海马组织神经元自噬小体水平比较:模型组神经元自噬小体水平较对照组明显降低(P<0.05);盐酸米诺环素组和丙泊酚低、高剂量组神经元自噬小体水平较模型组明显升高(P<0.05);丙泊酚低剂量组神经元自噬小体水平较盐酸米诺环素组明显降低(P<0.05);丙泊酚高剂量组与盐酸米诺环素组相比无明显改变(P>0.05)。见表2。
2.3各组大鼠海马神经元病理结构比较:对照组海马区神经元细胞较多,排列整齐;模型组海马区见片状神经元坏死,数目减少,核固缩明显;丙泊酚低剂量组坏死神经元细胞减少;盐酸米诺环素组、丙泊酚高剂量组海马区见少量坏死神经元细胞,神经元细胞结构完整。见图1。
2.4各组大鼠海马组织AMPK、NR2B mRNA和蛋白表达水平比较:模型组AMPK、NR2B mRNA和蛋白表达水平较对照组明显升高(P<0.05);盐酸米诺环素组和丙泊酚低、高剂量组AMPK、NR2B mRNA和蛋白表达水平较模型组明显降低(P<0.05);丙泊酚低剂量组AMPK、NR2B mRNA和蛋白表达水平较盐酸米诺环素组明显升高(P<0.05);丙泊酚高剂量组与盐酸米诺环素组相比无明显改变(P>0.05)。见表3、图2。

表3 各组大鼠海马组织AMPK NR2B mRNA和蛋白表达水平比较
.
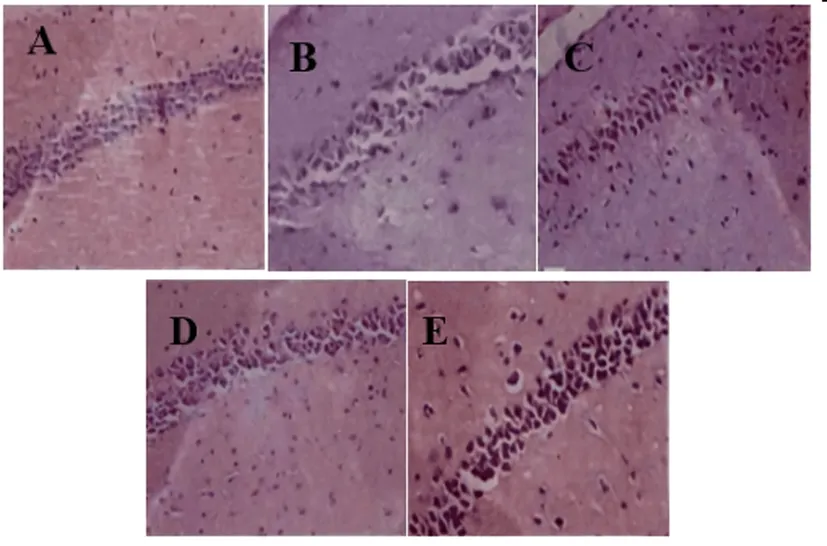
图1 各组大鼠海马神经元病理结构图(HE染色,400倍)
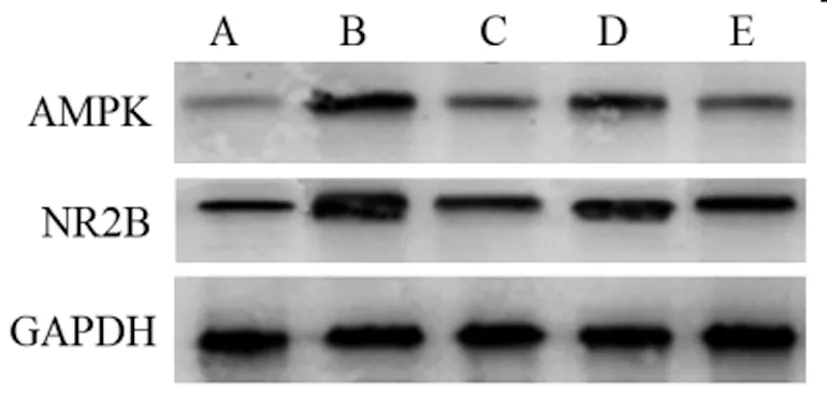
图2 各组大鼠海马组织AMPK、NR2B蛋白表达印迹图
3 讨 论
老年痴呆主要病理变化是神经原纤维缠结,老年斑沉积和神经元细胞死亡。Aβ已被证明是老年斑中的关键成分,而tau蛋白的过度磷酸化可促进神经原纤维缠结[9]。有研究表明自噬对老年痴呆具有有益作用[10]。Aβ1-42或β样淀粉蛋白1-40(Aβ1-40)及其前体淀粉样前体蛋白(APP)和β切割的APP的羧基末端结构域富含自噬空泡(AVs)在自噬中异常积累。AVs积累和溶酶体蛋白水解缺陷的自噬-溶酶体途径功能失调发生在老年痴呆脑神经中。AV的大量积累是老年痴呆症中Aβ产生的原因,因此,自噬缺陷有助于异常的老年痴呆进程。本次研究发现,模型组逃避潜伏期时间高于对照组,经过原平台位置次数、原平台象限留时间、神经元自噬小体水平低于对照组;盐酸米诺环素组和丙泊酚剂量组逃避潜伏期时间明显低于模型组,经过原平台位置的次数、原平台象限停留的时间、神经元自噬小体水平高于模型组,且随着丙泊酚给药剂量的增加,呈剂量依赖性。这说明丙泊酚能降低老年痴呆大鼠神经认知功能损害,增加海马神经元自噬水平。大鼠海马神经元结构病理学结果显示,对照组海马区神经元细胞结构正常;模型组海马区见片状神经元坏死,数目减少,核固缩明显;丙泊酚低剂量组坏死神经元细胞减少;盐酸米诺环素组、丙泊酚高剂量组海马区见少量坏死神经元细胞,神经元细胞结构完整。这提示丙泊酚能明显减轻老年痴呆大鼠海马神经元损伤程度。
AMPK通路的激活在自噬中具有重要作用。AMPK是一种能量传感器,可以调节急性和慢性脑损伤中的炎症反应,氧化应激和突触可塑性。活化的AMPK通过下调磷脂酰肌醇3-激酶/p38丝裂原活化蛋白激酶(PI3K/p38)、丝裂原活化蛋白激酶(MAPK)、核因子kappa B(NF-kB)和Nod -类受体蛋白3(NLRP3)的产生[11]。手术后老年大鼠海马中的AMPK激活增强,而成年幼鼠海马中的AMPK激活增强,这与认知障碍发生的年龄依赖性有关[12]。此外,抑制AMPK激活不仅显著改善了老年大鼠的认知障碍,而且还限制了小胶质细胞的激活,NR2B表达的下调以及手术后老年大鼠海马中Tau和Tau磷酸化表达的上调[13]。这些数据表明AMPK可能是上游信号分子,启动了认知障碍的病理过程。本研究结果显示:模型组AMPK、NR2B mRNA和蛋白表达水平明显高于对照组;盐酸米诺环素组和丙泊酚低、高剂量组AMPK、NR2B mRNA和蛋白表达水平明显低于模型组,且随着丙泊酚给药剂量的增加,AMPK、NR2B mRNA和蛋白表达水平逐渐降低,呈剂量依赖性。这提示丙泊酚抑制AMPK信号通路诱导的大鼠神经元自噬来削弱老年痴呆大鼠神经损伤。
综上所述,丙泊酚能增加老年痴呆大鼠神经元自噬水平进而明显减轻海马神经元损伤程度,其机制与丙泊酚抑制AMPK信号通路诱导的大鼠神经元自噬来削弱老年痴呆大鼠神经损伤有关。
