基于小鼠肝炎病毒研究遗传工程小鼠隔离检疫设计*
2021-01-22杨伟伟俞利平汪海燕孙筱品戴方伟宋晓明
桂 飞 杨伟伟 俞利平 周 祥 汪海燕 孙筱品 戴方伟 宋晓明
(1. 杭州师范大学实验动物中心, 杭州 310036)(2. 浙江省医学科学院实验动物中心, 杭州 310013)
随着基因编辑技术的不断进步,遗传工程小鼠逐渐成为生命科学研究中应用最为广泛的实验动物,各大高校、科研机构每年需引进、制备大量品系的遗传工程小鼠,其中很大比例来自科研院所的交流或从海外进口。这有效促进了生命科学相关领域的快速发展,同时引入一系列关于实验动物病原微生物和寄生虫质量控制的难题。一旦隔离检疫环节出现疏漏,往往导致大规模、持续性病原感染,不仅严重影响科研成果准确性,更威胁到从业人员健康和生命安全。检测机构在接收委托检测时发现,很多机构采用遗传工程小鼠背景鼠—C57BL/6小鼠作为哨兵鼠进行隔离检疫和常规病原监测。我国对入境活体动物的隔离检疫,综合《进境动物检疫疫病名录》相关鼠病和国标《实验动物 微生物学等级及监测》[1]要求,将SPF鼠隔离期由30 d调整为14 d[2],在1~2周内需实现病原检测是否可行以及如何实现是实验动物管理人员都需面对的现实问题。
小鼠肝炎病毒(murine hepatitis virus, MHV)属于冠状病毒科、冠状病毒属,基因组为线性不分段的单股正链RNA[3]。 MHV感染是一种严重危害小鼠生产的病毒性传染病,正常情况下呈隐性感染,应激激发时会诱发致死性病变,是一种广泛传播且顽固的病原,难于被发现和有效控制,MHV已是遗传工程小鼠微生物控制中最难于生物净化的病原之一[4]。目前,针对MHV的诊断方法有病毒分离与鉴定、血清学试验、组织病理学诊断和分子生物学诊断等。本文以MHV为例,研究两种品系小鼠作为哨兵鼠在MHV感染后,病毒核酸检测量和血清抗体变化规律,以期为遗传工程小鼠隔离检疫以及常规病原检测提供参考。
1 材料与方法
1.1 材料
1.1.1实验动物:6~8周龄C57BL/6小鼠和BALB/c小鼠各10只,雌雄各半,由杭州师范大学实验动物中心提供,生产许可证:SCXK(浙)2016-0004,小鼠饲养在屏障系统隔离器中,使用许可证:SYXK(浙)2016-0006,动物自由采食和饮水。待动物充分适应环境后,在符合动物福利的条件下进行实验。
1.1.2试剂:DNA/RNA Isolation Kit(TIANGEN DP422)核酸提取试剂盒以及Fast Quant RT Kit(With gDNase)(TIANGEN KR106)反转录试剂盒购自天根生化科技有限公司;小鼠肝炎病毒实时荧光定量PCR检测试剂盒TaqMan© Gene Expression Master Mix(ABI 4369016)购自ABI公司;小鼠肝炎病毒ELISA检测试剂盒购自Xpress Bio公司。
1.1.3主要仪器与设备:微量紫外分光光度计(Thermo Nanodrop 2000)、 普通PCR扩增仪(Bio-RAD)、实时荧光PCR仪(ABI One step plus)、生物安全柜(Thermo)、酶标仪(Molecular Devices)、 DEM-3型自动洗板机(北京拓普分析仪器有限责任公司)。
1.2 方法
1.2.1引物与探针的设计:从NCBI的FTP中下载两株MHV基因组序列,经分析比对、Primer Premier 5.0 软件设计荧光定量PCR引物和探针以及实验筛选和验证,选取29843-31210 Murine hepatitis virus strain JHM为靶基因。引物、探针(见表1)由上海捷瑞生物工程有限公司合成。

表1 MHV TaqMan荧光定量PCR引物及探针序列
1.2.2样品的收集及前处理:C57BL/6小鼠和BALB/c小鼠作为哨兵鼠,参照常规的遗传工程小鼠隔离检疫方式进行如下设计:小鼠雌雄各半,分4笼放入同一个隔离包中,使用经MHV核酸检测阳性的小鼠脏垫料为感染源,均分后感染待检哨兵鼠。哨兵鼠每周更换2次脏垫料,使其自然感染。接触饲养28天后停止接触脏垫料,每只小鼠进行单笼饲养并取样直至实验结束。在第7、14、21、28、42、56天分别将每只实验小鼠取出至经高压灭菌的笼盒中,待其自然排便后采集小鼠的新鲜粪便,同时采集血样。取50 mg粪便用液氮研磨法[5],加入600 μL裂解液,充分混匀后,按试剂盒操作步骤提取。血液经3 000 r/min、5 min离心后,取血清放置于-20 ℃备用,待所有血清收集完成后,使用ELISA检测试剂盒检测血清MHV特异性抗体。
1.2.3核酸提取:将采集的粪便样本,按照TIANGEN DP422核酸提取试剂盒说明书,手动提取病毒RNA,并进行核酸浓度测定,常规方法反转录成cDNA,-20 ℃保存备用。
1.2.4实时荧光定量TaqMan-PCR检测及判定标准:用TaqMan试剂盒对提取的病毒RNA进行检测,反应体系如下: 2×TaqMan Fast Advanced Master Mix 12.5 μL,上下游引物(10 μmol/L) 各 0.5 μL,探针(5 μmol /L) 1.0 μL,模板cDNA 2.0 μL,补水至 25 μL。扩增程序为: 50 ℃孵育2 min,95 ℃预变性10 min; 95 ℃变性 15 s,60 ℃退火延伸 1 min,共 40 个循环,收集荧光信号并读取数据。
参考《中国实验动物学会团体标准汇编及实施指南》[6],若待检测样品无荧光扩增曲线,则判定样品未检出小鼠肝炎病毒。若待检测样品有荧光扩增曲线,且Ct值应≤35时,则判断样品中检出小鼠肝炎病毒。若待检测样品Ct值介于35和40之间时,应重新进行实时荧光RT-PCR检测。重新检测后,若Ct值≥40时,则判定样品未检出小鼠肝炎病毒。重新检测后的Ct值仍介于35和40之间,则判定样品检出小鼠肝炎病毒。
1.2.5血清抗体检测及判定标准:应用XpressBio公司小鼠肝炎病毒ELISA检测试剂盒,按照说明书步骤进行检测。在405 nm波长处,待检测样本光吸收值与相应阴性对照孔的光吸收值的差值≥0.3时,则判定该待测样本中检出小鼠肝炎病毒。
1.2.6统计学分析:数据运用SPSS statistics 22软件处理,采用Cohen’s kappa系数[7]分析两种检测方法对样本阳性判断的一致性,P< 0.05为差异显著;P< 0.01为差异极显著。
2 结果
2.1 C57BL/6小鼠粪便中肝炎病毒检测量与血清抗体的变化结果
C57BL/6小鼠qPCR检测结果(表2)表明,在接触含小鼠肝炎病毒脏垫料的第7天、第14天和第21天均未从单独采集的粪便中检出病毒核酸,在第28天、第42天各有两只C57BL/6小鼠粪便中检出病毒核酸阳性,阳性率仅为20%,2个阳性样本的平均Ct值分别为(37.31±1.35)和(36.36±3.06)。第56天所有粪样均为阴性,未检出病毒核酸。由血清MHV特异性抗体结果(表2)可知,在整个脏垫料接触期(第1天至第28天)以及之后四周的单独饲养期均未从本项目设计的C57BL/6哨兵鼠血清中检出MHV特异性抗体。
由表2可知,当采用 C57BL/6小鼠作为隔离检疫的哨兵鼠使用时,qPCR法在第28天小鼠粪样中检出MHV阳性,检出率仅为20%,第42天阳性数量未增加,到第56天时粪便病毒载量已经低于qPCR检测限。采用ELISA法检测血清MHV特异性抗体的结果则表明,本研究所设计的整个隔离检疫策略无法检出阳性样本。

表2 C57BL/6小鼠粪便中肝炎病毒的检测量与血清中抗体的变化结果
2.2 BALB/c小鼠粪便中肝炎病毒的检测量与血清抗体的变化结果
qPCR检测结果(表3)发现,在BALB/c小鼠与脏垫料接触期的第21天,从单独采集的粪便中可检测出少量的MHV核酸,qPCR方法的检出率为20%,平均Ct值为(38.70±0.99)。在第28天,从10只BALB/c小鼠中检出7只小鼠的MHV核酸阳性,阳性率为80%,阳性样本的平均Ct值为(27.31±6.85),经脱离脏垫料环境饲养两周后,第42天也有5只BALB/c小鼠检出MHV核酸阳性,在第56天qPCR未能检出阳性。
ELISA检测结果(表3)显示,在接触感染期(第1天至第28天周)血清抗体检测结果均为阴性,在第42天和第56天,待检的10只哨兵鼠中有5只BALB/c小鼠血清特异性抗体检测呈阳性,且第56天抗体OD值与第42天相比有显著提高。
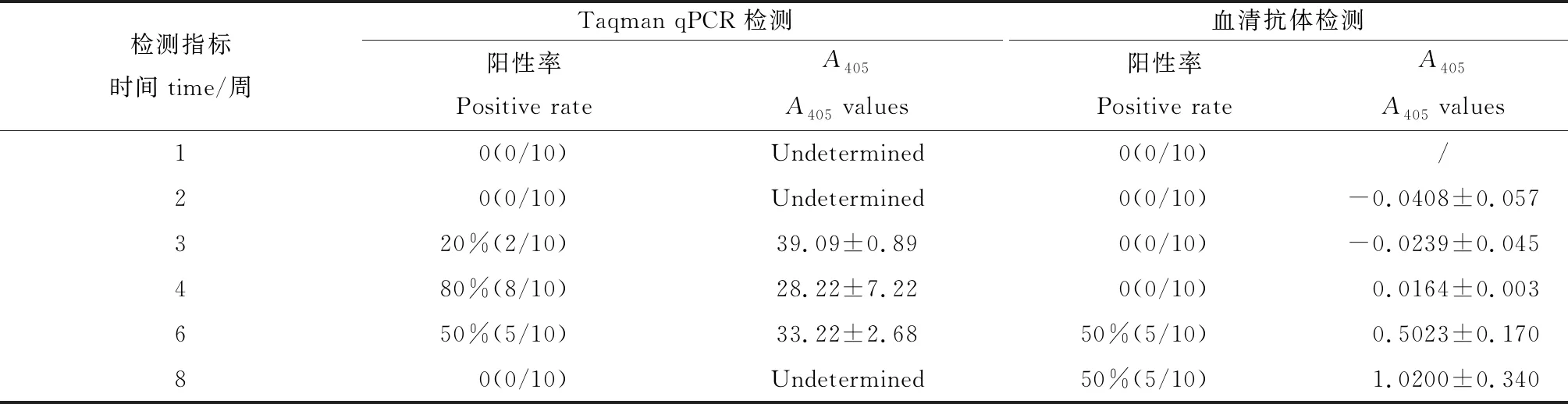
表3 BALB/c小鼠粪便中肝炎病毒的检测量与血清抗体的变化结果
配对卡方检验发现,感染前28 d,仅qPCR方法可检测出阳性;第42天两种方法均可检出阳性,且两种检测方法的Cohen’s kappa系数为1,P<0.01,具有很强的一致性。而第56天仅ELISA方法检测出阳性。由表3可知,在模拟常规隔离检疫的脏垫料接触感染21 d后,有20% BALB/c小鼠粪样qPCR检测为阳性,第28天有80%BALB/c小鼠粪样检出阳性,第42天仍有50%阳性率。采用ELISA法检测特异性抗体时,第21天、第28天均无阳性血样检出,仅在第42天时开始检测到抗体阳性,表明qPCR检测粪样病毒核酸较ELISA法测血清抗体具有早检出且检出率更高的特点,更能达到隔离检疫的目标。
2.3 C57BL/6和BALB/c小鼠粪便中MHV核酸检测量与血清抗体变化的比较
将C57BL/6和BALB/c两品系小鼠粪便中MHV qPCR核酸检测量进行对比(图1)后发现,BALB/c小鼠在感染第21天,从粪便中即可检测出少量MHV核酸阳性,随后病毒含量呈上升趋势;C57BL/6小鼠在感染后第28天才能检出,从Ct值判断其病毒含量一直处于较低水平。两品系小鼠的血清抗体检测结果对比显示,C57BL/6小鼠直至第56天,均未检测出抗体阳性,BALB/c小鼠随着肝炎病毒检测量的增加,从第42天开始血清抗体水平持续增加。当血清抗体增加到一定程度后,病毒检测量出现了下降(见图1)。因此,本研究结果表明,针对小鼠肝炎病毒BALB/c小鼠较C57BL/6更易感,且更易引起机体的免疫应答反应。
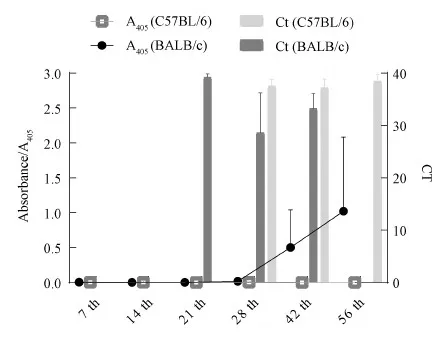
图1 C57BL/6和BALB/c小鼠粪便中肝炎病毒检测量与血清抗体的变化结果
3 讨论
从实验结果看,BALB/c小鼠在当前的感染条件下,MHV感染后粪便中病毒载量的变化呈先升后降的趋势,第21天开始检出少量,第28天检测含量最高,随后下降,第56天未能检出,这表明小鼠在感染前期,因体内未产生抗体,病毒处于复制期,当病毒复制到一定量后刺激机体发生免疫反应,产生抗体,从而使感染后期病毒载量出现下降趋势;感染后期才出现小鼠肝炎病毒抗体,与Scavizzi和Raspa等[8]实验结果基本一致。且粪便中病毒载量与血清抗体的变化呈负相关关系。本研究中采用自然感染的方式,所用的感染源MHV含量较低,就病毒检出时间和检出率来看,自然感染小鼠排毒时间较人工感染小鼠肝炎病毒排毒明显滞后[9],可能毒株的类型和其毒力的强弱有关,也可能与感染途径或方式有关。
通过比较不同品系小鼠发现,C57BL/6小鼠对MHV不太敏感,在整感染过程中,从粪便中仅检测出极少量病毒,且未能刺激机体产生抗体。BALB/c小鼠对MHV较易感,诱导产生较强烈的免疫反应,产生抗体。Shigeru Kyuwa等[10]也发现在BALB/c小鼠的原代肝细胞增殖的MHV滴度比C57BL/6小鼠的原代肝细胞增殖的要高,提示BALB/c小鼠较C57BL/6小鼠对小鼠肝炎病毒更易感,可为哨兵鼠的选择提供参考依据。
在隔离检疫的过程中,通过小鼠粪便,可以较早检测小鼠肝炎病毒的感染情况,提早确定病原微生物的感染状况;感染后期,血清抗体相对稳定,与刘香梅等[11]报道结果相一致。研究提示可结合粪便中病原微生物检测和血清抗体含量的检测方法,综合评价实验动物病原微生物的感染状况,从而有效控制病原微生物的感染。
针对本研究选用的小鼠肝炎病毒,无论是用qPCR法还是ELISA法,BALB/c作为哨兵鼠比C57BL/6小鼠有更高的检出率,鉴于MHV是遗传工程小鼠最主要的感染病原之一,我们建议在隔离检疫和常规病原检测中,选用BALB/c替代C57BL/6作哨兵鼠。同时在大鼠或小鼠进行隔离检疫时,粪便和其他排泄物均用PCR法来监测传染性病原体。
