中风1号方对急性脑出血大鼠的保护作用及机制研究*
2021-01-21邢锡熙吴绍钦沈存思李建香王益俊严晶
邢锡熙,吴绍钦,沈存思,李建香,王益俊,严晶
1.南京市江宁区中医医院,江苏南京211100;2.南京中医药大学第一临床医学院中医儿科学研究所/江苏省儿童呼吸疾病(中医药)重点实验室,江苏南京210023;3.南京中医药大学附属南京中医院,江苏南京210001;4.南京中医药大学第一临床医学院代谢病中医研究重点实验室,江苏南京210023
急性脑出血(acute intracerebral hemorrhage,AICH)约占急性脑血管病的10% ~20%,其发病率、复发率、病死率和致残率高,给社会和家庭带来沉重的负担[1]。除了急性期颅内血肿对脑组织造成压迫,产生占位效应及其分解产物造成脑组织损伤外,继发性的脑水肿和炎症反应等亦会加重脑损伤[2]。西医内科多采用脱水、利尿、降颅压等方法,外科多以清除血肿、去骨瓣降颅压等治法为主,但会遗留除疾病本身以外手术创伤带来的合并症[3]。虽然目前已有一些针对炎症因子的药物,如肿瘤坏死因子α(tumor necrosis factor,TNF-α)抑制剂等,但仍处于试验阶段[4]。中医以辨证论治为基础,复方见长。诸多研究发现,联合中药治疗可显著提高临床疗效[5]。课题组所拟中风1号方具有凉血活血、通腑泄热、开窍通络、上下并治之功,联合应用后临床疗效显著。本文主要观察其对神经损伤、脑水肿、血脑屏障、炎症因子的影响,初步揭示其神经保护作用机制。
1 材料
1.1 动物SD雄性大鼠144只,清洁级,体质量200~250 g,南京市江宁区青龙山动物繁殖场提供[动物合格证号:SCXK(苏)2017-0001],饲养于南京中医药大学动物实验中心。室温23~25℃、相对湿度65% ~70%,饲养环境清洁、安静。大鼠自由饮水、饮食,适应性饲养1周后再进行实验。
1.2 药物及试剂中风1号方由生大黄10 g,生地黄10 g,牡丹皮12 g,三七3 g,全瓜蒌15 g,石菖蒲10 g组成。购于南京市江宁区中医医院中药房,按传统方法煎煮熬制,浓缩至含0.54 g·mL-1生药的药液,调整pH至7.0,无菌操作过滤除菌后,4℃冰箱保存备用。伊文思蓝(Evans Blue,EB)(Solarbio,货号:E8010);大鼠TNF-αELISA试剂盒(福麦斯生物,货号:ELR010);大鼠IL-1βELISA试剂盒(福麦斯生物,货号:ELR002)。
1.3 仪器脑立体定位仪(北京智鼠多宝,型号:DB053);微量进样器(上海高鸽,50μL);酶标仪(优利特,型号:URIT-660);电子天平[赛多利斯科学仪器(北京)有限公司];电热鼓风干燥箱(天津市泰斯特仪器有限公司,型号:WGL-125B)。
2 方法
2.1 AICH模型的建立采用自体尾部血液注入法造模。0.4%的戊巴比妥钠(1 mL·100 g-1)腹腔注射麻醉后断尾取血,用微量进样器(预先用1‰肝素钠冲洗)抽取自体不凝血50μL备用。将大鼠以俯卧位用立体定位仪固定在操作台上,使前后囟处于同一平面,门齿沟的水平与耳间线比较低2.4 mm。沿头皮正中纵行切开约10 mm,暴露颅骨,依据《脑立体定位图谱》定位尾壳核。将微量进样器固定在立体定位仪上,将微量进样器尖端垂直于矢状缝右侧旁开3.0 mm,前囟前0.2 mm处,用三棱针在正对针尖下方钻一直径约1.0 mm的小孔,深度达硬脑膜表面,调整上下坐标尺,以颅骨外板为零点,使微量进样器进针深度为6.0 mm。按照5μL·min-1的速度,缓慢匀速地将大鼠自体血加50μL注入至尾壳核内,注血完成留针约15 min后再缓慢地退针,用骨蜡对钻孔进行封闭后缝合手术切口,进行常规消毒后将大鼠侧卧位放置于单独的鼠笼。假手术组只行进针,不注入自体血,手术操作同其余各组。以上操作均遵守无菌原则。
2.2 分组及给药将造模成功的大鼠随机分成3组,每组各36只,即模型+生理盐水组、模型+中风1号方低剂量组、模型+中风1号方高剂量组,假手术组共36只。并按照指标检测的时间不同分为24 h、72 h两个亚组,每亚组随机分配18只大鼠,用于检测不同指标。给药剂量根据体表面积折算,低剂量相当于成人每日等效剂量(75 g·0.018·0.2 kg-1=6.75 g·kg-1),低、高剂量比为1∶2。假手术组、模型组(24 h、72 h)均予以等量生理盐水,灌胃容积均为10 mL·kg-1,低剂量组每日1次,高剂量组每日2次。各组的灌胃疗程均以各亚组的时间(24 h、72 h)为准。
2.3 检测指标
2.3.1 神经行为学评分造模结束及各时间点给药结束后,均参照Longa 5级评分法评估神经功能损伤程度[6]。评分标准为:0分,无神经功能缺损症状;1分,提尾倒挂时血肿对侧前肢紧贴胸壁不能伸展;2分,行走时向血肿对侧转圈;3分,行走或站立时向血肿对侧倾倒;4分,意识障碍,不能行走。评分为1~3分认为造模成功,0分则认为造模失败,4分和死亡大鼠均被剔除实验并根据分组进行相应补充。
2.3.2 脑水肿检测采用干湿重法检测脑含水量。分别于24 h、72 h,每组随机选择6只大鼠予0.4%戊巴比妥钠(1 mL·100 g-1)腹腔注射麻醉后断头,用钳剥开硬脑膜,取出整个大脑滤干。沿中线将脑组织切成两半,再沿穿刺针眼纵切一刀见到水肿,取血肿周围脑组织约150 mg(湿重),置于100~110℃的干燥箱中,24 h后体质量恒定称重(干重)。
脑组织含水量(%)=(湿重-干重)/湿重×100%
2.3.3 血脑屏障通透性检测每组随机选择6只大鼠按上法麻醉后,由尾静脉注入4 mL·kg-1的2%EB溶液,当大鼠眼球结膜、四肢变蓝时,说明EB注入成功。2 h后,开胸通过左心室灌注生理盐水,直到右心房流出无色液体为止。大鼠断头取脑之后,取血肿周围组织,称重后加入3 mL的甲酰胺,置于54℃的恒温水浴箱中孵育24 h。对溶有EB的甲酰胺溶液进行过滤,用分光光度计(λ=632 nm)测其吸光度值。根据EB标准曲线计算脑组织EB的含量。
2.3.4 ELISA法检测TNF-α、IL-1β水平每组剩余的6只按上述方法麻醉后,用钳剥开硬脑膜,取出待测出血周围脑组织,检测TNF-α、IL-1β水平。在酶标仪上测450 nm波长处吸光度(OD值),计算样本浓度。
2.4 统计学方法采用SPSS 20.0统计软件,原始数据用±s表示,符合正态分布采用One-Way ANOVA检验,不符合正态分布用Wilcoxon秩和检验。以P<0.05作为有统计学意义。
3 结果
3.1 中风1号方对AICH模型大鼠神经功能的影响与假手术组相比,模型组大鼠24 h、72 h神经行为学评分均显著增加(P<0.01)。与模型组相比,中风1号方低、高剂量组大鼠24 h神经行为学评分有降低的趋势(P>0.05);中风1号方低、高剂量组大鼠72 h神经行为学评分降低(P<0.05,P<0.01)。见表1。
表1 中风1号方对各时间段AICH模型大鼠神经行为学评分的影响(分,±s)

表1 中风1号方对各时间段AICH模型大鼠神经行为学评分的影响(分,±s)
注:与同时段假手术组比较,#P<0.05,##P<0.01;与同时段模型组比较,△P<0.05,△△P<0.01
24 h 72 h假手术组组别0.00±0.00 0.00±0.00模型组2.50±0.55##1.83±0.41##中风1号方低剂量组2.33±0.52 1.16±0.41△中风1号方高剂量组2.17±0.41 1.00±0.63△△
3.2 中风1号方对AICH模型脑组织含水量的影响与假手术组相比,模型组大鼠24 h、72 h脑组织含水量均增加(P<0.05,P<0.01)。与模型组相比,中风1号方低、高剂量组大鼠24 h脑组织含水量有降低的趋势(P>0.05);中风1号方低、高剂量组大鼠72 h脑组织含水量降低(P<0.05,P<0.01)。见表2。
表2 中风1号方对各时间段AICH模型大鼠脑组织含水量的影响(%,±s)
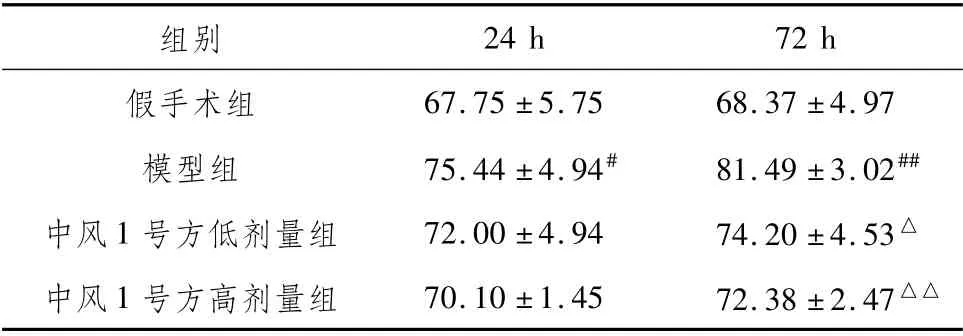
表2 中风1号方对各时间段AICH模型大鼠脑组织含水量的影响(%,±s)
注:与同时段假手术组比较,#P<0.05,##P<0.01;与同时段模型组比较,△P<0.05,△△P<0.01
24 h 72 h假手术组组别67.75±5.75 68.37±4.97模型组75.44±4.94#81.49±3.02##中风1号方低剂量组72.00±4.94 74.20±4.53△中风1号方高剂量组70.10±1.45 72.38±2.47△△
3.3 中风1号方对AICH模型血脑屏障的影响
与假手术组相比,模型组大鼠24 h、72 h脑组织EB水平均增加(P<0.05,P<0.01)。与模型组相比,中风1号方高剂量组大鼠24 h脑组织EB水平显著降低(P<0.01);中风1号方低、高剂量组大鼠72 h脑组织EB水平均显著降低(P<0.01)。见表3。
表3 中风1号方对各时间段AICH模型大鼠脑组织EB水平的影响(μg·g-1,±s)
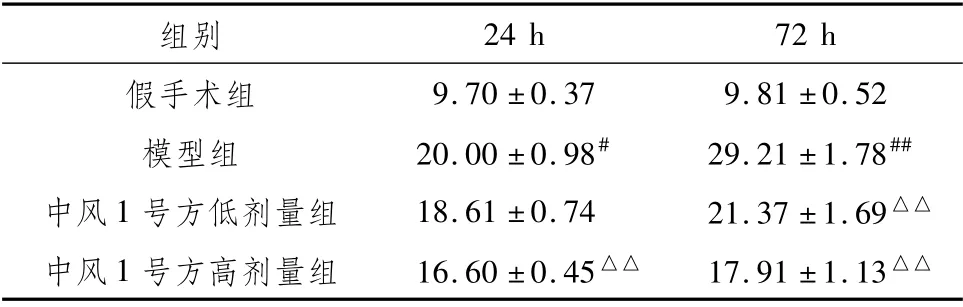
表3 中风1号方对各时间段AICH模型大鼠脑组织EB水平的影响(μg·g-1,±s)
注:与同时段假手术组比较,#P<0.05,##P<0.01;与同时段模型组比较,△△P<0.01
24 h 72 h假手术组组别9.70±0.37 9.81±0.52模型组20.00±0.98#29.21±1.78##中风1号方低剂量组18.61±0.74 21.37±1.69△△中风1号方高剂量组16.60±0.45△△17.91±1.13△△
3.4 中风1号方对AICH模型大鼠脑血肿旁组织炎症因子的影响与假手术组相比,模型组大鼠24 h、72 h脑血肿旁组织TNF-α、IL-1β水平均显著增加(P<0.01)。与模型组相比,中风1号方高剂量组大鼠24 h脑血肿旁组织TNF-α、IL-1β水平显著降低(P<0.01);中风1号方低、高剂量组大鼠72 h脑血肿旁组织TNF-α、IL-1β水平显著降低(P<0.01)。见表4。
表4 中风1号对AICH模型大鼠脑血肿旁组织TNF-α、IL-1β的影响(pg·mL-1,±s)

表4 中风1号对AICH模型大鼠脑血肿旁组织TNF-α、IL-1β的影响(pg·mL-1,±s)
注:与同时段假手术组比较,##P<0.01;与同时段模型组比较,△△P<0.01
组别24 h TNF-αIL-1β 72 h TNF-αIL-1β 5±37.57模型组1146.19±111.04##1209.49±138.93##994.83±159.07##1066.40±175.96##中风1号方低剂量组1073.17±123.71 1051.21±95.94 754.28±119.20△△811.52±61.44△△中风1号方高剂量组930.57±73.72△△832.40±102.58△△660.17±138.30△△619.18±71.14假手术组68.51±15.38 387.44±36.99 73.26±10.37 413.6△△
4 讨论
脑出血归属于中医学“出血性中风”范畴。既往中医治法有活血化瘀法、破瘀涤痰法、通腑法、复元醒脑法、解毒活血法、凉血通瘀法等[7]。课题组秉承国医大师周仲瑛教授学术思想,认为“离经之血便是瘀”“治风先治血,血行风自灭”,因此瘀血证候贯穿于出血性中风整个过程。瘀血日久郁而化热,而致瘀热搏结阻于脑窍,瘀热搏结不解,则热愈炽,瘀益甚,气机愈壅,进而化火、生风、成痰(水),三者互为因果兼夹,终致风火相煽,痰瘀闭阻于脑窍,而致脑髓受损,神机失用[8,9]。治则当急则治其标,以凉血通瘀为治疗大法。所拟中风1号方,以生大黄为君药,凉血逐瘀,通腑泄热,实际运用中无论有无腑实证候,均可应用,以下为度;臣以生地黄清热凉血、养阴生津,以治瘀热相搏所致之伤阴耗血,牡丹皮、三七凉血活血散瘀,既可阻断血中之热煎熬成瘀,又可防瘀热生风化痰,佐以瓜蒌,清热化痰,润肠通便,使以石菖蒲,芳香走窜、开窍豁痰、醒神益智、引药上行以达巅顶。全方共奏凉血活血、通腑泻热、开窍通络、上下并治之功。
现代医学认为,脑部炎症在血脑屏障受损、脑组织损伤、神经细胞凋亡等方面发挥了重要作用[10]。田婷等进行了脑出血瘀热机元的生物标志物的研究,发现“热”机素主要与炎症反应有关,TNF-α、IL-1β明显升高[11]。王昀应用人全基因组表达谱芯片筛选脑出血中风急性期“瘀热阻窍证”患者和非“瘀热阻窍证”患者基因的差异表达,发现34条与炎症因子相关的信号通路发生了变化,其中与TNF-α等差异明显[12]。TNF-α可干扰细胞外谷氨酸星形胶质细胞的去除导致继发性脑损伤,加剧兴奋性毒性,激活小胶质细胞,诱导NF-κB活化,加重炎性反应产生级联效应,亦能增强炎症细胞粘附作用,进一步导致脑血管结构、血脑屏障受损[13-14]。IL-1β主要是脑出血后继发性脑损伤刺激星形细胞、胶质细胞和内皮细胞所分泌,且能进一步激活星形胶质细胞、巨噬细胞,破坏血脑屏障,促进神经细胞凋亡[13,15];另一方面,IL-1β又诱导免疫细胞产生继发性细胞因子等,诱导炎性反应,扩大级联效应,造成细胞、脑组织的进一步损伤[16]。两者在脑出血急性期显著升高,并与病情严重程度呈正相关,能评价脑出血严重程度,参与预测急性脑出血的病情恶化[17-19]。
本研究中,中风1号方可不同程度降低不同时间段AICH模型大鼠Longa 5级评分、脑组织含水量、EB含量,72 h更明显,提示中风1号方可改善急性脑出血大鼠神经功能损伤、修复血脑屏障受损,减轻脑水肿。另外,本方亦可不同程度地显著降低脑出血周围组织24 h、72 h的TNF-α、IL-1β水平,提示中风1号方缓解急性脑出血的机制与抑制炎症因子水平密切相关。虽然中风1号方低、高剂量组对24 h大鼠神经功能、脑组织含水量的效果不存在明显差异,但有下降趋势,且中风1号方高剂量组对大鼠脑组织EB水平、TNF-α、IL-1β水平的效果比低剂量组更明显,存在剂量依赖性,这可能与给药疗程短等因素有关。药理研究结果提示,中风1号方中的中药单体大黄素可降低铁过载,抑制小胶质细胞激活,降低TNF-α、IL-1β、谷氨酸水平,减轻脑水肿,缓解脑出血[20-21];牡丹皮通过升高大鼠血清超氧化物歧化酶含量、降低丙二醛、一氧化氮含量,减轻氧化应激、炎症反应[22];三七总皂苷可降低脑出血大鼠TNF-α水平,保护损伤脑组织[23];石菖蒲能减轻缺血脑中风模型大鼠脑水肿、保护脑细胞的作用与抑制脑皮质和海马神经细胞凋亡相关[24]。生地黄汤(含生地黄、大黄)可显著改善AICH模型大鼠神经功能,减轻脑水肿及EB外渗,其机制与下调TLR4、NF-κB、TNF-α、IL-1β表达,抑制小胶质细胞活化有关[25]。有研究者采用差异mRNA表达结合网络药理学方法,发现周老所拟凉血通瘀方(含大黄、三七、生地黄、赤芍等)可通过干预AICH模型大鼠7个靶点,涉及5个病理通路来改善AICH,主要包括修复脑功能缺损,改善神经功能,保护血脑屏障损伤,减少炎症因子,抑制细胞凋亡[26]。他们的研究进一步佐证了凉血通瘀法的疗效,也为我们课题组进一步深入研究中风1号方的作用机制指引了方向。
