自组装纳米粒子在肿瘤诊疗中的研究进展
2021-01-21欧昌金司伟丽董晓臣
戈 伟,欧昌金,司伟丽,董晓臣,
(1.南京工业大学 先进材料研究院 江苏省柔性电子重点实验室,江苏 南京 210009; 2.南京信息工程大学 化学与材料学院,江苏 南京 210044)
近年来,肿瘤的发病率日益增高,严重威胁着人类的生命健康,并已成为我国主要的致死疾病之一[1-2]。目前,临床上治疗肿瘤的主要手段为手术、放疗与化疗[3]。手术通常是早期患者的首选治疗方式,但对中晚期患者的治疗效果有限[4];化疗是一种全身性治疗,但通常伴随较大的毒副作用,如恶心、呕吐、脱发、肝肾功能损伤等[5];放疗是一种高效的局部疗法,但其产生的辐射不可避免地会对肿瘤周围的正常组织或造血功能产生损伤[3,6]。3种疗法各有所长,在临床治疗中相互补充,但都无法根治肿瘤且无法保证患者的生存质量。鉴于传统疗法的局限性,许多新兴的微创疗法被研究并用于肿瘤治疗,如光动力疗法(PDT)[7]、光热疗法(PTT)[8]、化学动力疗法[9]、基因疗法[10]和免疫疗法[11]等。光动力疗法与光热疗法可统称为光治疗,分别通过光敏剂(PS)或光热试剂吸收光能并产生有毒的活性氧物质(ROS)或高热来杀伤肿瘤细胞[12-14]。化学动力疗法通过芬顿试剂在肿瘤区域发生芬顿反应,原位催化H2O2生成ROS进而杀死肿瘤细胞[15]。这些新兴疗法具有微创、毒副作用小、治疗效果好等优点,与传统治疗方式相互补充,在肿瘤治疗领域有着独特的地位。但不论是传统的化疗、放疗试剂,还是新兴疗法的光敏剂、光热试剂和芬顿试剂,它们在以分子形式给药时,由于缺乏靶向性,会通过血液循环系统进入全身组织和器官;另外,这些试剂通常存在水溶性差、生物相容性差、稳定性差、血液清除率高和多药耐药性等缺点,限制了它们的使用[16-17]。
纳米技术的出现为这些问题的解决带来了曙光。在生物医疗领域中,诊疗试剂纳米化能够提高它们的水溶性、稳定性和靶向性[17-19]。由于肿瘤组织的异常增生等原因,与正常组织的血管相比,肿瘤区域的血管具有形状不规则、弯曲、有漏洞等特点。尺寸为20~200 nm的纳米药物能有效地穿透肿瘤畸变血管,通过高通透性和长滞留效应(EPR效应)进入并累积在肿瘤区域[20]。与传统的以自由分子形式存在的药物相比,纳米药物在体内具有许多独特的优点,如被动靶向性、克服多药耐药性、更好的生物相容性和药代动力学参数等[21-24]。其中,自组装技术制备的新型有效的抗肿瘤纳米粒子更引起了科研人员的兴趣[25-28]。自组装指的是有机分子通过非共价的超分子作用力(亲疏水作用、氢键、静电作用、主客体作用、π-π堆积和范德华力)自发地聚集,形成稳定聚集体。自组装技术在制备抗肿瘤药物方面显示出极大的优势:① 由于驱动力的非共价特性,自组装制备纳米粒子的合成通常方便快捷和绿色环保,有利于大规模的合成制备;② 非共价键较弱的相互作用力,使得多功能纳米药物容易在独特的肿瘤微环境中发生解聚,展现出智能响应性与靶向性等特征;③ 纳米粒子功能多样可调,可以实现功能导向的纳米材料的设计,如多模式成像、肿瘤靶向、药物可控释放、协同治疗等;④ 用于构建纳米粒子的基础单元成分一般包括天然产物、内源性的生物分子或金属元素以及一些通过美国食品和药物管理局(FDA)批准的药物,这些组成对人体的生物相容性好、安全性高,有利于实现实验室成果进入临床再到工业大规模生产的转化。笔者介绍了用于肿瘤治疗领域的单组分、双组分与多组分自组装纳米颗粒的最新研究进展,并对自组装技术在纳米药物中的研究进行展望。
1 单组分自组装纳米粒子
部分有机药物分子同时具有疏水端与亲水端,这类两亲性药物在水中通过亲疏水作用等超分子作用,倾向于将疏水端埋在内部,当亲水性与疏水性达到平衡时,形成有序、稳定的纳米粒子[29]。此外,有少部分非两亲性药物由于本身独特的结构,如大的共轭平面等,其自身可以通过π-π堆积、疏水作用等形成水溶性纳米聚集体。由于大部分诊疗试剂是疏水的,将疏水药物通过共价修饰亲水官能结构端变为两亲性药物,因此单组分自组装纳米粒子可以分为本身具有治疗性能的药物自组装制得的纳米粒子和需要通过共价修饰将药物变为两亲性分子再自组装形成的纳米粒子。由于大部分药物具有疏水性,将需共价修饰的药物细分为药物-非药物、药物-药物共价连接的单组分自组装纳米粒子。
1.1 药物本身自组装纳米粒子
使用已有的或商业化的临床药物自组装制备的纳米粒子极具吸引力,这样可以避免冗繁的有机合成且药物的安全性等有相对完善的评估验证。有些药物由于自身具有大的共轭结构,可以在特定条件下生成H-聚集体或J-聚集体等有序自组装结构,如喜树碱(CPT)、吲哚菁绿(ICG)、IR825等[30-31]。ICG作为临床上诊断肝功能相关疾病的造影剂,因具有大的共轭体系、较好的近红外吸收和光热特性,常用于光热治疗研究。据报道,通过热处理可以获得ICG的J-聚集体[32]。Liu等[33]通过简单绿色的方法得到了ICG的单组分纳米J-聚集体,被细胞摄取之后又可以重新分解成ICG,与自由分子形式的ICG相比,获得的纳米粒子在水相中更稳定、生物利用度高、生物相容性和治疗效果更好。化学合成中常见的改善疏水物质亲水性的方法有引入亲水的官能团,如羧基、羟基、氨基等。如图1所示,Li等[34]将氨基引入锌酞菁(PcA)染料中以提高该染料水溶性,此外,由于氨基的孤对电子与酞菁大环之间容易发生光致电子转移而导致ROS猝灭,因此在氨基与酞菁共轭大环间引入亚甲基进行隔离,有效地抑制了光致电子转移,获得了Ⅰ型光动力纳米材料,通过电子转移生成ROS,弥补了传统光动力疗法因乏氧而影响治疗效果等缺陷。

ISC—intersestem crossing process;R—various substrates could react with PS to form ROS;type Ⅰ—eleclron transfer or hydrogen atom abstraction;type Ⅱ—direct energy transfer图1 氨基-酞菁分子结构及其自组装纳米粒子Ⅰ型光动力疗法原理示意图 [34]Fig.1 Molecular structure of PcA and self-assembled nanoPcA, and the schematic diagram of type Ⅰ PDT mechanism [34]
此外,在聚乙二醇(PEG)、聚(乳酸-乙醇酸)共聚物(PLGA)等表面活性剂的辅助下,疏水分子能够自组装获得水分散性好的纳米粒子[35]。笔者所在课题组基于氟硼二甲基吡咯(BODIPY)和吡咯并吡咯二酮(DPP)母核结构,设计并开发了系列光治疗试剂,通过光动力疗法和光热疗法的协同作用,展现出优异的抗肿瘤性能[7,36]。将血管生成抑制剂与BODIPY结合得到小分子氟硼二甲基吡咯衍生物(BDPVDA)以及将二异丙基氨基(PPDA)引入PEG得到了聚合物mPEG-PPDA,通过mPEG-PPDA与BDPVDA相互作用自组装制得纳米粒子PBV NPs。一方面,由于核壳间的电子转移,在近红外光照的情况下,PBV NPs可以有效地发生Ⅰ型光动力过程,产生超氧阴离子,杀伤肿瘤细胞;另一方面,酯键水解释放出血管生成抑制剂破坏血管,从而进一步抑制肿瘤细胞扩散。细胞与活体实验研究表明,不论在乏氧还是常氧环境下,该纳米材料都能有效地杀伤肿瘤细胞和抑制血管生成[36]。
1.2 药物-非药物共价连接的自组装纳米粒子
非药物指的是不具备治疗和药理性能的成分,这类成分常是一些亲水的、生物相容性好的寡聚物、聚合物、生物分子或亲水的官能团等,它们在人体内容易降解且不会引起激烈的免疫反应及产生毒副作用。常见的非药物材料主要有三甘醇、聚乙二醇及其衍生物、聚丙烯酸及其衍生物、各种多糖、糖苷等[37-42]。Chen等[42]将三甘醇引入荧光染料Aza-BODIPY,得到具有两种聚集态的两亲性Aza-BODIPY光热分子,该分子可以在溶液中自组装形成亚稳态纳米纤维,延长了Aza-BODIPY在血液中的循环时间。而在光照条件下,随着温度的升高,纳米纤维逐渐转变成热力学更稳定的纳米球,实验证明纳米球比纳米纤维具有更强的穿透能力,从而深层肿瘤得以治疗。这两种纳米形态的样品具有不同的光谱吸收和光声信号,可以通过监测光声信号的变化来检测形态的转换。
此外,将多肽、核酸、蛋白质等生物分子作为亲水段连接到疏水药物上的研究也层出不穷,有大量关于各种基于生物分子的多功能自组装纳米粒子的报道[43-46]。Tan等[45]设计合成了DNA与CPT连接的可以自组装形成纳米粒子的两亲性分子,在光照条件下,该DNA-CPT纳米粒子可以脱落DNA外壳,释放出小分子药物,且验证了重新释放的CPT药物具有和自由药物分子同样的治疗效果。为解决光动力疗法中光敏剂的光漂白和全身毒性问题,Jia等[47]将酞菁光敏剂与多肽共价连接的两亲物在生理盐水中自组装,得到聚集态纳米粒子,该纳米粒子可以抑制光敏剂的荧光与ROS的生成。而在肿瘤特殊的微环境条件下,纳米粒子又重新分解为多个单体酞菁光敏剂,恢复了荧光与ROS生成能力,从而减少了光敏剂脱靶和光漂白等问题的产生。生物分子除了本身具有亲水性,进入体内也可履行特定的生物功能,如透明质酸(HA)可以特异性地结合肿瘤细胞表面过表达的CD44受体用于靶向[48]。类似的,亲水环多肽RGD可以与肿瘤细胞膜上过表达的整合蛋白αvβ3结合,实现主动靶向的功能,Ji等[49]将疏水化疗药CPT、光敏剂吲哚菁染料Icy5和具有靶向性的亲水环多肽RGD三者共价结合,获得了具有增强光动力、化疗、活体成像、深层肿瘤治疗的多功能一体化自组装纳米药物。由于聚集导致的更高的系间窜越率,纳米粒子具有更高的单线态氧量子产率,产生的ROS可以有效地将纳米粒子变小,用于深层治疗,且经过酯酶水解酯键释放出CPT进行化疗,达到协同治疗的目的(图2)。

图2 Icy5-CPT-RGD的分子结构式及其自组装形成的光疗纳米药物(PTN)在光照条件下的药物释放示意图[49]Fig.2 Molecular structure of Icy5-CPT-RGD and schematic diagram of drug release of self-assembled PTN under light condition [49]
1.3 药物-药物共价连接的自组装纳米粒子
将亲水药物作为亲水端引入疏水药物中得到两亲性药物,展现出药物的协同作用[50-52]。新获得的多功能分子具有独特的性能,且连接两个药物的通常是在肿瘤微环境中易于断裂重新变成两种药物的键,如酯键、二硫键等,多功能一体化纳米药物能够解决多药耐药性和生物相容性差等问题,且药物进入体内后可以重新分解成两个具有抗肿瘤活性的药物分子并各自发挥治疗作用,获得较单体药物更好的治疗效果[53-56]。
目前,常见的自组装方法是将疏水药与亲水抗肿瘤药物通过酯键或二硫键等连接,获得在水溶液中可以自组装且具有两亲性的新型前药分子。在自组装纳米粒子研究中疏水端常使用的药物有CPT、苯丁酸氮芥(Cb)、苯达莫司汀(BdM)、紫杉醇(PTX)等,亲水端常用的药物有吉西他滨(Gem)、伊立替康(Ir)、氟脲嘧啶(FUDR)、氨甲叶酸(MTX)、阿糖胞苷(Ara-C)等,图3中列出了几种有代表性的用于自组装制备纳米粒子的药物-药物偶联分子[57-61]。Sun等[59]通过可生物降解的酯键将亲水化疗药FUDR和疏水的天然中药土荆皮乙酸(PAB)结合,一步合成出能在水中自组装成纳米粒子的FUDR-PAB前药分子。PAB作为天然的中草药成分,具有抑制血管生成的作用,可以阻断对肿瘤细胞供给O2和营养物质,对肿瘤细胞有显著的毒性并能抑制其转移。体内实验表明,FUDR-PAB纳米粒子具有化疗和抑制血管生成的作用,且对耐药细胞具有较高的抗肿瘤效果。
2 双组分与多组分自组装纳米粒子
双组分和多组分自组装纳米粒子为纳米复合物,即由两种或多种不同分子或离子通过氢键、π-π堆积、疏水作用等超分子作用力,按特定的几何结构形成的多功能纳米颗粒。这类自组装纳米粒子的构建成分丰富多样,理论上这类自组装纳米粒子有无限的组合方式,可灵活设计纳米结构以及功能导向的多功能纳米药物,如,将化疗药物与光疗试剂(光敏剂或光热试剂)相结合构筑的纳米诊疗平台,可以实现成像介导的化疗-光疗协同肿瘤治疗。这种多功能纳米粒子的制备无需化学合成,因此药物筛选方便快捷。根据不同纳米粒子常见组成成分的突出特点,可以将双组分与多组分自组装纳米粒子分为四大类,分别为共轭体系复合物自组装纳米粒子、有机金属复合物自组装纳米粒子、大环主客体复合物自组装纳米粒子和生物分子相关复合物自组装纳米粒子。

图3 已报道的部分自组装制备纳米粒子的疏水药物-亲水药物偶联分子结构式[57-61]Fig.3 Molecular structures of hydrophobic drug-hydrophilic drug coupling that have been reported for preparing nanoparticles via self-assembly[57-61]
2.1 共轭体系复合物自组装纳米粒子
该体系自组装纳米粒子的显著特点是组成成分具有芳香环和大共轭结构,主要以氢键、π-π堆积、疏水作用和静电作用等超分子作用力自组装形成纳米粒子。目前,临床常用的有机药物分子常含有亲水基团,如羧基、氨基、羟基、氨基和(杂)芳香环共轭体系,不同的药物之间可以通过超分子弱作用形成纳米复合物,而且药物间不是通过共价键连接,不影响药物在体内的生理活性,将不同功能的药物组合到一起,获得多功能的自组装药物[62-64]。此外,化疗药除了能有效地杀伤增殖过快的肿瘤细胞,还可以作为增敏剂使细胞对其他药物更敏感,联合不同治疗的药物达到协同治疗的目的[65-67]。
多药耐药性、肿瘤组织的乏氧环境、氧化-还原环境等诸多因素限制了药物的化疗作用的发挥。因此,可以针对单一药物存在的问题,通过自组装方式制备功能互补的多功能纳米药物,实现协同治疗的目的。例如,多药耐药性与细胞内P糖蛋白表达升高有关,因而将P糖蛋白抑制剂与化疗药组合制备多功能纳米粒子,可以有效提高药物的浓度和摄取,改善化疗效果。此外,不同化疗药自组装制得的纳米粒子也可降低对单化疗药的多药耐药性,Zhao等[68]以10-羟基喜树碱(HCPT)和阿霉素(DOX)为构建模块,通过π-π堆积制得水溶性的纳米粒子HD NPs,与自由分子HCPT相比,其溶解性提高了50倍,延长了药物在体内的循环时间,且细胞实验表明HD NPs可以减少耐药细胞MCF-7R的P糖蛋白引起的DOX泵出,使DOX在耐药细胞中的滞留量提高了两倍,对耐药细胞MCF-7R也具有杀伤作用。
对于光动力治疗,限制其对肿瘤治疗作用发挥的主要原因是瘤内的乏氧问题,该问题可以通过增大O2含量、减少O2消耗和使用乏氧响应药物来解决,其中增大局部O2含量的途径有直接输运O2到肿瘤区域和原位催化生成O2等,减少O2消耗有从细胞线粒体呼吸链出发抑制代谢等。Fan等[69]利用自组装技术将维替泊芬(VER,二代卟啉光敏剂,能选择性进入不正常血管)和阿托伐醌(ATO,线粒体呼吸抑制剂,能降低耗氧量,缓解乏氧,无细胞毒性)结合到一起,制得具有靶向选择性的增强光动力治疗试剂。该纳米粒子与细胞共同孵育后,细胞的乏氧环境得到改善,在光照条件下对肿瘤细胞表现出显著的光毒性,且活体实验实现了完全的肿瘤消除(图4)。替拉扎明(TPZ)是一种乏氧响应性化疗前药且可用作化疗增敏剂,因此,针对肿瘤微环境的乏氧特征,Song等[70]利用PEG修饰的光敏剂Ce6(Ce6-PEG)自组装包裹TPZ,制得纳米粒子(图5);又由于低密度脂蛋白(LDLR)在乏氧细胞上过表达,可作为乏氧肿瘤细胞的靶点与anti-LDLR特异性结合,将anti-LDLR进一步修饰到前一步自组装制得的纳米粒子上得到乏氧响应的多功能纳米粒子,并命名为CPTA,CPTA既具有Ce6的光热与光动力性能,又具有TPZ的乏氧响应性、化疗与放疗增敏的作用以及anti-LDLR的乏氧靶向等能力。有趣的是,在进行光动力治疗的同时会进一步恶化乏氧情况,并同时提高了TPZ的乏氧化疗能力。体内体外实验都表明CPTA具有光动力、光热、化疗和放疗的协同治疗能力,有临床治疗的价值。
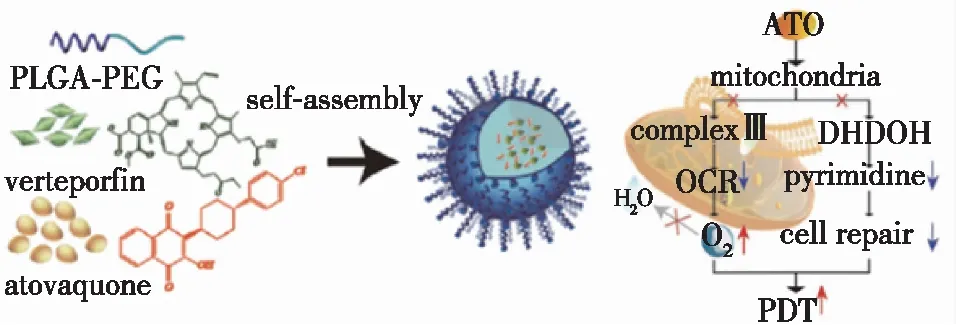
图4 VER、ATO和其自组装纳米粒子的结构简图以及ATO缓解乏氧的机制[69]Fig.4 Structure diagram of VER, ATO and self-assembly nanoparticles and the mechanism of relieving ATO hypoxia[69]

图5 Ce6-PEG自组装包覆TPZ后修饰anti-LDLR制得的纳米粒子CPTA及其相关测试和治疗示意图[70]Fig.5 Self-assembly of Ce6-PEG then co-assembly of anti-LDLR to obtain CPTA and schematic diagram of the application of CPTA in therapy[70]
光热治疗通过光热试剂产生高热来杀伤肿瘤细胞,不同试剂产生热的机制不同,如一些金属纳米粒子通过表面等离子体共振产生热[71],而有机分子则通过非辐射跃迁的振动弛豫释放热能,且激发态分子还可以通过发射荧光和系间窜越到三线态激发态等方式释放过多的能量,因此,提高光热治疗效率的策略之一为抑制荧光等释放能量,使更多的能量通过热辐射的方式释放[72]。Li等[73]报道了两种酞菁染料衍生物(PcS4和PcN4)的超分子自组装,制得的PcS4-PcN4纳米粒子具有完全的荧光猝灭、减少ROS产率和极好的光热等性能,且其产生的光声信号能用于肿瘤区域的可视化等检测。此外,合理构建给体-受体超分子体系,调控其整体光谱吸收也可以获得高性能的光热材料。Xiang等[74]报道了二苯并四硫富瓦烯(DBTTF)作为电子给体,四氰苯(TCB)作为电子受体自组装制备了共晶,并命名为DTC,由于给体和受体之间存在强烈的电荷转移作用,相较于DBTTF和TCB,DTC光谱吸收会红移至近红外区域,表现出优异的近红外光热性能。
除了以上增强单一疗法的自组装纳米粒子,将不同疗法的药物自组装制成具有协同治疗作用的纳米粒子也是研究热点,如结合传统化疗与新兴的光治疗等[75-76]。Chen等[76]将线粒体靶向的化疗药AIE-Mito-TPP和溶酶体靶向的光敏剂AlPcSNa4通过静电作用自组装获得亚细胞器双靶向的纳米粒子。该纳米粒子被细胞摄取后解离并分别聚集到线粒体和溶酶体上,并各自发挥功能,损伤线粒体和溶酶体,造成细胞死亡。有趣的是,自组装制得的纳米粒子荧光发生猝灭,在细胞内解离之后又可以恢复荧光用于辅助诊疗成像。Wei等[77]报道了将抗血管生成药物索拉菲尼(sorafenib)与Ce6结合制得了多功能协同治疗的纳米粒子SC NPs,SC NPs具有抗血管生成、阻断营养供给、光动力、光热治疗以及荧光成像等性能。在治疗过程中,Ce6会进一步消耗O2,放大饥饿疗法。体内体外实验表明SC NPs具有很好的生物相容性且能有效杀伤肿瘤细胞,有望用于临床治疗。
2.2 有机金属复合物自组装纳米粒子
由于N、O、S等元素在药物分子或氨基酸中广泛存在,并且它们与大部分金属阳离子具有优良的配位能力,已有许多有机金属复合物药物通过FDA审批用于临床治疗肿瘤,如顺铂、奥沙利铂等,用自组装技术将其制成纳米粒子并研究金属复合物纳米粒子在抗肿瘤中的应用也广受关注[78-80]。有机金属复合物自组装纳米粒子主要通过金属配位键作用而成,其通常由中心金属元素与配体组成。在人体内具有生物活性或生物相容性好、无免疫反应的常见金属元素有Fe、Mn、Cu、Pt和Au等[81-82]。除了具备生物活性的金属中心离子,配体本身的成像或抗肿瘤特性也可能使得整个纳米粒子具有成像或抗肿瘤性能。此外,形成的金属复合物由于配体与金属离子间的电荷转移,其整体光谱吸收一般会发生红移,有利于用于近红外区域的光治疗研究。
作为人体必需的微量元素,Fe元素在人体内具有独特的生物活性,它还可以作为芬顿试剂催化H2O2生成ROS,氧化损伤细胞,因此关于Fe3+的金属复合物自组装纳米粒子一直是研究热点[83-85]。笔者所在课题组利用羟基修饰的BODIPY染料(BDP-4OH)与Fe3+配位形成的纳米粒子(BDP-Fe NPs),具有催化芬顿反应生成ROS的能力、高的光热转换效率和二区光声成像等性质。体内体外实验表明,BDP-Fe NPs具有协同光热和化学动力治疗的性质,能有效地杀伤肿瘤细胞(图6)[9]。

图6 BDP-Fe NPs的合成路线及其通过CDT、PTT协同作用杀伤细胞的机制示意图[9]Fig.6 Synthetic route and schematic diagram of BDP-Fe NPs by synergy with PTT and CDT to kill cells [9]
此外,Cu2+、Mn2+也可以催化H2O2进行类芬顿反应用于化学动力治疗[86-87]。Ma等[86]报道了Cu2+与半胱氨酸(Cys)配位自组装制备得到了纳米粒子Cu-Cys NPs,该纳米粒子被细胞摄取后Cu2+能被肿瘤细胞内过高的谷胱甘肽(GSH)还原为Cu+,生成的Cu+可以进行高效的类芬顿反应生成ROS,又由于消耗了还原性的GSH,放大了氧化应激,Cu-Cys NPs能有效地造成细胞的氧化损伤,且体内实验表明该纳米粒子能有效地抑制耐药乳腺肿瘤细胞且无明显的全身毒性。与Cu2+类似,Mn2+也具有类芬顿性能,且可以作为造影剂用于核磁共振成像(MRI),Zhang等[87]利用氨基酸(Fmoc-L-亮氨酸)和Mn2+较好的配位能力,将光敏剂Ce6封装到和Mn2+自组装的超分子体系内,获得水溶性纳米粒子。该纳米粒子被肿瘤细胞摄取后,可以对细胞内过高水平的GSH响应性解离并释放Mn2+,催化芬顿反应,杀伤肿瘤细胞,同时用于MRI诊疗成像(图7)。

图7 Mn2+与氨基酸自组装包封Ce6制得纳米粒子及其治疗与成像示意图[87]Fig.7 Schematic diagram of therapy and imaging of nanoparticles prepared by self-assembly of manganese ions and amino acids in Ce6[87]
2.3 大环主客体复合物自组装纳米粒子
主客体复合物是指满足锁与钥匙原理的主体与客体通过超分子作用力结合起来的超分子复合物,研究主客体复合物在生命科学领域有着重要的意义。随着冠醚、瓜环、环糊精等亲水大环化合物的快速发展,出现了大量关于大环主客体自组装复合物的研究[27]。与大环主客体复合相关的因素有主客体的大小及形状等。大环化合物一般具有疏水性的空腔,客体的选择多样,可以是金属离子、苯环、烷基链、多糖或氨基酸等。大环主客体复合物纳米粒子在肿瘤治疗方面具有许多优势,如提高疏水药物的稳定性、水溶性与延长体内循环时间等,此外,促进主客体自发复合的作用力(如pH、氧化还原条件等)在肿瘤独特的微环境中易于被扰乱,可以在肿瘤区域有选择性地释放出药物[88-91]。图8中列出了几种常见的大环分子(葫芦脲、环糊精、杯芳烃)的化学结构和模型示意图。大环分子杯芳烃与药物自组装形成大环主客体纳米复合物用于肿瘤治疗,具有提高药物稳定性、水溶性、选择性等性能(图9)[27,89]。Zhao等[88]通过大环主客体复合物共负载光敏剂BODIPY与ROS的响应性化疗前药PTX,且负载的比例可以调控,在近红外光照下可以有效地生成ROS,并且活化前药释放PTX,进行光动力与化疗协同治疗(图10)。
2.4 生物分子相关复合物自组装纳米粒子
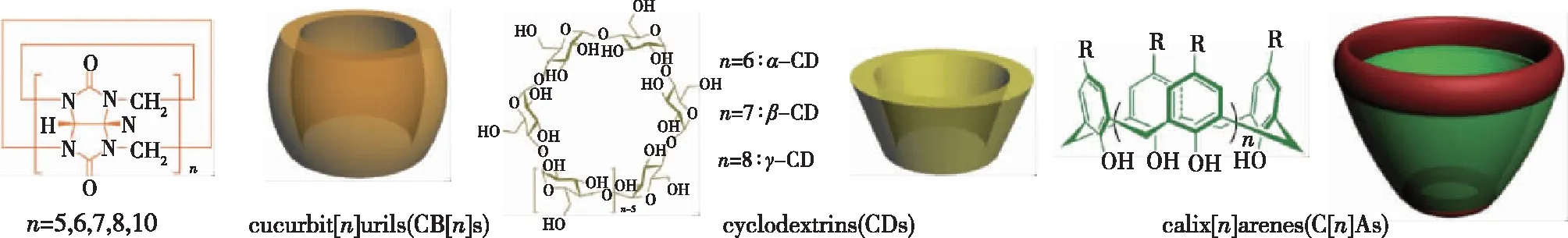
图8 大环分子葫芦脲、环糊精、杯芳烃的分子结构和模型示意图[27]Fig.8 Molecular structure and model diagram of cucurbit[n]urils, cyclodextrins and calix[n]arenes[27]
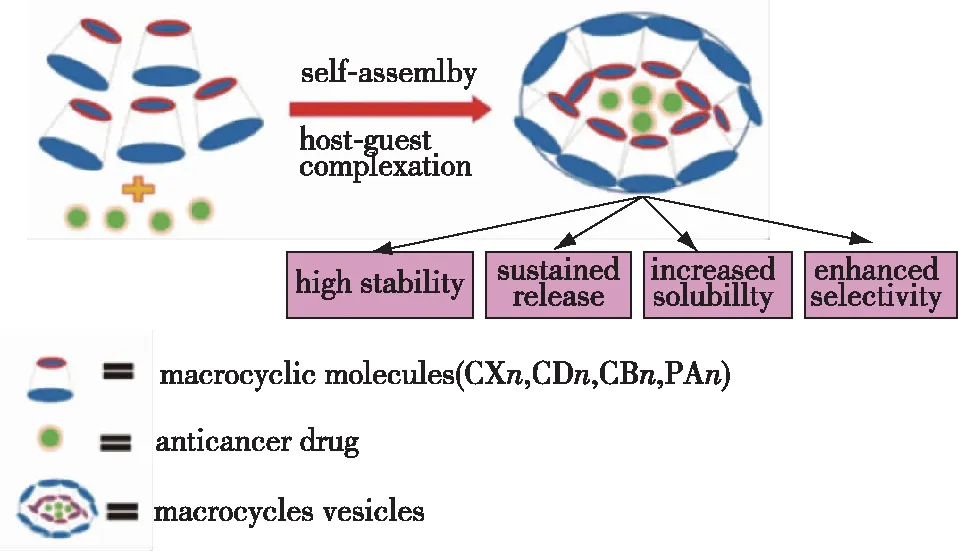
图9 大环主客体复合物自组装制备纳米粒子的过程示意图及其优点[89]Fig.9 Schematic diagram of self-assembly nanoparticles prepared by macrocyclic host guest complexes and its advantages[89]

图10 聚合物、BODIPY、前药的分子结构式以及自组装形成纳米粒子的过程示意图[88]Fig.10 Molecular structures of the polymer, BODIPY,the resulted prodrug,and schematic diagram for self-assembly process of the nanoparticles [88]
生物分子(如蛋白质、核酸等)是一类存在于生物体内的可以用于构建纳米粒子的特殊天然材料,将它们作为构建模块一般具备极佳的生物相容性和低的免疫反应性。超分子自组装在生物体内也随处可见,生物分子可以通过氢键或其他超分子作用力轻易地自组装形成复合物。目前已有许多关于蛋白质、核酸自组装纳米材料的报道[92-94]。作为体内重要的遗传物质,DNA由4种含氮碱基的脱氧核苷酸组成,两条互补的DNA链可以通过碱基识别以氢键的方式形成稳定的结构。Mou等[95]设计并合成了特定序列的载药DNA互补链并通过DNA碱基配对自组装获得不同结构的纳米药物,并且获得的纳米药物载药比例与形貌可控,体内体外实验结果表明该“特洛伊木马”纳米载药体系能比自由药物分子形式的氟脲苷具有更好的治疗效果,且在所有形貌中,巴基球形貌的自组装药物比其他结构(如四面体等)具有更好的抗肿瘤作用(图11)。作为人血清内含量最多的蛋白质,人血清白蛋白相关的载药研究层出不穷。Chen等[96]报道了一种pH响应的近红外染料能够促进人血清白蛋白自组装形成纳米粒子HSA-Croc NPs。随着pH的减小,该纳米粒子在810 nm处的光吸收增强,同时在680 nm处的光吸收减弱,可产生两种光声信号并用于肿瘤pH检测的探针中。此外,将其作为pH响应的光热试剂也能有效地杀伤肿瘤。
3 总结与展望
超分子自组装,尤其是双组分或多组分自组装,展现出灵活且便捷的优势,自组装技术制备纳米粒子为肿瘤治疗提供了新的策略。笔者总结了用于肿瘤治疗的自组装纳米颗粒领域的最新研究进展,包括它们的分类、应用以及设计思路等。目前,治疗肿瘤的手段和药物有很多,然而单一的疗法常有其局限性,因此,需要根据药物的作用机制和肿瘤微环境,将不同功能的药物自组装形成多功能纳米粒子,通过多模式协同抗肿瘤作用,提高肿瘤治疗效率。尽管自组装纳米颗粒在肿瘤治疗方面具有许多独特的优点且已经有大量的相关研究,但目前仍存在许多挑战。首先,仍需研发更智能、更安全、更高效的多功能一体化肿瘤诊疗试剂,在已有药物基础上应用自组装技术制得易于推进临床转化的高效药物将十分有意义。此外,仍应开发新的高性能诊疗药物,自组装纳米粒子的构建模块会影响整体的性能,即所使用的基础结构单元越优异,获得的纳米颗粒性能就越好,并可能出现更多的自组装组合。如今,关于治疗肿瘤药物的研究越来越多,许多药物具有大的共轭体系、富含羟基和羧基等有利于超分子自组装的构型或基团,自组装技术在纳米药物中的应用必将为肿瘤的治疗做出巨大的贡献。

图11 氟脲苷-磷酰胺的合成路线以及载氟脲苷的特定序列的DNA通过碱基配对自组装形成纳米粒子[95]Fig.11 Synthesis route of fluorourea glycoside-phosphoramide and the process of self-assembly fluorourea glycoside containing DNA by base pairing[95]
