近红外荧光成像技术引导下光动力疗法在宫颈癌中的研究进展
2022-08-10闫婷古丽妮尕尔阿里木朱丽君张琳雪张学良努尔尼沙阿力甫
闫婷,古丽妮尕尔·阿里木,朱丽君,张琳雪,张学良,努尔尼沙·阿力甫
(新疆医科大学a.公共卫生学院,b.医学工程技术学院,乌鲁木齐 830011)
宫颈癌是女性高发的恶性肿瘤之一,2020年全球新发宫颈癌约60万例,死亡30余万例[1-3]。人乳头瘤病毒(human papilloma virus,HPV)是诱发宫颈癌的主要因素之一,持续的高危型HPV感染可增加宫颈癌的发生率[4],严重危害女性身心健康。目前,治疗宫颈癌的主要方法有手术、放疗、化疗以及放化疗协同治疗[5],但均对正常组织造成较大损伤,且不良反应较多[6-7]。此外,宫颈癌诊断中常使用传统成像方法(B超、CT和磁共振成像等)进行辅助诊断,但这些成像技术存在辐射大、软组织显影分辨率差、耗时长[8-9]等不足。因此,寻求安全、高效、清晰成像的宫颈癌诊疗方式显得十分重要。
光动力疗法(photodynamic therapy,PDT)作为一种新型癌症治疗方法,具有非侵入性和可定向性的优势[10]。与传统治疗方法相比,PDT借助光敏剂治疗对正常组织损伤较小、生物安全性较高,且仅在肿瘤病灶区域表现出高摄取信号,近年逐渐受到关注。同时,光敏剂辅助的荧光成像不仅具有灵敏度和分辨率高等特点[11],还能够实现成像引导下的精准治疗,是具有良好应用前景的生物医学诊疗方式。随着对光敏剂的不断研究,第一代光敏剂血卟啉衍生物已广泛应用于临床肿瘤治疗。第二代光敏剂卟吩、钛菁等部分克服了第一代光敏剂的众多缺点,现已进入临床研究阶段。第三代光敏剂以第二代光敏剂为基础,进一步优化其修饰基团,能够获得更理想的成像效果。近红外荧光成像作为一种新发展的医学影像成像方式,与传统成像方式相比,其信噪比、时空分辨率、灵敏度均较高,且具有深层组织成像能力。使用光敏剂的近红外荧光成像在临床肿瘤的辅助诊断和光疗法中显示出巨大的应用潜力。现就近红外荧光成像技术引导下PDT在宫颈癌中的研究进展予以综述。
1 PDT概述
1.1PDT的方法 在PDT过程中,使用特定波长的激光照射通过注射光敏剂的肿瘤病灶区域,以激发光敏剂能量转移,从而产生对癌细胞具有毒性作用的活性氧[12-13]。与传统放疗和化疗相比,PDT具有对病灶周围正常组织损伤小、可重复治疗、无副作用等优势。近红外荧光成像已逐渐成为医学成像的研究热点。与传统可见光相比,近红外激发光的波长更长、散射更小、生物体组织穿透力更强[14-15]。此外,近红外荧光成像技术具有高时空分辨率、低自发荧光背景干扰、高对比度和高灵敏度[16]等优点,在提升医学成像质量、确保精准肿瘤诊断等方面有巨大的应用价值。因此,生物安全性可靠且发光的光敏剂与长波长的近红外光源组合使用能够杀死癌细胞,为宫颈癌的诊疗提供新的技术手段。
1.2PDT的三要素 PDT的三要素为激光、光敏剂、活性氧。其中,激光为PDT的第一要素,故选择合适的激光尤为重要。传统可见激光能量低、散射强[17-18],不足以很好地实现成像引导下的PDT。近红外激光的波长较长,能改善传统激光光散射强的缺点,且可穿透更深层组织,进而激发更多光敏剂富集区域。光敏剂是PDT的第二要素,主要包含有机光敏剂和无机光敏剂[19],其中无机光敏剂主要有碳纳米管、半导体量子点和掺杂稀土的发光纳米材料等,然而无机光敏剂潜在的毒性问题使其应用受到限制[20]。有机光敏剂主要包括有机小分子和有机纳米颗粒,具有良好的生物兼容性、低毒性,可实现高清晰度的生物体成像[21-23]。活性氧作为PDT的第三要素,经激光照射后,光敏剂由基态跃迁至激发态,将能量传递给周围的氧分子,从而形成活性氧,光敏剂三重态发生电子转移形成自由基阴离子和超氧化物(称为Ⅰ型反应),或与基态分子氧发生能量转移,产生单线态氧(1O2,称为Ⅱ型反应)[24],即产生活性氧,最终引起癌细胞损伤乃至凋亡,以达到治疗肿瘤的目的[25-27]。活性氧的产生主要基于光敏剂与激光的共同作用,光敏剂具有近红外荧光特性,经激发后可实现近红外荧光成像并提高活性氧产生率,从而更好地实现近红外荧光成像引导下高质量的PDT。
2 有机光敏剂辅助的PDT在宫颈癌中的应用
有机光敏剂凭借良好的生物相容性、低毒性以及独特的荧光特性,可辅助近红外荧光成像技术实现高时空分辨率、成像清晰、高灵敏度的PDT,可避免无机光敏剂的潜在毒性,并实现宫颈癌治疗的高效癌细胞消融与高质量成像。常用的3种典型近红外有机光敏剂主要有原卟啉Ⅸ(proto-porphyrin Ⅸ,PPⅨ)、二氢卟吩e6(chlorin e6,Ce6)和聚集诱导发光(aggregation-induced emission,AIE)有机纳米颗粒等。
2.1PPⅨ光敏剂 PPⅨ是人体组织细胞正常成分,美国食品药品管理局批准其作为光敏剂[28],基于PPⅨ的有效积累可抑制癌细胞的增殖,PPⅨ与其他粒子联合可实现PPⅨ的外源性补充,且小剂量光敏剂即可抑制癌细胞增长,进一步增强PDT作用。近红外有机光敏剂PPⅨ及其应用见表1。
5-氨基乙酰丙酸(5-aminolevulonic acid,5-ALA)是血红素前体,其本身没有光敏剂的特性,但可在人体内与酶发生反应并转化为PPⅨ。PPⅨ作为一种内源性光敏剂,借助激光可在肿瘤区域发生PDT,抑制癌细胞生长,还具有较强的荧光信号。Rossi等[32]对5-ALA介导的PDT在妇科肿瘤中作用的研究显示,在600~700 nm激光照射下,HeLa、MDA-MB-231等
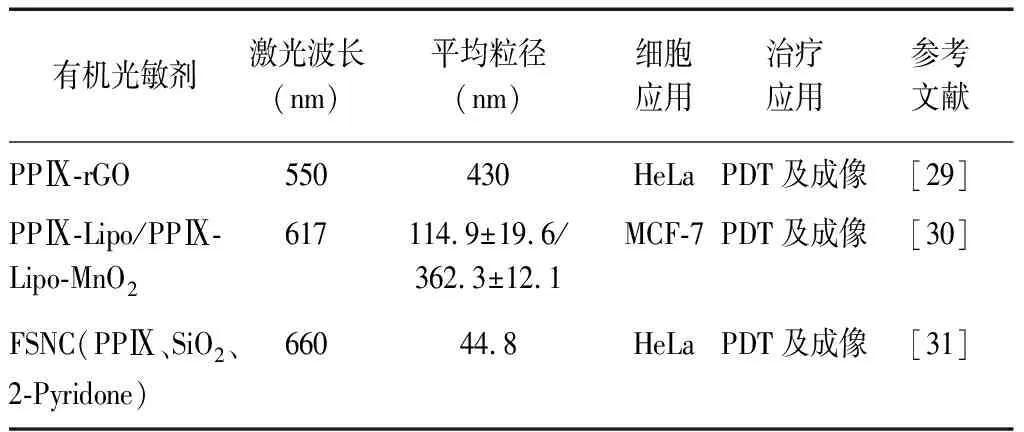
表1 近红外有机光敏剂PPⅨ及其应用
6种细胞线粒体中观察到光敏剂的发光和亚细胞的损伤,并在6种细胞中均发现5-ALA诱导的PPⅨ有效积累,在光能量>15 J/cm2时,可获得至少3个对数的细胞杀伤率,这为肿瘤细胞内光敏剂的有效聚集提供了依据。经肿瘤细胞内化后,光敏剂仍具有明显的荧光信号,且与疗效显著相关。PPⅨ与激光共同作用才可完成PDT,PPⅨ在人体内通过酶反应产生,但若没有激光或自然光的照射,并不能发生PDT,表明光敏剂与激光照射在PDT过程中缺一不可。Xie等[33]采用100 mW/cm2、635 nm波长激光治疗生殖器尖锐湿疣30 min,结果显示,ALA-PDT可以剂量依赖方式抑制HeLa细胞增殖,且治疗后HPV病毒载量明显降低。
经前体物质酶促反应产生的内源性PPⅨ较少,耗时较长。因此,将外源性PPⅨ进行基团修饰后内化至体内是增加其积累量的有效方法,修饰后的PPⅨ光敏剂既降低了较高的暗毒性,又提升了富集量,改善了体内PPⅨ的有效积累与稳定性,以获取最大优势下的PDT效果。Shuvra Smita等[29]基于氧化石墨烯在生物安全性和亲水性方面的优势,以葡萄糖为还原剂,将PPⅨ与还原后的氧化石墨烯官能化,其官能化偶联步骤简单,且具有较高的PPⅨ负载量与光吸收能力,在635 nm激光照射下,仅0.001 mg/ml的浓度即对HeLa细胞表现出明显的增殖抑制,具有较高的PDT效率。Zhang等[34]发现,经聚乙二醇与金纳米棒修饰的PPⅨ-聚乙二醇、PPⅨ-金纳米棒复合物具有更理想的稳定性与生物相容性。在1 064 nm激光照射下,存在PDT以及光热疗法(photothermal therapy,PTT)的协同治疗,可实时观测凋亡情况的生物成像。
综上,PPⅨ的内源性特点大大提升了其生物安全性、可代谢性,在PDT过程中,荧光信号与疗效并不消失,对正常组织的损伤几乎可忽略。且修饰后的外源性PPⅨ复合物不仅具有类似于内源性PPⅨ的良好生物安全性和生物相容性,还保留了较强的荧光信号及PDT的高细胞杀伤率,为辅助诊断及治疗妇科恶性肿瘤提供了一种非手术疗法。
2.2Ce6光敏剂 四吡咯结构类光敏剂在临床PDT中广泛应用,以PPⅨ、Ce6等常见[35]。与PPⅨ相比,Ce6的最大吸收波长更长、穿透力更强、成像更清晰,在PDT与PTT协同治疗中表现出潜在优势。近红外有机光敏剂Ce6及其应用见表2。
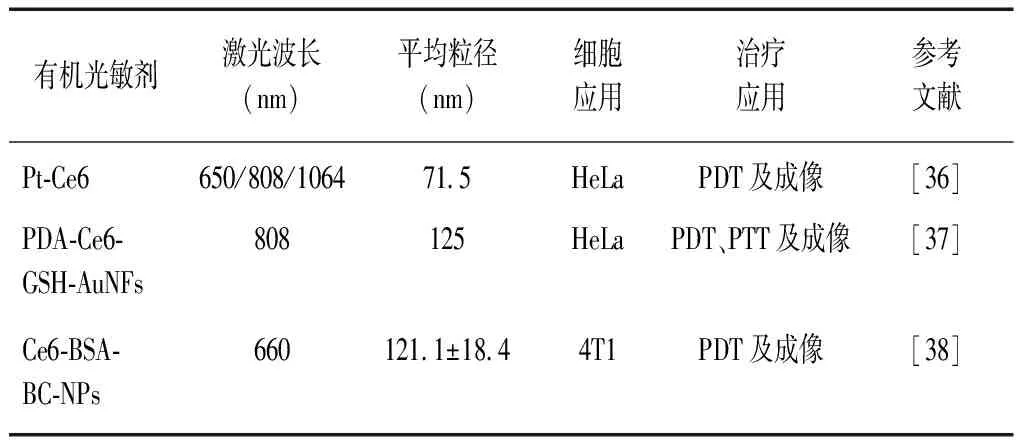
表2 近红外有机光敏剂Ce6及其应用
缺氧是肿瘤微环境的常见特征,缺氧会限制反应速率,进而明显制约PDT效率。研究者通过提供谷胱甘肽来解决这一问题。通常Ce6在激光照射下容易被消耗降解,而二氧化锰(manganese dioxide,MnO2)薄片可以保护激光照射下的Ce6不被降解,增强其稳定性。Gulzar等[39]基于保护Ce6组装了一种能克服肿瘤缺氧和谷胱甘肽导致PDT抵抗的纳米复合材料(过氧化钙-MnO2-环己烷-Ce6/阿霉素),其中MnO2与过氧化钙在过氧化氢和水的调节作用下生成氧气,同时MnO2将Ce6的荧光信号覆盖,但随着MnO2的消耗降解,Ce6的荧光特性恢复。在808 nm激光照射下,Ce6荧光信号可在更深层生物组织内呈现,不仅可提升成像的时空分辨率,还在肿瘤细胞中表现出剂量与时间依赖性,并可有效杀死肿瘤细胞。Chen等[36]利用铂负载过氧化氢酶与Ce6制备的复合材料能够持续分解过氧化氢生成氧气,以缓解肿瘤缺氧,具有制备简单、可重复的特点,在650 nm激光照射下,Ce6传递能量产生的活性氧能够降低线粒体的膜电位,使线粒体中的细胞色素C释放到细胞质,最终导致线粒体介导的细胞凋亡,可明显抑制HeLa细胞增殖,并在BALB/c小鼠中表现出明显的抑瘤作用和荧光稳定性。
Ce6通过PDT产生活性氧,进而抑制肿瘤细胞增殖,并通过PTT的光热转换实现PDT/PTT协同作用,与单纯PDT或PTT相比,细胞杀伤能力更强。Lin等[40]基于Ce6开发了一种多功能纳米颗粒,其具有合适的生物相容性、光稳定性和横向弛豫率。在808 nm和670 nm近红外激光照射下,该多功能纳米颗粒作用于HeLa细胞的活性氧生成速率与细胞杀伤率随之增加,PDT/PTT协同作用的效果显著。为了使Ce6在体内具有良好的发光特性并参与PDT的发生,Zhang等[41]设计了一种Ce6-共轭金纳米棒(Ce6-聚乙二醇-AuNR),经修饰的Ce6-聚乙二醇-AuNR发生荧光猝灭,但在酸性条件(pH=5.0)下,Ce6-聚乙二醇-AuNR经808 nm激光照射后发出明显的荧光信号,20 h约释放80%的Ce6,Ce6的特异性荧光恢复,能够辅助肿瘤定位;同时,在664 nm激光照射下,Ce6-聚乙二醇-AuNR能够有效产生活性氧,仅400 s肿瘤区域温度就达到55 ℃,与单纯PDT或PTT有显著差异。
由此可见,Ce6的长波长有助于实现深层生物组织的成像,其与多肽结合可将诸多改善肿瘤缺氧微环境的物质带入生物体,从而改善肿瘤缺氧、增强PDT效率。修饰后包含Ce6的纳米颗粒即使存在荧光猝灭,但在酸性环境下仍可重新释放Ce6,恢复其荧光特性,从而有效地通过PDT/PTT协同作用抑制肿瘤细胞的增殖。
2.3AIE光敏剂 PPⅨ和Ce6的多数衍生物大都表现出团簇状态,进而表现出聚集诱导荧光猝灭现象,而AIE有机纳米颗粒可有效避免这一现象[42]。近红外有机光敏剂AIE及其应用见表3。
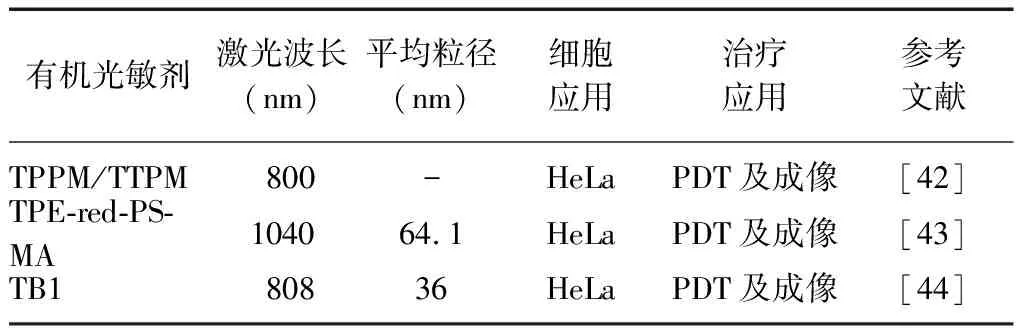
表3 近红外有机光敏剂AIE及其应用
传统单体光敏剂大多存在光稳定性差、荧光量子产生率低、斯托克斯位移小、在生物环境中稳定性欠佳等缺点。一旦产生聚集诱导猝灭现象,便导致荧光与活性氧产生率降低。研究者通过包覆修饰单体光敏剂解决上述问题。与传统单体光敏剂相比,AIE光敏剂具有较大的斯托克斯位移、较强的荧光信号以及较高的活性氧产生率。活性氧作为PDT的关键因素,其高产生率有望更好地抑制肿瘤细胞增殖。Luo等[45]设计合成了一种硅胶聚合物(1-甲基1,2,3,4,5-五苯基硅烷)作为光敏剂,该聚合物表现出明显的AIE现象,随着溶液中硅胶聚合物光敏剂含量的增加,其荧光光谱逐渐红移且荧光增强,说明发光未被聚集猝灭,此结果与聚集诱导荧光猝灭相反,表明聚集可使硅胶聚合物光敏剂的发光与PDT效率大幅提升。Ysraki等[46]将4-巯基苯甲酸修饰的银纳米颗粒(AgNP)通过静电作用形成红色发光的AgNP@AIE-PS光敏剂,其荧光猝灭仅5%,且具有较高的活性氧产生率、良好的生物相容性和荧光特性;细胞荧光成像数据显示,AgNP@AIE-PS在HeLa细胞中的荧光信号较单独使用AIE-PS更强,经40 mW/cm2低强度激光照射10 min后,AgNP@AIE-PS组的细胞杀伤率较单独AIE-PS组高4倍,且活性氧产生率明显升高,PDT治疗效率明显提升。Min等[47]以高负电荷的铁蛋白为支架,制备了一种更稳定的蛋白质-AIE光敏剂,其荧光发射性能较强、活性氧产生增加,荧光量子产生率达54.59%,粒径较小(35.16 nm),更易被肿瘤细胞摄取;该蛋白质-AIE光敏剂浓度为5 μmol/ml时,其暗毒性基本可忽略,在HeLa、A549、MCF-7等细胞中具有强烈的荧光信号;在5 μmol/ml的蛋白质-AIE光敏剂作用下,经0.25 W/cm2白光照射2 min的PDT组产生的活性氧多于无白光照射的对照组。
近红外激光可实现更深层组织的荧光成像,其较高的活性氧产生率与穿透深度相关。在近红外激光照射下,AIE光敏剂不仅具有荧光信号,其较高的活性氧产生亦可增强PDT的疗效,故其具备生物成像和治疗的双重优势。Fang等[48]开发了一种具有AIE特性的小分子,这种小分子(FM1210)基于苯并双噻二唑衍生物骨架,并引入Se原子和氨基来改善光敏剂的波长,可使FM1210的最大发射波长超过1 200 nm,从而实现100帧的高速近红外荧光成像,且更深层组织的荧光信号较强,能够明显抑制肿瘤生长,促进活性氧产生,显著提高PDT的疗效。Liu等[49]开发了基于供电子的以三苯胺和吸电子的氮杂氟酮为核心,并将二甲基苯胺、吡啶等取代基连接至外围的4个AIE光敏剂(TPAN、TPAPy、TPANPF6和TPAPyPF6),当其由分散状态转变为聚集态后,分子内的运动受到限制,荧光强度增强、活性氧产生率升高;在1 040 nm激光照射下,TPAN、TPAPy、TPANPF6和TPAPyPF6分别作用于HeLa细胞和荷瘤裸鼠后,HeLa细胞中出现明亮的荧光信号,且荷瘤小鼠肿瘤体积随照射时间的延长而逐渐减小。Wang等[50]设计了一种具有AIE特征并以铜为金属有机骨架的高效线粒体靶向光敏剂——PMOF,PMOF具有核壳结构,流体力学直径约为110 nm,在中性和酸性环境中具有良好的稳定性。将HeLa细胞与PMOF共同孵育24 h,可在HeLa细胞的线粒体观察到明亮的荧光,且PMOF对HeLa细胞的光毒性也强于正常3T3细胞;此外,在使用PMOF干预荷瘤斑马鱼中观察到PDT的发生,表明PMOF可以有效抑制肿瘤增长。
综上,AIE光敏剂通过包覆多种光敏剂可有效避免荧光猝灭现象的发生,并增强细胞成像的示踪能力。近红外激光照射实现了更深层生物组织内成像,并大幅度提升了荧光量子和活性氧的产生率,使荧光信号与PDT效果大大增强。
3 小 结
PDT克服了传统辅助诊断成像技术在恶性肿瘤治疗过程中导致的正常组织辐射损伤等不足,凭借微创性、不良反应小、可重复性、生物安全性高等优势为宫颈癌的研究和临床治疗提供了技术支撑。目前,有机光敏剂虽表现出高荧光量子产生率和高活性氧产生率,但由于人体内生物化学环境复杂,尚无法避免敏感聚合引起的荧光猝灭现象。因此,研究生物安全性更高、稳定性更强且具备靶向作用的光敏剂仍是未来的研究方向,同时应进一步完善激光使用条件和仪器设备等,以为PDT在宫颈癌辅助诊断与治疗中的应用提供条件,实现宫颈癌的早诊断、早治疗,提高患者生存率,改善患者生活质量。
