南美白对虾肉糜低温冻藏过程中蛋白质的特性变化
2021-01-19李志鹏周晓娇张宾苏来金水珊珊
李志鹏,周晓娇,张宾,苏来金,水珊珊
(1.浙江海洋大学食品与医药学院,浙江舟山 316022)
(2.温州市农业科学研究院,温州市特色食品资源工程技术研究中心,浙江温州 325006)
南美白对虾(Litopenaeus vannamei)的壳通透,感官效果好,肉质鲜美,含有脂肪量少,且又富含许多人类需求的营养物质。因此,它目前是世界上产量最高的虾种之一。除了高质量的肉质,养殖南美白对虾时其生活环境要求不高;并且能够很好的适应多种养殖方式,其抗病能力非常优秀也是其产量高的原因之一[1]。虾类一般都含有较高比例的蛋白质,随着当代人们对于生活品质的要求越来越高,国内外对于高营养的虾的需求量在不断升高。但是其在捕捞后至工厂加工以及后续的仓库和运输贮藏这一系列过程中的保鲜问题难以解决,因此很容易腐败变质,使得虾的各项指标都变差。目前市场上一般采用冻藏保鲜以延长虾的保鲜期,但仅仅使用冻藏保鲜并不能满足人们对其长时间的保鲜需求,且会导致虾口感不佳和品质下降[2]。因此寻找一种合适的保存虾类的方法是相关企业迫切需求的。
虾肉糜是新鲜的虾通过高速匀浆,成型而得到的产品,具有高营养,易存储,食用时简单方便等特点。如今,对虾肉糜方向的研究已经逐渐成为一个新颖的研究课题,且越来越多的水产品工厂对技术的进一步创新有着迫切的需求。曹文红等[3]研究了脊尾白虾虾糜的制备及其抗冷冻变性工艺,以凝胶强度和弹性的加权平均值为指标进行正交试验得出较好的虾糜漂洗工艺,并且初步研究了冻藏对虾糜品质的影响。目前对南美白对虾制成虾肉糜的相关报道量不多,因此本实验以虾仁为对照,在冻藏过程中对虾糜蛋白的含量,各物理指标的对比,以及化学键的变化进行详细的研究,旨在对虾仁和虾糜的品质进行比较,对后续虾类品质实验的进一步扩展研究打下基础,并为相关虾类加工提供理论基础。
1 材料与方法
1.1 实验材料
实验原料:新鲜的南美白对虾(体长13~15 cm),选购自浙江舟山老碶菜场。购买后立即将其放入事先准备的装有冰袋降温的保温箱内,快速运回实验室,并立即对其进行处理。
主要试剂:磷酸氢二钠、磷酸二氢钠、尿素、十二烷基硫酸钠(SDS)等,国药集团化学试剂有限公司;SDS-PAGE试剂盒,碧云天生物科技研究所;β-巯基乙醇,上海埃彼化学试剂有限公司;2-硝基苯甲酸(DNTB),阿拉丁试剂(上海)有限公司;Ca2+-ATPase活性测定试剂盒、总巯基、活性巯基测定试剂盒、水溶性和盐溶性蛋白测定试剂盒,南京建成生物工程研究所。
1.2 实验仪器
主要仪器:HSY-A-200恒温水浴振荡器,天津厂草科技有限公司;Tube Mill 100control型研磨机,IKA集团;CF-16RN高速冷冻多用途离心机,日本日立公司;BCD-206STPA冰箱,青岛海尔股份有限公司;DiRECT-Q超纯水装置,美国 MILLIPORE公司;751UVGD型紫外-可见光分光光度计,上海第三分析仪器厂。
1.3 南美白对虾肉糜的制备
将新鲜南美白对虾进行去头、去壳处理,获得虾仁后再除去虾肠,保留虾肉部分;然后将虾肉置于洁净组织捣碎机中(4 ℃),高速斩拌3~5 min,至虾糜变成粘稠状,即实验样品。将虾糜按相同的质量分开包装后,记录标签并将其于放于-18 ℃冰箱中冻藏保藏。在0~120 d时间段中每隔20 d,取出相对应的肉糜样品,解冻并进行后续指标测定。
1.4 测定指标
1.4.1 肉糜pH值测定
取3.0 g解冻的虾糜样品,将其放于烧杯中,加入蒸馏水30 mL,高速均质1 min,在4 ℃温度下放于冰箱中浸泡20 min,用滤纸过滤不需要的杂质,最后用PHS-25型酸度计测定滤液的pH值。
1.4.2 水溶性蛋白和盐溶性蛋白含量测定
测定方法参考沈春蕾报道[4]。水溶性蛋白含量:取5.0 g肉糜样品,加入40 mL盐酸缓冲液(含0.05 mol/L KCl),25 ℃恒温振荡提取4 h后,不需静置,以5000 r/min离心10 min后,用考马斯亮蓝法测定上的清液中蛋白质含量。
盐溶性蛋白含量:取5.0 g肉糜样品,加入40 mL高盐缓冲液(含0.5 mol/L KCl),方法同上,但在恒温提取后需要放入4 ℃冰箱中静置提取16 h,接着用考马斯亮蓝法测定上清液中的蛋白质含量。
1.4.3 肌原纤维蛋白Ca2+-ATPase活性测定
参照曹淑敏等[4]的方法测定虾的肌原纤维蛋白Ca2+-ATPase活性。实验进行 3次平行后取平均值。Ca2+-ATPase活性的计算公式为:

式中:n1为1.0 mL样品中生成磷酸物质的量(μmol);n2为对照组中生成磷酸物质的量(μmol);t为反应时间(min);m为1.0 mL反应液所含的酶蛋白质量(mg)。
1.4.4 肌原纤维蛋白含量测定
测定方法参考Fang Y等报道[6]。称取5.0 g肉糜样品,加入10 mL的去离子水,放入4 ℃冰箱静置一段时间后,用12000 r/min匀浆30 s,再以10000 r/min的速度离心20 min(4 ℃),选用沉淀物重复上述实验。再往沉淀物中加入20 mL 0.05 mol/L磷酸缓冲液(pH 7.0,4 ℃),重复实验,取上清液记为一次。重复之前的步骤,再提取一次上清液记为二次。将两次的上清液合并就是肌原纤维蛋白粗提取液。用考马斯亮蓝法测定上清液的蛋白含量即为肌原纤维蛋白含量。
1.4.5 肌原纤维蛋白总巯基和活性巯基含量测定
总巯基含量测定,参照石径[6]报道方法。取0.5 mL肌原纤维蛋白溶液,加入4.5 mL 0.2 mol/L Tris-HCl缓冲液(pH 8.0,含8 mol/L尿素,1% SDS和3 mmol/L EDTA),振荡混匀后,取4 mL混合液加入0.5 mL 0.2 mol/L Tris-HCl缓冲液(pH 8.0,含10 mmol/L DTNB),搅拌均匀后于40 ℃水浴25 min。对照组用0.6 mol/L NaCl(pH 7.0)溶液替换肌原纤维蛋白溶液。反应完成后,测定412 nm波长下吸光值,摩尔吸光系数为13600 L/mol·cm,计算总巯基含量(mol/105g 蛋白质)。
活性巯基含量测定,参考任丽娜[8]报道方法。取3.0 g肉糜样品,加入4倍量蛋白提取液(5% SDS,0.1% PBS),10000 r/min均质1 min,然后6000 r/min离心10 min,上清液用BCA法测蛋白质浓度。将溶液稀释到5 mg/mL后,加入1 mL 50 mmol/L磷酸缓冲液(pH 7.0,含有10 mmol/L EDTA-2Na,0.6 mol/L KCl),同时加入0.4 mL Tris-HCl缓冲液(pH 8.0,0.2 mol/L,含0.1%的DTNB),在25℃的水浴锅中水浴1 h。以不加Tris-HC1缓冲液的实验组作为空白对照组,用紫外分光光度计在波长412 nm处测定吸光值。巯基的计算公式为:

其中:A-吸光度;D-稀释倍数;ρ-蛋白质浓度;测得的巯基含量以mol/105g蛋白表示。
1.4.6 肌原纤维蛋白各化学键含量测定
离子键:取一定量的虾糜置于烧杯中,加入10 mL 0.6 mol/L NaCl的溶液,静置一段时间后,将样品在5000 r/min下匀浆3 min。将样品放置于4 ℃的冰箱下1 h,再在4 ℃条件下以4000 r/min的速度离心15 min。离心后将上清液于4 ℃冰箱中放置一段时间,再用考马斯亮蓝试剂法测定溶液中蛋白质的含量。
疏水键:上述离心沉淀加10 mL 1.5 mol/L尿素和0.6 mol/L NaCl的混合液,并以转速为5000 r/min的条件下匀浆3 min。将样品放置于4 ℃的冰箱下1 h,再在4 ℃条件下以4000 r/min的速度离心15 min。取其沉淀再加10 mL 8 mol/L尿素和0.6 mol/L NaCl的混合液在5000 r/min下匀浆3 min,将样品放置于4 ℃的冰箱下1 h,在以相同条件下离心15 min,上清液4 ℃保存;重复实验,并将离心所得的上清液混合后放置于4 ℃的冰箱中,再用考马斯亮蓝试剂法测定溶液中蛋白质的含量。
二硫键:参照测定参照Thannhauser[9]。取一定量的虾糜置于烧杯中,加入 5倍体积的含 0.6 mol/L NaCl、8 mol/L尿素的溶液,均质离心。取0.5 mL上述溶液于试管中,加入4.5 mL缓冲液(pH 8.0,含8 mol/L 尿素,3 mmol/L EDTA,0.2 mol/L Tris-HCl)。再取上述混合液4 mL,加入0.5 mL缓冲液(pH 9.0,含有 8 mol/L尿素,3 mmol/L EDTA,0.2 mol/L Tris-HCl)。置于40 ℃水浴25 min,冷却后在412 nm下测定上清液的吸光值。二硫键的计算公式:

其中:A为吸光度;B为蛋白浓度,mg/mL;D为稀释倍数;C为摩尔消光系数13600/( L/mol·cm)。
1.5 数据分析
本次实验的每组数据均进行三次平行,即 n=3。采用SPSS 17.0进行数据处理,不同处理组之间的差异采用多重比较分析(Duncan法,p<0.05)。采用Origin 8.0对结果数据进行制图分析。
2 结果与讨论
2.1 肉糜冻藏过程中pH值变化
虾肉的pH值可作为虾体致死后所发生的化学和生化变化情况的指标。图中为虾仁和虾糜在不同贮存天数时pH值的变化趋势。这种数值的变化间接表示了样品的品质。由图1我们可以发现,在0 d的时候,虾仁的pH为6.81,虾糜的pH为6.82,但在120 d时虾仁和虾糜组的pH分别上升到7.65和7.5。在冻藏的第0~20 d,虾仁与虾糜pH值上升趋势显著,在冻藏20~120 d的时间内,pH值处于缓慢上升状态。该结果与Alexander Chouljenkod等[10]报道相一致。虾仁与虾糜的变化规律一致,但虾仁的pH值始终高于虾仁糜。经查阅文献后发现,虾的pH值腐败临界值在8左右[11]。由结果可知,以虾仁为对照,虾糜的储存形式在冻藏过程体现出较好的保藏效果。

图1 虾仁与虾糜冻藏120 d的pH值变化Fig.1 Changes of pH in shrimp and minced shrimp frozen for 120 days
2.2 肉糜冻藏过程中蛋白质各组分含量变化
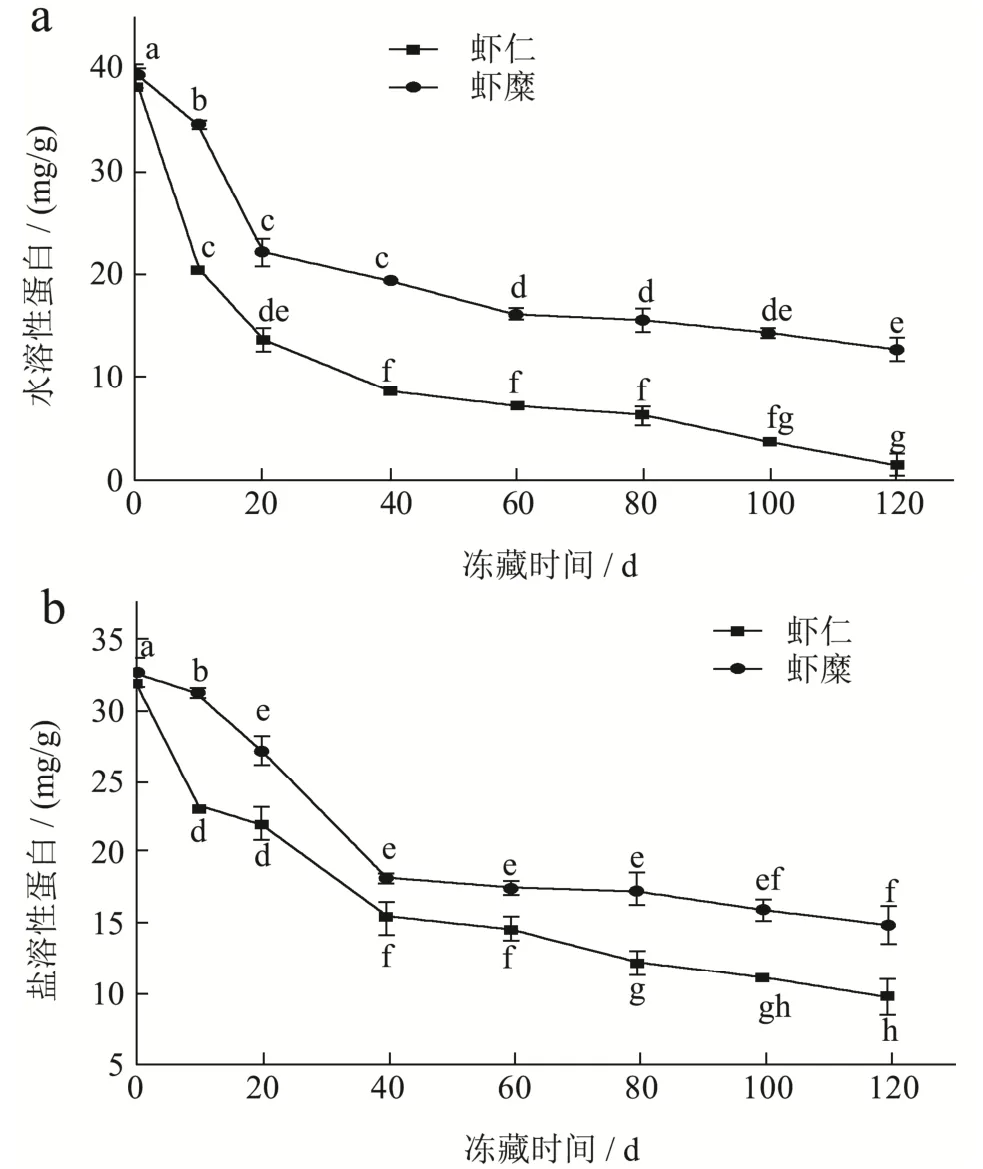
图2 虾仁与虾糜冻藏120 d的水溶性蛋白和盐溶性蛋白的变化Fig.2 Changes of water-soluble protein and salt-soluble protein in shrimp and minced shrimp frozen for 120 days
水溶性蛋白质,指的是可溶于水的蛋白质。如图2a所示,在0~120 d的时间中,两组水溶性蛋白含量一直在不断下降。第0 d虾仁的水溶性蛋白质含量为39.41 mg/g,而虾糜组为39.28 mg/g。两组样品数值在0~20 d的时间段内剧烈下降,在20~60 d下降幅度没有之前的剧烈,在60~120 d时虾糜和虾仁组的下降趋势减缓。第120 d时,虾仁和虾糜的水溶性蛋白含量较新鲜值下降了38.02 mg/g和25.38 mg/g。从图2a中可以看出,随着贮藏期的延长,虾仁的水溶性蛋白流失比虾糜严重。结果表明,虾糜制品保存效果更好。
盐溶性蛋白是虾肌中主要蛋白质,其含量占总蛋白的65%~75%[12]。如图2b所示,在0~120 d的时间中,两组盐溶性蛋白含量一直在不断下降。第0 d虾仁组盐溶性蛋白质含量为32.47 mg/g,虾糜组为32.61 mg/g。样品在 0~40 d的时间段内数值剧烈下降,在40~120 d下降趋势减缓。第120 d时,虾仁组盐溶性蛋白含量为8.78 mg/g,虾糜组为14.54 mg/g。参考江杨阳等[13]人的实验后,我们发现在低温保藏过程中,细胞中部分结合水形成冰晶,导致了肌动球蛋白之间形成化学键,导致了盐溶性降低,这一结论与本文的结果相符。该实验结果表明,虾糜组的盐溶性蛋白含量高于虾糜组,虾糜的存储形式比虾仁冻藏效果更好。
2.3 肉糜冻藏过程中肌原纤维蛋白含量变化

图3 虾仁与虾糜的肌原纤维蛋白在120 d的变化情况Fig.3 Changes of myofibrillar protein in shrimp and shrimp paste for 120 days
实验中常用水产品在高浓度的盐性溶液提取出来的肌原纤维蛋白含量的变化,来表示蛋白质变性情况[14]。由图3可知,在0~120 d的时间中,实验中的各组的蛋白含量一直处于下降趋势。第0 d时,虾仁的肌原纤维蛋白含量为37.92 mg/g,虾糜为38.1 mg/g。样品在0~40 d的时间段内数值下降幅度较大,虾仁组含量下降到了0 d时的一半,而虾糜只下降四分之一;第60~120 d时两组含量的下降幅度开始变缓,至120 d时虾仁变为原来的三分之一,而虾糜仍剩余原来的40%左右。图中肌原纤维蛋白含量的下降趋势和Feng等[14]人的实验结果相同。该实验表明,虾的不同的储存形式对于肌原纤维蛋白含量影响较为显著,且虾糜的存储形式比虾仁冻藏效果更好。
2.4 肉糜冻藏过程中肌原纤维蛋白Ca2+-ATPase活性
蛋白质的变性与Ca2+-ATPase活性之间存在怎样的关系一直是诸多研究的目标。通过Sriket P等[15]的结论,可以发现肌球蛋白的球状头部是 Ca2+-ATPase的活性中心,Ca2+-ATPase活性是反映肌球蛋白或肌原纤维蛋白分子完整性的一个重要指标,且Ca2+-ATPase活性与蛋白质变性呈正相关。从图4中可以看出,在0~120 d的时间中,两组数据的活性一直在下降。经过120 d的时间变化Ca2+-ATPase活性下降十分显著(p<0.05)。第0 d时,虾仁的Ca2+-ATPase活性为0.642 U/mg,虾糜为0.647 U/mg。第120 d时虾仁和虾糜两组的蛋白活性几乎为 0,但虾糜的活性仍然高于虾仁组。与 Puppo等[16]人的实验比较肌原纤维蛋白Ca2+-ATPase活性都处于下降趋势,参考其结论发现导致Ca2+-ATPase活性下降的原因是因为在冻藏过程中,肌球蛋白球状头部构象发生改变或者相互聚集。上述实验表明,在贮藏120 d后虾糜的Ca2+-ATPase活性仍比虾仁高,贮存效果更优秀。

图4 Ca2+-ATPase活性在不同贮藏方式下120 d内的变化情况Fig.4 Change of Ca2+-ATPase activity within 120 days under different storage methods
2.5 肉糜冻藏过程中肌原纤维蛋白总巯基和活性巯基含量
总巯基包括活性巯基和隐藏的巯基。通过汪之和等[17]人研究发现,总巯基和活性巯基变化情况可以表示蛋白质冻藏过程中的氧化程度和蛋白质的变性情况。由图5a可知,在0~120 d的时间中,总巯基含量不断下降。0 d时虾仁的总巯基含量为14.89 mmol/L,虾糜为14.82 mmol/L。第0~20 d时数值变化十分显著,虾仁在20 d已经下降到原先的的十分之一,而虾糜变为原来的18.6%,第20~120 d,结果下降幅度很缓慢,至120 d时虾仁组的总巯基的含量0.8 mmol/L,而虾糜组还剩余接近10%。由图可知,在0~120 d时间内虾糜的总巯基的含量大多比虾仁高,虾糜保藏效果比虾仁好。
由图5b可知,在0~120 d的时间中,活性巯基的含量也处于不断下降的趋势。0 d时虾仁的活性巯基含量为3.24 mmol/L,虾糜为3.25 mmol/L。两组样品在0~20 d的时间段内含量处于剧烈下降的趋势,在20~120 d又趋于平缓。曾名湧等[18]人认为,这种现象是因为肌原纤维蛋白中有一部分活性巯基位于分子外侧,在冻藏初期蛋白质结构未发生重大变化就能够被氧化。此外,参照彭欢欢等[19]人的实验结论在冻藏过程中蛋白质的聚集也会使检测到的巯基数量减少,这与本文的结论相同。该实验表明,在贮藏期间虾糜的活性巯基的含量一直高于虾仁组,因此虾糜的贮存效果比虾仁好。

图5 总巯基和活性巯基含量在不同贮藏方式下120 d内的变化情况Fig.5 Changes of total sulfhydryl and active sulfhydryl content within 120 days under different storage methods
2.6 肌原纤维蛋白各化学键含量测定
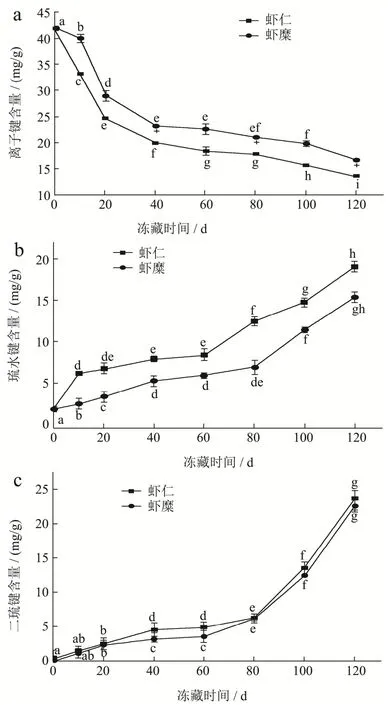
图6 离子键,疏水键和二硫键的含量在不同贮藏方式下120 d内的变化情况Fig.6 Changes of ionic bonds, hydrophobic bonds and disulfide bonds content within 120 days under different storage methods
离子键(Ionic bonds),也叫盐桥,指阴离子与阳离子之间通过静电作用形成的一种化学键,主要存在于蛋白质的表面[20]。离子键影响这蛋白质分子之间的相互作用,并且是维持肌原纤维蛋白天然结构的主要作用力[21]。由图6a可以看出,在0~120 d的时间中,离子键的含量不断变低。0 d时虾仁的离子键含量为42.03 mg/g,虾糜为41.97 mg/g。第0~40 d的时候含量下降的趋势显著,虾仁的离子键含量比0 d时下降了一半,而虾糜的含量为初始的55%;第40~120 d的时候,含量的变化曲线变得平缓,到120 d的时候虾仁组的含量为 12.55 mg/g,而虾糜组的含量为 17.05 mg/g。从实验图中可以发现,两组样品在贮藏时期离子键的含量一直下降,但虾糜组的离子键含量始终高于虾仁,因此在离子键方面虾糜的存储形式比虾仁好。
疏水键(Hydrophobic bonds),不是真正的化学键,是指蛋白质多肽链上某些氨基酸的疏水基团或疏水侧链(非极性侧链),由于避开水而造成相互接近、粘附聚集在一起[21]。从图6b可以看出,在0~120 d的时间中,两组样品的疏水键含量一直上升。在0~10 d的时候上升幅度较为显著,在10~60 d的时候含量的上升趋势平缓,但在60~120 d的时候,上升趋势变得平缓。0 d时虾仁的疏水键含量为 2.2 mg/g,虾糜为 2.13 mg/g。但在 120 d的时候虾仁组已经上升到 19.33 mg/g,而虾糜组的疏水键含量为15.48 mg/g。虾类氧化可能导致蛋白二级结构和三级结构的改变,导致溶液中极性和非极性基团数量的改变,因此可能增加表面疏水作用[22]。在实验中发现,在冻藏期间,蛋白质发生氧化作用,使其表面疏水作用增加,因此使得疏水键含量增加,这与Morzel等[23]的研究是一致的。由实验图可以发现,在0~120 d的贮藏时间段中,两组样品的疏水键一直在上升,但虾糜的疏水键含量一直低于虾仁组,所以在疏水键方面虾糜组的贮藏效果比虾仁组好。
二硫键是两个-SH基被氧化而形成的-S-S-形式的硫原子之间的化学键。虾类肌肉蛋白质中的巯基在冷藏或冷冻储存或冻融过程中容易氧化成二硫键[24]。从图6c可以看出,在0~120 d的贮藏时间段中,两组样品的二硫键含量一直处于上升趋势。0 d时虾仁的二硫键含量为0.03 mg/g,虾糜为0.05 mg/g。在0~80 d的时间段内,上升趋势平缓,在80 d的时候,虾仁组的含量为5.36 mg/g,而虾糜组只有5.28 mg/g;在80~120 d的时间段内,含量变化显著,在120 d的时候,虾仁组的含量为24.02 mg/g,而虾糜组为23.34 mg/g。这些结果与初始数据相比相差很大。Benjaku等[25]研究表明,肌氨酸分子的构象变化可能导致二硫键通过氧化增加,这与本实验数据的变化趋势相符。由实验图可知,在0~120 d的贮藏时间段中,两组样品的二硫键含量一直上升,但是虾糜组的数值一直低于虾仁组,所以在二硫键方面虾糜的贮藏效果比虾仁好。
3 结论
3.1 虾糜作为一种新的贮藏方式对虾类的保藏开启了一个新的发展方向。本实验从理化角度分析,与虾仁的贮藏方式相比较,虾糜的贮藏方式减缓了二硫键和疏水键的含量、pH值的上升趋势。同时这种贮藏方式也使得其在总巯基和活性巯基的含量、离子键的含量、总蛋白的含量以及Ca2+-ATPase活性方面比虾仁组更高。从上述各项指标表明,使用虾糜的贮藏方式比虾仁更优秀。本实验为今后对虾糜低温冻藏过程中品质变化和加工品的深加工提供了理论依据。
3.2 关于对虾的品质的探寻,还存在很多的研究方向。陶欢等[26]人认为虾品质的下降是因为在冻藏过程中蛋白质中的结合水形成冰晶析出导致肌动球蛋白分子之间相互形成非共价键,进而形成超大分子的不溶性凝集。陈诗妍等[27]人通过对虾中内源酶的活性测定研究,证明了内源酶会对虾肌原纤维蛋白的降解,从而影响虾的品质。这与本文的结论一致,从侧面证实了肌原纤维含量变化对虾的影响成正比。而目前虾类在对溶质的浓缩效益这一研究方向的文献较少,这也是之后实验中将研究的目标之一。
