高海拔地区颈动脉体瘤围术期颈动脉处理策略
——单中心经验
2021-01-15朱吉海杨佳马伟钟浩王永宏武建英
朱吉海,杨佳,马伟,钟浩,王永宏,武建英
(青海大学附属医院 心脏血管外科,青海 西宁 810001)
颈动脉体瘤(carotid body tumor,CBT)是一种临床上较为少见的化学感受器肿瘤,青海省地处青藏高原,笔者发现青海省CBT发病率明显高于平原地区。手术切除是目前CBT唯一有效的治疗手段。由于肿瘤生长位置特殊并血供丰富,手术风险大,并发症发生率高。且瘤体越大,手术操作难度越大,手术并发症发生率也越高。其中大出血是CBT手术最常见的并发症,而脑缺血性损伤是最严重的并发症。我中心在长期的CBT外科治疗过程中积累了一定的临床经验,并逐渐形成了一套规范的处理颈动脉的方法,本研究旨在总结分析我中心对于CBT患者围术期对颈动脉的处理方法与经验,从而更加有效地提高手术安全性,减少脑缺血性损伤、出血等并发症的发生。
1 资料与方法
1.1 一般资料
我中心2 0 1 0年1月—2 0 2 0年4月共收住C B T患者1 5 1 例,共计1 7 9 个瘤体,其中男2 6 例,女1 2 5 例;年龄3 2 ~7 1 岁,中位年龄4 8.5 岁;瘤体位于左侧60例,右侧63例,双侧28例;Shamblin分型:I型55例,II型91例,III型33例。瘤体最大径0.9~6.8 cm,平均(3.9± 2.6)cm。病史2~95个月,患者中97例长期生活于海拔高于3 000 m地区。
1.2 颈动脉的处理
1.2.1 术前所有患者行头颈部动脉CT 明确肿瘤大小、分型,瘤体与周围组织的关系,颅底动脉环发育情况等(图1);通过超声、颈动脉MRI黑血技术明确患侧颈总、颈内动脉内膜有无斑块,并判断斑块的性质。术前均常规行颈动脉压迫试验(Matas 试验)。Shamblin 分型I 型患者Matas试验耐受时间10 min 以上即考虑手术;II 型和III 型患者Matas 试验耐受时间大于20 min 时考虑手术。17 例Shamblin III 型患者术前行患侧颈动脉造影(图2),其中2 例造影发现粗大滋养动脉,术中行瘤体滋养动脉栓塞,当日或次日行外科手术。

图1 颈动脉体瘤CT 水平位及矢状位图像
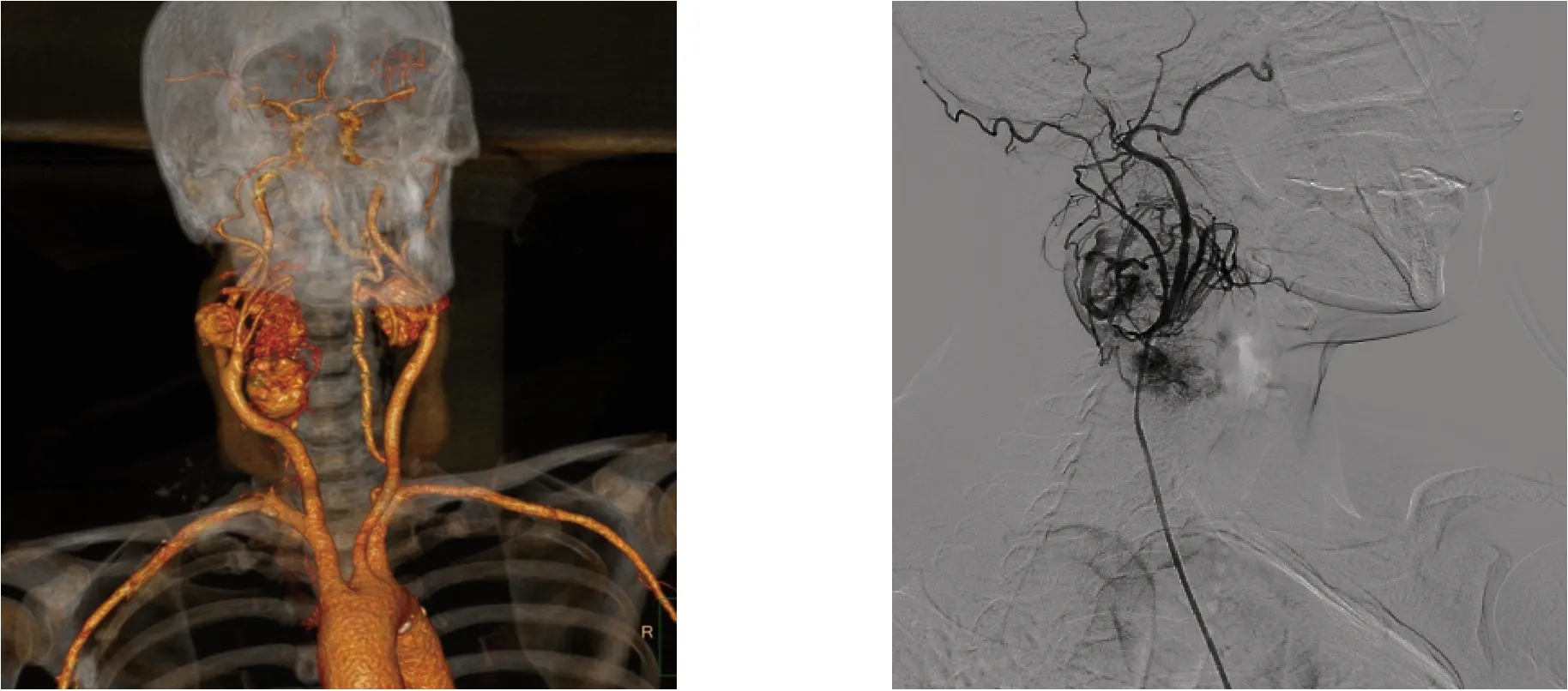
图2 颈动脉体瘤CT 三维重建图像及造影图像
1.2.2 术中11 例Shamblin III 型、瘤体最大径超过6 cm 者,术前常规进行Matas 试验,在决定实施瘤体切除术时先在局麻下游离患侧颈总动脉,肝素化后阻断患侧颈总动脉,记录耐受时间(图3),并持续监测脑氧饱。10 例耐受时间大于20 min,脑氧饱较阻断前下降小于10%,改为全麻下颈动脉体瘤切除术;1 例阻断5 min 后出现明显头晕、血压升高等变化,放弃手术。

图3 术中局麻下颈总动脉阻断
手术时先于瘤体近心端游离颈总动脉并套带,自颈总动脉近心端开始,沿颈动脉纵轴用血管钳沿Gordon-Taylor平面逐渐向上分离颈动脉与瘤体,边分离边结扎。向上分离颈外动脉近端,使颈总动脉及颈外动脉近端与瘤体完全分离,再分离颈外动脉远端与瘤体;同法将颈内动脉与瘤体分离。然后锐性分离瘤体与颈动脉分叉处,最后分离瘤体上极,将瘤体完整切除(图4)。

图4 术中照片 A:瘤体切除前;B:瘤体切除后
1.2.3 术后根据术中对颈动脉的处理情况,若术中行颈动脉修补、成型、重建、血管置换等,早期进行抗血小板等治疗;密切观察,若有脑血管并发症,做到早发现、早处理。
2 结果
2.1 手术方式
1 5 1 例C B T 患者共1 7 9 个瘤体,其中2 例患者术中发现瘤体与周围组织浸润生长,考虑恶变,放弃手术;1 例患者因术前行颈动脉切开阻断试验无法耐受,放弃手术,以上3 例均为Shamblin III型。其余176例次均成功切除瘤体,手术切除率98.3%。手术时间 47~184 min,平均(86±98)min;术中出血量45~1 800 mL,平均(195±125)mL。出血超过800 mL认为大出血,本组2例出血量分别约为1 200、1 800 mL。
2.2 术中颈动脉处理情况
行颈外动脉切断缝闭或结扎2例,颈外动脉切断、重建术2例;颈动脉分叉破裂修补14例;颈动脉分叉切除、颈内动脉重建1例(图5)。

图5 颈外动脉切断后重建,颈外动脉切断缝闭
2.3 术后脑血管并发症发生情况
全组无术中死亡;术后发生不同程度脑梗塞共7例,其中6例发生于2014年以前,2例因大面积脑梗死亡,4例经治疗不同程度康复;2014年后仅发生1例轻微脑梗塞,经治疗完全康复。
2.4 术后随访情况
95例患者得到随访,随访率62.9%,随访时间2 ~8 6 个月。2 例患者出现肿瘤转移,其中1 例Shamblin分型为II型,术后14个月出现广泛肺转移,经活检证实为CBT转移;1例Shamblin分型为III型,术后8个月出现骨、脑转移,经活检证实为CBT转移。其余患者均未发现肿瘤复发、转移。
3 讨论
目前对于C B T 发病原因尚不完全清楚。研究[1-2]发现,较多刺激均能引起颈动脉体功能或形态发生变化,对低氧刺激尤为敏感。长期或持续慢性低氧刺激导致颈动脉体结构和功能发生颈动脉体球细胞、支持细胞等实质细胞增生、体积增大、血管增生等一系列变化。Kusakabe等[3]发现长时间的低氧刺激可使小鼠颈动脉体体积增大、血管增生。长期居住于高海拔地区使机体长期处于慢性低氧状态,进而引起颈动脉体代偿性增生和肥大,最终形成CBT[2,4]。此外,研究[5]发现CBT有一定的家族性遗传倾向,是一种外显率与年龄相关的常染色体疾病。约35%的CBT患者有氧敏感基因突变。有家族史者多为双侧发病[6]。如果合并基因突变,再加上长期慢性低氧刺激,CBT发病率明显提高,且发病年龄将更加提前[2]。
CBT总体发病率较低,任何年龄均可发病,5 0 岁左右明显。女性较男性好发,大部分报道男:女约为1:2~3。国内汪忠镐等[7-11]的报道例数相对较多,但大宗报道较少。高海拔地区的人群由于持续慢性低氧,发生CBT的可能性是平原地区人群的10倍。青海省平均海拔3 000米以上,大部分地区大气氧气稀薄,居住环境恶劣,长期低氧刺激使CBT发生的可能较平原地区明显增加。本组女性患者远远多于男性患者,男:女约1:4.8,与国内报道差异较大,推测是由于外界环境因素造成的长期慢性低氧刺激更容易促使女性颈动脉体肥大、增生,其具体机制有待进一步探究。
目前对于C B T 的良恶性鉴别尚无统一有效的方法。比较公认的为“肾上腺嗜铬细胞瘤和副神经节瘤分级系统(the grading system for adrenal phaeochromocytoma and paraganglioma,GAPP)”[12-13]。GAPP提供了转移风险和患者生存率的逐步评估,且认为评分越高,肿瘤分化程度越低,其恶变潜能随之增加,患者预后越差[14-15]。K o h 等[13]研究表明G A P P 对于患者预后具有可靠的预测意义,并认为G A P P 联合S D H B 片段是否缺失,能进一步提高预测的准确性。本组有2 例患者术后发生肿瘤转移,其中1例Shamblin分型为II型,1例为III型,提示肿瘤的良恶性可能与Shamblin分型没有明确的关系。
由于CBT生长位置特殊,瘤体血供丰富,瘤体往往与周围组织粘连紧密,术中出血多,切除难度大,术后并发症多[16]。其中脑缺血性损伤是CBT切除术最严重的并发症,文献[17]报道其发生率为7%左右。术中长时间阻断颈总或颈内动脉,颅底动脉环发育差或侧支循环开放不完善;术中牵拉或钳夹动脉使斑块碎裂脱落造成远端动脉栓塞;动脉重建或吻合口血栓形成;术中转流管内血栓形成等因素都是脑缺血性损伤发生的原因。本组151例CBT患者共179个瘤体。其中6例发生于2014年以前,2例因大面积脑梗死亡,4例经治疗不同程度康复。2014年以后仅发生1例轻微脑梗塞,经治疗完全康复,这可能得益于笔者在长期的临床实践过程中逐渐形成了一套规范的个体化的处理颈动脉的方法。
术前通过头颈部动脉C T 明确肿瘤大小、分型,瘤体与周围组织的关系,颅底动脉环发育情况等;经超声、颈动脉MRI黑血技术等检查手段明确患侧颈动脉内膜有无斑块,并判断斑块的性质。常规进行Matas试验。对于Shamblin分型I型及部分II型患者,由于瘤体小,术中即便损伤颈动脉也可在短时间内完成修补,此类患者Matas试验耐受10 min左右即可。部分瘤体较大的II型和III型患者,Matas试验耐受时间要求大于20 min。对于部分Shamblin III型、瘤体体积大、与周围组织分界不清,距颅底较近者,术前常规行患侧颈动脉造影,进一步明确瘤体血供,若造影发现粗大滋养动脉,行瘤体滋养动脉栓塞,当日或次日行外科手术,可明显减少术中出血。张建彬等[18]也认为超选择动脉栓塞后手术切除颈动脉体瘤可明显减少术中出血。虽然Matas试验常规用于颈动脉体瘤术前准备,实施时需要他人协助压迫患者颈动脉,通常以远端动脉搏动消失认为阻断有效,由于非医务人员对颈动脉解剖不熟悉,压迫过程中患者的体位变动,长时间按压容易导致压迫者手指僵硬、力量减弱等因素,无法保证颈动脉被持续、完全阻断,也无法有效评估颈动脉阻断后脑血流能否代偿;并且由于需要较大的力量压迫颈部,部分患者可能会有明显的局部疼痛、压迫感及恶心等不适,从而无法耐受。因此对于部分Shamblin III型瘤体较大的患者,术前预测颈动脉损伤可能性大者,以及无法耐受Matas试验的患者,在决定实施瘤体切除术时先在局麻下游离患侧颈总动脉,肝素化后阻断患侧颈总动脉,密切观察患者血压、心率等变化,随时与患者沟通,了解其有无脑缺血症状,并通过语言交流判断有无短暂认知障碍,记录颈动脉阻断耐受时间。同时,通过持续监测患者经皮脑氧饱,能更加直观的观察脑部供血变化情况。对于Shamblin III型瘤体较大者如果耐受时间大于20 min,Shamblin分型为II型者耐受时间大于10 min,则改为全麻下颈动脉体瘤切除术;若颈动脉阻断后无法耐受,出现明显的脑缺血症状,则暂缓手术。该方法较Matas试验体外阻断颈总动脉更为确切。此外,有学者[19-20]报道经超声或CT引导经皮穿刺瘤体,采用乙烯基乙烯乙醇聚合物等液体栓塞剂进行栓塞可有效减少术中出血的发生。Ong等[21]报道术前在颈总动脉及颈内动脉植入覆膜支架,可明显减少术中出血,如果血管损伤无需重建,减少了脑部缺血性并发症的发生。
手术时对颈动脉的处理尤为关键。笔者分离颈动脉与瘤体的顺序一般为颈总动脉近心端—颈外动脉—颈内动脉—颈动脉分叉。沿颈动脉纵轴用血管钳沿Gordon-Taylor平面边分离边结扎,瘤体侧结扎可收紧瘤体外膜,减少瘤体出血。CBT的滋养动脉多发自颈外动脉,故分离颈外动脉尤其颈外动脉近端时往往出血较多,需谨慎操作。颈内动脉一般无侧支发出,分离时出血一般较少。对于颈总动脉及颈内动脉有斑块尤其是不稳定斑块者,术中尽量避免对动脉的牵拉,如需牵拉瘤体,则尽量以颈总及颈内动脉为轴线牵拉,以免动脉斑块脱落导致脑梗塞。颈动脉分叉处及颈内、外动脉起始部往往是瘤体与动脉粘连最为紧密的地方,也有少数患者瘤体滋养动脉发自颈动脉分叉处,如有不慎,很容易造成分叉处动脉破裂。因此,此处操作应更加谨慎。我们的经验是将瘤体牵向后上方,用剪刀锐性分离瘤体与颈动脉分叉处,如有细小的滋养动脉,可结扎或缝闭。瘤体上极最后分离,此时由于瘤体滋养动脉已被处理,瘤体血供明显减少,瘤体张力减低,体积较前缩小,处理相对简单。术中如需阻断颈动脉,阻断前全身肝素化并相应提高全身血压,增加脑灌注,妥善处理动脉成型或吻合口,避免吻合口狭窄、扭曲。此外,由于一些体积较大的瘤体由于长时间的压迫效应,导致颈动脉尤其颈内动脉冗长、迂曲,应注意避免术后颈内动脉扭曲、成角;同时,术中仔细止血,避免血肿形成、颈动脉受压;若术中行颈动脉修补、成型、重建或血管置换等,术后早期进行抗血小板等治疗措施,也是至关重要的。若瘤体与动脉紧密粘连,可选择性切断颈外动脉,这样能获得更好的术野暴露,并能减少术中出血;待瘤体切除后根据情况行颈外动脉重建或直接结扎或缝闭颈外动脉断端。有文献报道术中使用超声刀、双极电刀等能有效减少术中出血,但本组所有患者均使用止血钳分离瘤体,术中平均出血量(1 9 5±1 2 5)m L。对于瘤体巨大、瘤体与颈动脉粘连紧密者,文献[22-25]报道术中应用颈动脉转流管、使用自体大隐静脉或人工血管行颈内动脉转流术、甚至行颈内动脉结扎术。本组术中行颈外动脉切断结扎2例,颈外动脉切断重建2例;颈动脉分叉破裂修补14例;颈动脉分叉切除、颈内动脉重建1例。术中均未使用转流管,未实施颈内动脉搭桥术。
综上,围术期通过妥善处理颈动脉,可有效降低CBT切除术脑缺血性损伤的发生,减少术中出血,提高手术的安全性。但目前对于CBT确切发病原因尚不完全明确,对于CBT良恶性判断仍缺乏统一的标准,并且对于恶性病变、术后复发或远处转移者,也缺乏有效的治疗手段,以上均需要进一步探讨。
