基于重水拉曼技术的氯己定对白色念珠菌抑菌效能的研究
2021-01-13李帆张利娟谭凯璇张颖卢洁李姗姗杨芳
李帆 张利娟 谭凯璇 张颖 卢洁 李姗姗 杨芳
1.青岛大学口腔医学院 青岛266003;2.青岛市市立医院口腔医学中心 青岛266071;3.大连医科大学口腔医学院 大连116044
氯己定(chlorhexidine,CHX)具有相当强的广谱抑菌、杀菌效果,对革兰阳性菌、革兰阴性菌以及真菌均有效[1]。CHX 作为漱口水和根管冲洗液的添加成分,其效果较为确切[2]。临床常用CHX 的药物质量分数为0.12%~2%。白色念珠菌,是口腔中最常分离到的条件致病真菌之一[3],是口腔真菌感染中最常见的真菌种类[4],也是持续性根管感染、难治性根尖周炎及根管治疗失败患者最常分离到的真菌种类[5]。
最低抑菌浓度(minimum inhibitory concentra‑tion,MIC)是定量评价药物抑菌效能的金标准和重要指标[6],但在该浓度下,微生物生长虽受到抑制,细胞代谢的抑制情况却不清楚。重水标记的单细胞拉曼显微光谱技术,是重水标记技术和拉曼技术的结合。重水可以使有代谢活性微生物的拉曼图谱中特定区域(2 040~2 300 cm‑1)出现重水峰(C‑D 峰),基于ΔC‑D ratio [(当前时间与0 h 的C‑D ratio(重水峰所占比例)差值]测定的最小代谢活性抑制浓度(minimum inhibitory con‑centration based on metabolic activity,MIC‑MA)[7‑8]能定量评价药物对微生物实时代谢活性的影响[8]。该技术已普遍应用于微生物种类鉴别的研究[7],也曾广泛用于评价药物对细菌代谢活性的影响[8],但有关药物对真菌代谢活性影响的相关文献及研究还非常少见。
系统了解CHX 对白色念珠菌生长及代谢活性的影响有利于全面了解白色念珠菌的药敏性,指导临床合理使用药物,减少耐药菌株的产生及疾病反复感染和治疗失败的发生概率。本研究采用肉汤稀释法和重水拉曼技术,研究重水对白色念珠菌生长的影响及该菌对重水的吸收规律,以评价重水拉曼技术的普适性;同时测定CHX 对白色念珠菌的MIC 和MIC‑MA,评价CHX 对白色念珠菌生长及代谢的抑制效果。
1 材料和方法
1.1 实验材料与菌株培养
实验材料:实验用标准菌株白色念珠菌CICC32380 购自中国医学菌种保藏中心;SDA 固体培养基,以蛋白胨10 g、琼脂20 g、葡萄糖40 g加蒸馏水定容至1 L,115 ℃下高温灭菌20 min,趁热倒入培养皿,凝固后备用;RPMI1640培养基用无菌双蒸水溶解,每1 L 加入2 g NaHCO3,用HCl 和NaOH 溶液调节pH 为7.0,过膜滤菌,备用;质量分数19%~21%CHX,购自青岛汉爵生物技术有限公司。
实验菌株的培养:将白色念珠菌CICC32380划线接种到YPD 固体培养基,37 ℃条件下恒温培养24 h,取白色念珠菌菌落,转种到RPMI1640液体培养基中,37 ℃、200 r·min‑1摇床中培养12 h,备用。
1.2 重水拉曼技术普适性评价
1.2.1 重水环境对白色念珠菌生长的影响 与其他同位素标记物相比,重水价格便宜,对微生物干扰小[7];但也有研究[9‑10]表明,重水可能抑制细胞的活动,本实验在重水环境中培养白色念珠菌,观察对其生长的影响。将实验菌株接种于含不同质量分数(0%、10%、20%、30%、40%、50%)重水的培养基中(0%为对照组)培养9 h,利用分光光度计(上海屹谱仪器制造有限公司)测定白色念珠菌吸光度值OD600随时间的变化,检测不同质量分数重水对其生长的影响。
1.2.2 白色念珠菌对重水的吸收规律 另取上述接种于不同质量分数重水中的实验菌株培养12 h,于不同时间点(0、1、2、3、4、6、8、12 h)分别取样进行拉曼技术检测,以评价该菌株对重水的吸收规律。
1.3 采用肉汤稀释法测定CHX 对白色念珠菌的MIC
取YPD 固体培养基上生长24 h 的菌落,置于5 mL 无菌水中,涡旋15 s;调整菌密度至0.5麦氏标准,稀释1 000 倍,最终菌密度为每毫升1 000~5 000 个细胞。实验设置空白对照组:只含培养基,以排除培养基污染的可能性;阴性对照组:含有培养基+实验菌,以证明实验菌株可以在培养基中生长良好;实验组:含有培养基+实验菌+不同质量分数的CHX。实验组中,通过调整培养基和CHX 配比,使CHX 的质量分数最终为32、16、8、4、2、1 μg·mL‑1。37 ℃温度下培育24 h,利用分光光度计分别测量0 h 和24 h 的OD600值,计算ΔOD600(0 h 和24 h 的OD600吸光度值的差值),ΔOD600≤0.05对应的最低药物浓度,即CHX对白色念珠菌的MIC[11]。
1.4 采用重水拉曼技术测定CHX 对白色念珠菌的MIC‑MA
将实验菌株接种至含0、2、4、8、12 μg·mL‑1CHX的RPMI1640培养基(含30%重水)中,37 ℃培养8 h,按时间梯度取样,每个时间点取0.2µL测量样品点在CaF2玻片上,风干。利用LabRam HR 型的改良后共聚焦拉曼荧光显微镜(Shelab 公司,美国)采集拉曼图谱(参数设定如下:激光源为532 nm 的Nd:YAG 激光,样品上激光强度为50 mW,照射时间1 s,分光光栅300 grooves·mm‑1,拉曼图谱范围400~3 500 cm‑1),在不同视野中随机采集30~50 个细胞的拉曼图谱。图谱经过减背景、基线归一化和最大值标准化处理,即可计算出C‑D ratio值。计算ΔC‑D ratio(培养8 h与0 h的C‑D ratio 差值),当ΔC‑D ratio≤0 且标准差<0.005即为CHX对白色念珠菌的MIC‑MA[8]。
1.5 统计学分析
本实验中定量实验数据采用“均数±标准差”表示。采用SPSS 17.0 软件进行统计学分析,统计方法采用T检验,检验水准为双侧α=0.05。
2 结果
2.1 重水拉曼技术普适性评价
2.1.1 重水环境对白色念珠菌生长的影响 白色念珠菌在含不同质量分数重水环境下的生长状态见图1。生理状态下,白色念珠菌的生长过程包括延迟期(0~2 h)、对数期(2~8 h)、稳定期(8~9 h);与对照组相比,白色念珠菌在10%~30%重水中生长没有受到明显抑制(P>0.05);在40%~50%重水中,生长则受到明显抑制(P<0.05)。该结果提示,白色念珠菌能够耐受30%的重水,重水的毒性并不是本实验的限制性因素。
2.1.2 白色念珠菌对重水的吸收规律 白色念珠菌在含不同质量分数重水环境中培养12 h,在不同时间点进行拉曼检测的结果见图2 和图3。与对照组相比,10%重水环境下,即出现C‑D 峰(图2);且C‑D ratio 与重水质量分数成正相关关系(R2=0.989 4,P<0.05;图3)。该结果表明,实验菌株能活跃代谢重水并通过拉曼图谱检测到,因此本研究选择不影响实验菌株生长又能产生明显C‑D 峰的重水质量分数,即30%重水作为后续实验的默认重水质量分数。

图1 白色念珠菌CICC32380在含不同质量分数重水中OD600随时间的变化Fig 1 Temporal change of OD600 for Candida albicans CICC32380 under various quality score D2O
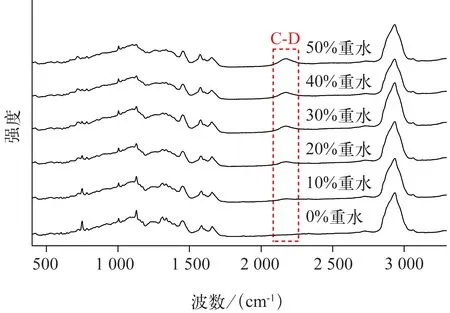
图2 含不同质量分数重水环境下白色念珠菌CICC32380 的单细胞拉曼图谱变化Fig 2 Change of single cell Raman spectrum for Candida albicans CICC32380 under various quality score D2O
白色念珠菌在30%重水环境中,其C‑D ratio及OD600随时间的变化趋势见图4和图5。C‑D峰在加入重水后迅速出现并快速升高,1 h 即有统计学差异(P<0.001),而吸光度值OD600在2 h 才发生明显升高,其变化晚于C‑D ratio变化曲线至少1 h。基于上述实验结果可见,拉曼图谱技术用于评价药物对真菌代谢活性的影响时,敏感性更高且省时。
2.2 CHX对白色念珠菌的MIC测定结果
不同质量分数CHX 对白色念珠菌的MIC 测定结果见表1,ΔOD600≤0.05 对应的最低药物浓度,即CHX 对白色念珠菌的MIC。空白对照组在培养0 h 与24 h 的吸光度差值(ΔOD600)未发生明显变化,可以排除培养基污染的可能。阴性对照组OD600的变化明显,表明实验菌株活力良好。CHX质量浓度分别为1、2μg·mL‑1时,ΔOD600>0.05;而当CHX 质量浓度为4、8、16、32μg·mL‑1时,ΔOD600≤0.05。由此可见,CHX 对白色念珠菌的MIC为4 μg·mL‑1。
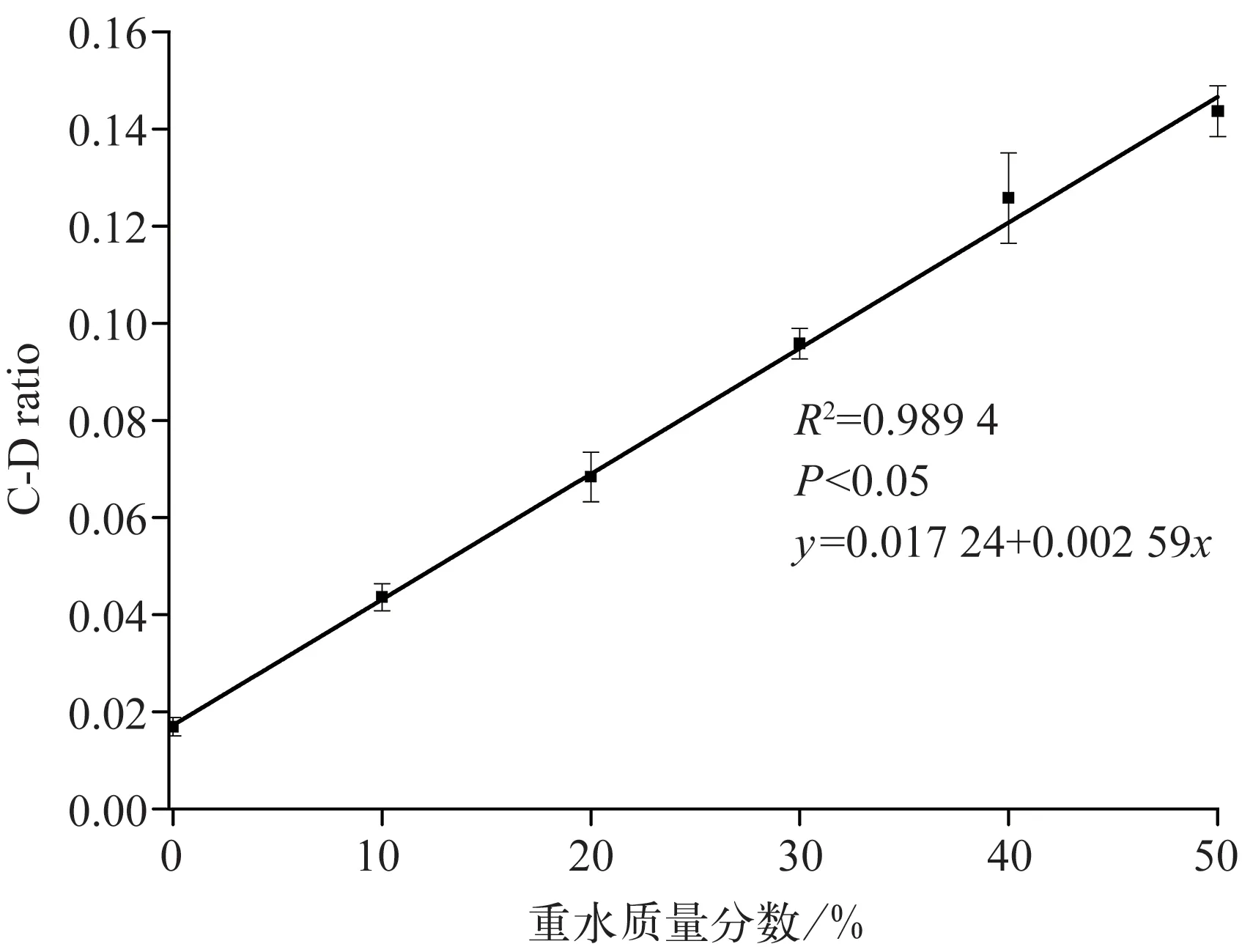
图3 稳定期白色念珠菌CICC32380 单细胞拉曼图谱中C‑D ratio与重水质量分数之间呈线性关系Fig 3 There was a linear relationship between the C‑D ratio of Candida albicans CICC32380 at stable stage and D2O concentra‑tion followed by single cell Raman spectrum measurement

图4 30%重水环境下白色念珠菌CICC32380 随时间变化的单细胞拉曼图谱Fig 4 Temporal change of single cell Raman spectrum for Candida albicans CICC32380 under 30%D2O
2.3 CHX对白色念珠菌MIC‑MA的测定
CHX 对白色念珠菌的MIC‑MA 测定结果见表2 和图6。与阴性对照组相比,CHX 在0.5×MIC(2 μg·mL‑1)及MIC(4 μg·mL‑1)时,ΔC‑D‑ratio>0且未见明显降低(P>0.05);在2×MIC 及3×MIC(8 μg·mL‑1及12 μg·mL‑1)时,ΔC‑D‑ratio<0 且标准差<0.005,ΔC‑D ratio 值明显降低(P<0.001)。由此可见,CHX 对白色念珠菌的MIC‑MA 为8 μg·mL‑1,即2×MIC。当CHX≤4 μg·mL‑1,C‑D ratio 随时间的变化趋势与阴性对照组无明显差异(P>0.05),而CHX>4 μg·mL‑1,C‑D ratio 在8 h 内甚至24 h 内均维持在基线水平(图7),说明该质量浓度下,药物作用发挥迅速,实验菌株的代谢活动瞬时即可受到完全的抑制,并在一定时间内未见恢复代谢活性。

图5 30%重水环境下白色念珠菌CICC32380 C‑D ratio 曲线和生长曲线随时间的变化Fig 5 Temporal change of C‑D ratio curve and growth curve of Candida albicans CICC32380 under 30%D2O

表1 CHX对白色念珠菌CICC32380的MIC测定结果Tab 1 Measurement of MIC for Candida albicans CICC32380 under CHX
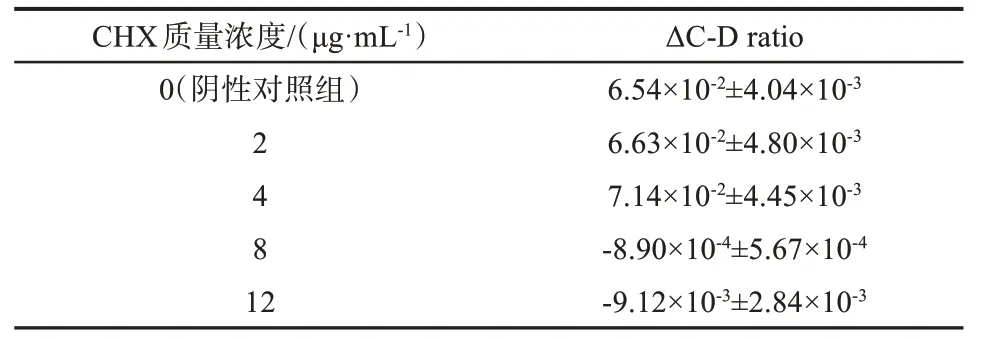
表2 CHX对白色念珠菌CICC32380的MIC-MA测定结果Tab 2 Measurement of MIC-MA for Candida albicans CICC32380 under CHX
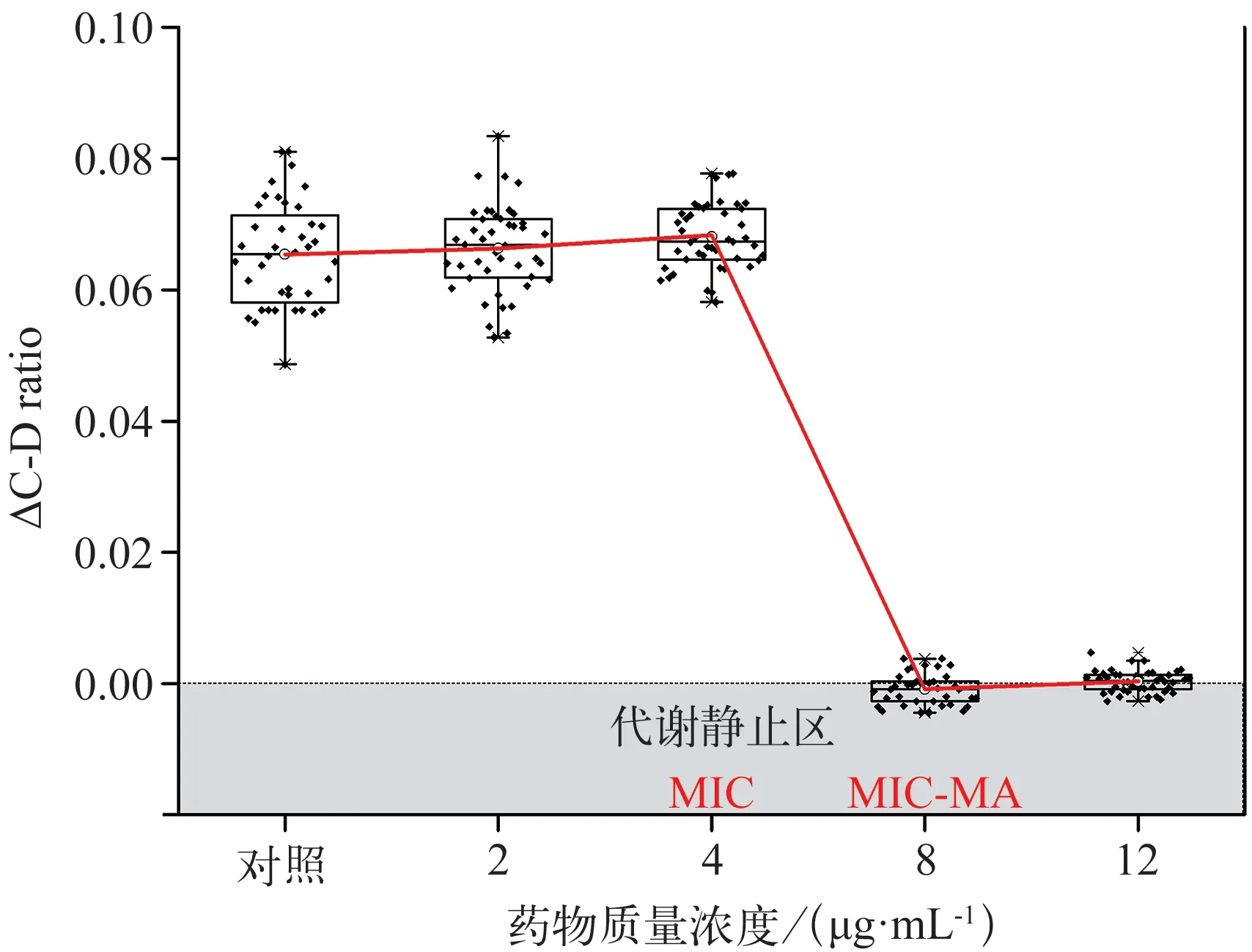
图6 CHX对白色念珠菌CICC32380的MIC‑MA测量Fig 6 Measurement of MIC‑MA under CHX for Candida albicans CICC32380
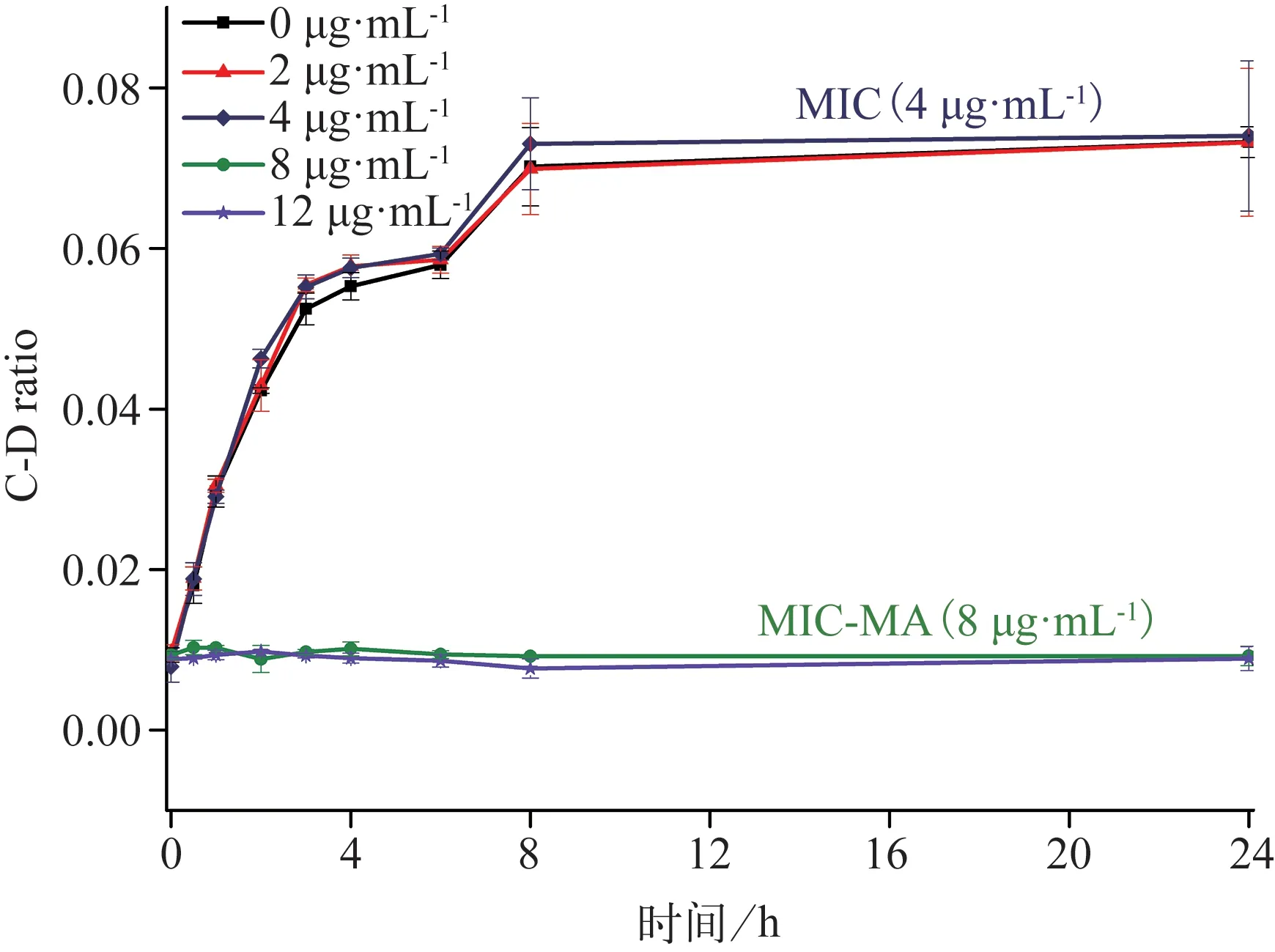
图7 C‑D ratio在不同质量浓度CHX作用下的时间曲线Fig 7 Temporal dynamics of the C‑D ratio under various quality score CHX
3 讨论
本研究确定了CHX 对白色念珠菌的MIC 及MIC‑MA,通过探讨CHX 对微生物生长及代谢的影响,系统地评价了CHX 对白色念珠菌的抑菌效能;同时,本研究建立了药物对真菌代谢活性的作用模型,为后期评价口腔常见药物对微生物抑菌效能研究提供了参考依据。
CHX 对白色念珠菌生长的抑制效果已有诸多报道[12‑13]。Ferguson等[12]报道,CHX 对白色念珠菌的MIC<0.63 μg·mL‑1;Estrela等[13]则 发 现MIC 为0.2 μg·mL‑1。本实验探索的MIC 与以往报道有所差别,分析原因可能是在实验菌株培养过程中产生的亚种、培养基组成、仪器设备及实验者操作等多种差异造成的。
在以往的研究中,评价药物对微生物的抑菌效能均是基于肉汤稀释法,参考MIC 指标仅考虑其对微生物生长的抑制效能,耗时且不能评价不生长但有代谢活性(nongrowing but metabolically active,NGMA)细胞[14]的抑菌效能。本实验显示,菌株在MIC 下生长受到抑制,但仍具有很高的代谢活性,与前期相关研究[8]中CHX 对变异链球菌、血链球菌、发酵乳杆菌等细菌代谢活性影响的研究结果相似。在基于重水拉曼技术的MIC‑MA 下,白色念珠菌的生长不仅受到完全抑制,代谢活性也瞬时受到完全抑制,并且在一定时间内,未见代谢活性的恢复。本研究通过重水拉曼技术发现了真菌的NGMA 细胞,此种细胞可能是疾病反复感染甚至治疗失败的重要原因[15]。
以往多采用二甲氧唑磺比色法检测细胞代谢活性,然而该方法存在溶液的不稳定性、培养体系中过氧化物及某些代谢产物影响结果准确性等因素,从而限制了该方法的应用[16]。重水标记的单细胞拉曼显微光谱技术,能够在不改变细胞组分、不依赖细胞培养的基础上,减少对细胞的损伤及人为干扰因素,达到在单细胞的水平快速、定量、无损地评价药物对微生物实时代谢活性的影响[7‑8,17]。同时,通过该技术测得的拉曼图谱包含的信息相当丰富,可以反映出物质的生化及结构特性,理论上能够覆盖细胞内所有物质的图谱,特别是600~1 800 cm‑1范围的“指纹区”[18],可以区分细胞类型、探讨微生物应激机制等,具有相当广阔的应用前景及重要的指导意义。
CHX 是一种带正电荷的亲水亲脂分子,可与带负电荷的细菌细胞壁之间的静电相结合,导致胞内蛋白的沉淀和凝固,同时也可导致细胞膜的完整性发生改变,使低相对分子质量的胞内成分发生渗漏,影响细胞的生长及代谢活动。CHX 作为口腔常用药物,具有低细胞毒性的特点;但CHX 在使用过程中仍可能导致过敏反应,舌、义齿、牙齿着色以及味觉改变等不良反应,其发生概率随质量浓度的增高而增大[19]。本研究发现,CHX 对白色念珠菌的MIC 和MIC‑MA,远低于临床常用浓度(0.12%~2%,即1.2~20 g·L‑1)。该结果提示,尽管在临床使用过程中,CHX 可能被稀释,但对白色念珠菌的生长及代谢仍具有很好的抑制作用,甚至稀释近千倍仍然具有良好的效果。
本研究采用重水标记的单细胞拉曼显微光谱技术探讨真菌药敏性和CHX 对白色念珠菌代谢的影响,技术手段先进。本实验建立了药物对真菌代谢活性影响的模型,为后期评价口腔常见药物对微生物抑菌效能的研究提供了参考,可以指导临床快速筛选药物,达到尽快筛选出高效低毒、安全有效且不易产生耐药菌的目的。
利益冲突声明:作者声明本文无利益冲突。
