钝叶酢浆草的离体培养与快速繁育研究
2021-01-08邱凯男宋婷婷
邱凯男,张 杰,宋婷婷
(北京农学院植物科学技术学院/农业应用新技术北京市重点实验室,北京 102206)
钝叶酢浆草(Oxalisobtusa)属于酢浆草科酢浆草属,广布于非洲纳米比亚的纳马夸兰区和克尼斯纳区,生长在砂土或黏土中,株高10~35 cm,全株被有疏柔毛,茎短缩,叶基生,莲座状,掌状复叶,3小叶,倒心形,小叶无柄,形状大小略有不同。花单生,颜色丰富,在不同的光照条件和温度下有不同的花色,是秋季、冬季、早春不可多得的中小型花卉[1-2]。
钝叶酢浆草具有独特的叶形花色,可盆栽种植[3],作为年宵花供应市场。盆栽可摆放于广场、花坛、花台或布置岩石园,钝叶酢浆草是中国南方全部生育期可以在露地栽培的地被[4],生长迅速,覆盖力强[5]。如今,钝叶酢浆草已经走进各个园艺爱好者的视野并受到追捧[6],目前只在网络电商中出售种球和盆栽,鳞茎按照规格不同从2~50元不等,盆栽根据品种从15~100元不等,部分新品种能卖出数百元的价格。繁育困难,供不应求,是其市场价格走高的主要因素。
目前仅有少量酢浆草专类玩家培育部分种内杂交品种[7],而对其相关研究少之又少。现今,对于酢浆草属组织培养的研究大部分集中在紫叶酢浆草(Oxalistriangularis)上[7-15],另有研究者研究熔岩酢浆草(Oxalisspiralissubsp.vulcanicola)的组培快繁技术[16],还有部分研究者研究山酢浆草(Oxalisacetosella)的组织培养体系[17];对于钝叶酢浆草的研究仅仅停留在种群鉴别上。研究者发现不同产地的钝叶酢浆草间存在生殖隔离[18-19],解释钝叶酢浆草杂交苗培育的困难。而对于钝叶酢浆草的组织培养仍没有研究者涉足。
园艺师为了创造更多花色的品种,会对钝叶酢浆草进行杂交,但钝叶酢浆草为异形花柱[2],不易结实,部分品种存在生殖隔离[19],种子是顽拗性种子,不耐失水,杂交种子采收后要立即播种,发芽率低,发芽不整齐[2],在中国部分播种苗无法形成鳞茎直接枯萎死亡。生产中钝叶酢浆草通常使用鳞茎繁殖。可是钝叶酢浆草收获的鳞茎尺寸不均,不便标准化生产,储藏时易失水死亡。以上问题是钝叶酢浆草批量生产和工厂化育苗的瓶颈。
为了建立钝叶酢浆草通用性强,生长繁殖速度快的组织培养体系,该试验以杂交钝叶酢浆草的叶片和茎尖为外植体,在含有不同质量浓度激素的培养基上进行组培研究。旨在获得钝叶酢浆草的完整繁殖体系,提高其种苗质量,为钝叶酢浆草的深入研究提供技术参考。
1 材料与方法
1.1 材 料
选取购买于北京四环花木中心的钝叶酢浆草‘锂辉石’(Oxalisobtuse‘Kunzite’)、钝叶酢浆草‘芬达’(Oxalisobtusa‘Fanta’)、钝叶酢浆草‘大花’(Oxalisobtuse‘large form’)长势相近、发育正常的植株茎尖和叶片为试验材料。材料放置于北京农学院实验楼组培室内培养,环境条件设置:光照14 h/d,光照强度2 000 lx,温度25 ℃±2 ℃,湿度50%~55%左右。
1.2 材料处理
选择盛花期、无病虫害的钝叶酢浆草植株的叶片和茎尖为繁殖材料。将选取的茎尖和叶片用2%表面活性剂溶液浸泡2 min,流水冲洗40~60 min,75%酒精处理15 s。将叶片分为3组,分别用2%NaClO溶液浸泡5、10和15 min,无菌水冲洗2次,叶片切成大小0.5 cm2左右,茎尖切成大小0.5 cm,备用。
1.3 启动培养
试验以MS培养基为基本培养基,在萘乙酸(NAA)质量浓度保持不变的情况下,每增加0.5 mg/L 6-苄氨基腺嘌呤(6-BA)的质量浓度设置一组培养基,设置6个试验组(表1)。将经过消毒处理的叶片接种到6组培养基中,每个培养基接种9片叶,设置5次重复。将经过消毒处理的茎尖接种到6组培养基中,每个培养基接种6段茎尖,设置5次重复。将完成接种的培养基放入组培室内暗培养,28 d后转为光培养。每隔7 d观察记录外植体、愈伤组织的生长状态及出愈率,选出最佳外植体、启动培养基和消毒时间。

表1 不同质量浓度激素的钝叶酢浆草初代培养基的配制Tab.1 Preparation of Oxalis obtusa primary medium with different hormone concentrations
1.4 继代培养
试验设置NAA质量浓度为0.1 mg/L和0.2 mg/L两大组,每一大组内设置6-BA 1.0、1.5和2.0 mg/L 3组,共计6组(表2)。经过初代培养的外植体长出芽后,将其分别接种到6组继代培养基上,每个培养瓶接种5个芽,设置5次重复,在继代培养基进行培养。每隔7 d观察记录芽的生长情况,选出最佳继代培养基,待芽生长到一定规格后移入生根培养基中。

表2 不同质量浓度激素的钝叶酢浆草继代培养基的配制Tab.2 Preparation of Oxalis obtusa subculture medium with different concentrations of hormones
1.5 生根培养
试验以1/2 MS培养基为基本培养基,设置6-BA质量浓度为0 mg/L和0.5 mg/L两大组,每一大组内设置NAA 0.05、0.10和0.15 mg/L,共计6组(表3)。将生长达到5 cm的芽移入6组生根培养基中,每个培养皿接种5个芽,设置5次重复,观察植株变化情况,待根系生长至一定长度后进行炼苗。

表3 不同质量浓度激素的钝叶酢浆草生根培养基的配制Tab.3 Preparation of root medium Oxalis obtusa with different concentrations of hormones
1.6 炼苗与移栽
组培苗根系长度达到5 cm以上,打开培养瓶进行炼苗。首先在温室内半阴处轻轻旋松瓶盖2 d,保证培养瓶内外的气体交换,然后完全开盖2 d,在自然光下开瓶炼苗3 d。最后将泥炭、珍珠岩和蛭石按照2∶1∶1比例混合作为基质,种植组培苗,并逐步转入日常管理。
2 结果与分析
2.1 最适消毒时间的选择
将3种钝叶酢浆草的外植体暗培养28 d后,统计最适消毒时间,见表4和图1及图2。‘大花’钝叶酢浆草叶片是3个品种中表现最好的,其余两个品种存活率低不做统计。用75%酒精和2%NaClO溶液浸泡10 min的消毒方法最好,外植体成活率高达74.0%,且长出大量愈伤组织,有利于后期植株生长。用75%酒精和2%NaClO溶液浸泡15 min的消毒方法外植体无菌率最高,达80.0%,但成活的外植体没有长出愈伤组织,且褐化、黄化严重,失去生命力,如图1所示。而用75%酒精和2%NaClO溶液浸泡5 min的消毒方法外植体损伤最小,但污染率最高,不利于后期无菌操作,如图2所示。

表4 不同消毒方法对‘大花’钝叶酢浆草外植体的影响Tab.4 Effects of different disinfection methods on explants of Oxalis obtuse ‘large form’
2.2 最适启动培养基的选择及最适外植体的选取
3种钝叶酢浆草的外植体暗培养28 d后,转入光培养7 d,并对生长情况进行统计。不同质量浓度激素配比导致各培养基外植体生长情况不同,其中‘大花’钝叶酢浆草的表现最明显,对其进行数据统计(表5)。A2到A5各组不同程度诱导出愈伤组织,其中A4组愈伤组织饱满,呈松散状,表面透明,有绿色的芽点出现,生长良好,利于分化,最为优秀。A1组外植体萎缩,没有分化出愈伤组织。A2组外植体褪色,愈伤组织排列紧密,半透明,呈白色,没有芽点。A3组愈伤组织排列紧密,呈浅黄色,分化趋势很慢。A5组愈伤组织浅绿色,没有芽点,松散程度介于A3组、A4组之间。A6组外植体饱满,但没有分化出愈伤组织和芽点。6组茎尖全部成活,状态饱满,但污染严重。通过比较,A4组长势最快,茎尖中心长出新叶,新叶叶柄伸长,叶片展开,生长良好,最为优秀。A2组和A5组茎尖生长缓慢。A3组茎尖长出新叶,但新叶仍皱缩。A1组和A6组的茎尖没有生长。通过比较,A4组的钝叶酢浆草愈伤组织和茎尖生长最好,如图3所示。A1组和A6组的茎尖没有生长。采用MS+6-BA 1.5 mg/L+NAA 0.2 mg/L+30 g/L蔗糖+30 g/L琼脂的配方为钝叶酢浆草最适启动培养基。培养时,茎尖的污染状况较叶片更严重。钝叶酢浆草茎尖不适宜作为外植体。而钝叶酢浆草叶片消毒效果好,是启动培养的最佳外植体。

表5 不同启动培养基对‘大花’钝叶酢浆草外植体的影响Tab.5 Effects of different primary medium on explants of Oxalis obtuse ‘large form’
2.3 不同品种在最适启动培养基中的生长情况
暗培养28 d后,统计3种钝叶酢浆草愈伤组织的分化情况。不同品种在同种激素配比下外植体出愈率不同(表6)。通过比较,叶片最厚质地最硬的‘大花’钝叶酢浆草出愈率最高,在A4组中高达66.7%。‘锂辉石’钝叶酢浆草叶片较厚,质地较软,在A4组出愈率为51.8%,而叶片较薄质地最软的‘芬达’钝叶酢浆草出愈率较低,只有22.2%。3个品种的培养状态如图4所示。在激素配比相同时,钝叶酢浆草叶片越厚、质地越硬,更易分化出愈伤组织,更适宜植物组织培养。

表6 3个品种钝叶酢浆草在同种激素配比下外植体出愈率Tab.6 The germination rate of 3 varieties of Oxalis obtusa explants under the same hormone concentration
2.4 最适继代培养基的选择
在NAA为0.1 mg/L时,随着6-BA质量浓度升高,钝叶酢浆草芽的生长速度加快,分枝增加(表7)。其中,B3组芽生长速度最快,长出的分枝较多,同时芽高度适中,茎直立健壮,长势最优。B1组芽生长较快但分枝极少。B2组芽生长较快,芽分支少,茎直立。而当NAA为0.2 mg/L时,随着6-BA质量浓度升高,钝叶酢浆草芽的生长速度略微加快,但分枝形态弯曲无法利用。B4组芽生长很慢,分枝少,茎高而扭曲。B5组芽生长较慢,分枝少,茎弯曲。B6组生长较快,芽分枝较多,但形态扭曲难以分离。MS+6-BA 2.0 mg/L+NAA 0.1 mg/L+30 g/L蔗糖+30 g/L琼脂,是培养钝叶酢浆草的最适继代培养基。

表7 不同继代培养基对钝叶酢浆草外植体的影响Tab.7 Effects of different subculture medium on explants of Oxalis obtusa
2.5 最适生根培养基的选择
在6-BA质量浓度为0.0 mg/L时,随着NAA质量浓度升高,钝叶酢浆草根的生长速度加快(表8)。其中C2组根密而粗壮,叶绿色,植株健壮,长势最好。C1组植株较弱,根密且细弱,叶浅绿。C3组植株较细弱,根稀而粗壮,叶浅绿。
在6-BA质量浓度为0.5 mg/L时,随着NAA质量浓度升高,钝叶酢浆草根的生长情况被明显抑制,植株状态差。其中C4组植株细弱,根系稀疏,叶黄。C5组植株很弱,只有零星根系长出,叶黄。C6组没有分化出根系,叶黄。采用1/2 MS+NAA 0.1 mg/L+30 g/L蔗糖+30 g/L琼脂的培养基是钝叶酢浆草的最适生根培养基,培养得到的苗在炼苗时损失少,移栽容易恢复,叶片深绿且生长快,如图5所示。
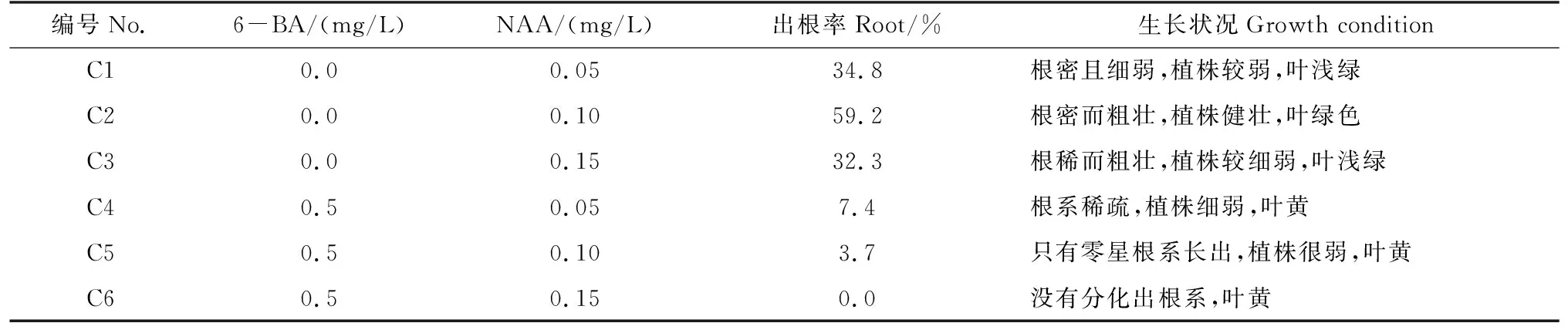
表8 不同生根培养基对钝叶酢浆草无菌苗的影响Tab.8 Effects of different root medium on sterile seedlings of Oxalis obtuse
3 讨 论
钝叶酢浆草组织培养的外植体选择很重要,一般选用叶片或茎尖,其中茎尖消毒不便、易污染[17],而叶片消毒操作简便,污染率低,因此钝叶酢浆草组织培养的最适外植体是叶片。胡国富等[12]确定培养三角紫叶酢浆草的最适外植体为叶片。陈芬等[16]以熔岩酢浆草叶片为外植体研究得出组培快繁技术。该试验使用叶片为外植体进行培养与前人研究结果一致。
该试验确定钝叶酢浆草叶片的最适消毒方法,75%酒精浸泡15 s后用2%NaClO溶液浸泡10 min的消毒效果最好,外植体成活率最高。消毒时间短,外植体不易损伤,但无法杀死杂菌,通常长出乳白色或淡黄色菌落。其中为了使叶片更清洁,用流水冲洗叶片时间应加长到40 min至60 min,冲洗时水流适中,防止叶片损伤。在选取的3个品种中,叶片的质地越硬出愈率越高。叶片最硬最厚的‘大花’叶片平整、绒毛少,能紧密贴合培养基,在各组培养基中发芽率最高,长势最好。叶片最薄、质地最软的‘芬达’在各组培养基的出愈率都不理想。消毒时间长,薄叶片的品种易受伤害,受害叶片背面呈海绵状,质地软、易碎,操作困难,出愈率低,部分叶片褪色,培养时易黄化、褐化。而厚叶片的品种在消毒后受到的损伤小,便于划伤培养。钝叶酢浆草叶片厚、质地硬的品种更适宜植物组织培养。
不同质量浓度的激素配比导致外植体在启动培养、继代培养和生根培养过程中产生不同的生长情况。启动培养中,NAA和6-BA对钝叶酢浆草叶片愈伤组织的形成起到关键作用。高贵珍等[20]在紫叶酢浆草组织培养中确定启动培养基激素配比为6-BA 1.0 mg/L+NAA 0.2 mg/L,外植体接种10 d后即可产生愈伤组织,诱导率83.3%。而在该试验当NAA质量浓度保持不变时,随着6-BA的质量浓度渐渐升高,其对钝叶酢浆草外植体分化趋势越来越强。当6-BA的质量浓度超过临界值2.0 mg/L时,6-BA质量浓度逐渐升高,钝叶酢浆草茎愈伤组织排列紧密,不利出芽。当6-BA质量浓度2.5 mg/L,NAA质量浓度0.2 mg/L时,叶片不会长出愈伤组织,茎尖也不会生长。该试验将启动培养基激素配比调整为MS+6-BA 1.5 mg/L+NAA 0.2 mg/L。继代培养中,NAA诱导钝叶酢浆草植株长出不定根,6-BA促进茎叶伸长和诱导侧芽生成。蔡丽琼等[21]、张兴桃[22]等在紫叶酢浆草组织培养中确定继代培养基激素配比为NAA 0.5 mg/L+6-BA 1.0 mg/L,不定芽增殖系数最高,达3.46±0.61。而该试验过程中,当NAA质量浓度0.1 mg/L时,钝叶酢浆草再生芽生长速度随着6-BA质量浓度增加而加快,形态直立健壮。当NAA质量浓度0.2 mg/L时,再生芽生长速度随着6-BA质量浓度增加而加快,生长旺盛但形态发生不可逆转的扭曲;可见只有二者处于合适的比例时,外植体才能快速大量产生愈伤组织,并加以诱导产生可用的再生芽,因此该试验最佳继代培养为MS+6-BA 2.0 mg/L+NAA 0.1 mg/L。生根培养中,王利[23]在紫叶酢浆草组织培养中确定生根培养基激素配比为NAA 0.2 mg/L时,丛生芽发生效果好,叶片宽大,叶柄粗壮,根系健壮,培养全过程只要40 d,成活率最高达96%。而该试验培养基同时加入6-BA和NAA时,不论NAA为何种质量浓度钝叶酢浆草无菌苗的生长状况都不好。当培养基中只有NAA时,随着NAA质量浓度的升高,植株根系生长加快,NAA质量浓度为0.1 mg/L时,出根率59.2%,得到的无菌苗根密而粗壮,便于移栽。当NAA质量浓度超过临界值0.1 mg/L时,NAA质量浓度逐渐升高,钝叶酢浆草根系数量减少,植株长势变差,因此该试验将激素NAA确定为0.1 mg/L。
为了提高移栽成活率,让钝叶酢浆草组培苗更好生长,需要先在温室半阴处适应,同时因为钝叶酢浆草有遇高温休眠的习性,组培苗移栽后应尽量处于18~25 ℃的环境内,防止环境温度过高引起组培苗落叶休眠死亡。由于组培瓶内湿度大,移栽后的组培苗地上部分仍然要保持一定湿度,组培苗定植后的根系尚未完全适应基质,所以应保持基质湿润,防止基质过涝烂根。并随日常管理逐渐降低湿度,直至与温室内一致。此外需要注意的是,组培苗根部的培养基要清理干净,否则会滋生大量细菌真菌引起根部腐烂。
该试验以钝叶酢浆草叶片为外植体,检测叶片的消毒时间,筛选启动培养基、继代培养基和生根培养基,最终获得大量钝叶酢浆草组培苗,确立钝叶酢浆草组织培养技术体系,为批量化生产提供基础。
