德国小蠊Bla g 5基因表达、纯化及生物信息学分析
2021-01-06季树宇欧阳春艳钟永浩杨礼腾刘晓宇
季树宇,欧阳春艳,曹 会,钟永浩,杨礼腾,刘晓宇
德国小蠊,属蜚蠊目姬蠊科,为蜚蠊目中分布最为广泛、与人类生活最为密切的一类医学昆虫,广泛分布于全球热带、亚热带、温带中低海拔湿润地区[1],在我国大部分省市均有广泛分布。其排泄物、分泌物、尸体及皮蜕通过吸入途径可引起I型超敏反应,进而诱发过敏性哮喘、过敏性鼻炎和过敏性皮炎等疾病[2-3],据季文霞等人的调查显示四川绵阳地区吸入性过敏原阳性结果前五位的分别是蟑螂、粉尘螨、屋尘螨、藜、大豚草[4],由此可见,蟑螂为重要吸入性过敏原疾病之一,其阳性率高达42.2%。李春林等人在海南对500例过敏性疾病患者,采用皮肤点刺试验及鼻黏膜激发试验,其中皮肤点刺试验阳性率为66.20%,而鼻黏膜激发试验阳性率为100%[5]。国内对德国小蠊过敏原Bla g 5尚未见报道,故本研究通过基因重组技术将德国小蠊主要过敏原Bla g 5基因导入大肠杆菌,通过纯化最终得到纯度较高的重组蛋白,为临床诊断过敏性疾病试剂研发、精准脱敏治疗提供实验依据。
1 材料与方法
1.1 材料、试剂、仪器
1.1.1表达载体与菌种E.coli感受态细胞Rosetta(DE3)及载体pET-32a(+)均由深圳大学医学院过敏反应与免疫学研究所保存。
1.1.2血清 过敏患者由深圳市龙岗耳鼻喉医院提供,血清采集均获得供血者知情同意。对20 例过敏性哮喘和过敏性鼻炎患者行静脉穿刺,采血 5 mL,分装后低温-80℃保存。
1.1.3主要试剂 限制性核酸内切酶BamHI、XhoI,Taq DNA聚合酶,T4 DNA连接酶均购自日本TaKaRa 公司;Ni-NTA柱填料购自广州佰路生物科技有限公司;辣根过氧化物酶(HRP)标记小鼠抗人IgE Fc端二抗购自深圳市华尔康生物科技有限公司。
1.1.4主要仪器材料 体视显微镜购自深圳市富途锐科技有限公司;超净工作台购自新加坡艺思高科技有限公司;低温高速离心机购自德国Eppendorf公司;水流抽气泵购自日本东京理化;PCR仪,蛋白纯化仪均购自美国BIO-RAD公司;超声波破碎仪购自美国Sonics公司;低温摇床购自上海智城分析仪器制造有限公司;凝胶成像系统购自广州迅益生物科技有限公司。
1.2 实验方法
1.2.1德国小蠊总RNA提取 取本实验室饲养的德国小蠊20 只(成虫), 液氮中均匀研磨虫体后,用Qiagen 公司试剂盒进行总 RNA 的提取。
1.2.2设计引物 从UniProt导出Bla g 5序列(登录ID为O18598)利用Primer Premier设计上、下游引物,使引物退火温度在50 ℃~70 ℃之间,且上下引物间退火温度不超过5 ℃,引物设计完成后交托上海生工生物技术股份有限公司进行合成。
1.2.3对目的基因进行RT-PCR扩增 以德国小蠊总RNA为模板进行逆转录合成cDNA,以cDNA为模板进行目标基因扩增,PCR扩增体系为:ddH2O 11.78 μL、25 mmol/L MgCl21.4 μL、25 μmol/L dNTP 0.16 μL、5 U/L Taq polymerase 0.16 μL、2 μmol/L primer 2.5 μL、40 ng/μL cDNA 2 μL、10X PCR buffer 2 μL;扩增条件:为94 ℃预变性3 min、94 ℃变性1 min、60 ℃退火1 min、72 ℃延伸1.5 min,循环35次,最后一次72 ℃延长至10 min,琼脂糖凝胶电泳鉴定PCR产物,并将少量PCR产物送至上海生工生物技术股份有限公司进行测序。
1.2.4基因表达载体构建 将序列正确的PCR产物与pET-28a(+)载体进行HindIII和XhoI双酶切,通过T4连接酶催化DNA 5′-P末端与3′-OH末端之间的磷酸二酯键结合,成功构建基因表达载体,以CaCl2法将载体转入感受态细胞Rosetta(DE3),以含卡那霉素的LB平板培养质粒转化后的大肠杆菌,用无菌牙签挑取单克隆菌落接种至5 mL LB培养基中,经37 ℃、200 r/min培养至对数生长期,离心集菌后提取质粒,经双酶切鉴定该载体是否正确连接目的基因。
1.2.5利用重组大肠杆菌表达目的蛋白 将成功转入目的基因的大肠杆菌为工程菌进一步扩大培养,以IPTG(异丙基-β-D-硫代半乳糖苷)在37 ℃诱导4 h以及在16 ℃环境下诱导12 h,诱导完成后在低温4 ℃条件下以10 000 r/min速度离心并收集菌体,加入磷酸盐缓冲液(Phosphate Buffered Saline)重悬,超声破碎仪进行破碎,超声破碎所得菌液进行低温超速离心10 000 r/min 30 min,倾倒法分离上清与沉淀,分别取诱导前全菌重悬液、低温诱导上清、低温诱导沉淀重悬液、高温诱导上清、高温诱导沉淀重悬液60 μL,分别各自加入20 μL 4x loading buffer,99 ℃恒温水浴锅加热9 min,经短暂离心后取5 μL样品进行聚乙烯酰胺凝胶电泳(SDS-PAGE),电泳完毕后立即用考马斯亮蓝R-250(Coomassie brilliant blue R-250),凝胶成像仪中观察。
1.2.6金属螯合离子层析法纯化目的蛋白 将上述剩余菌体进行纯化,硫酸镍(Nickel sulfate)冲柱,ddH2O冲柱,平衡缓冲液buffer A冲柱(500 mmol/L Sodium chloride,50 mmol/L Tris,pH8.0),柱体积buffer A洗脱未结合杂蛋白,buffer B(50 mmol/L Tris,15非特异性蛋白,buffer C冲柱洗特异性蛋白,取少量纯化进行SDS-page电泳分析。
1.2.7重组蛋白Western blot分析 取纯化蛋白样SDS-PAGE电泳将蛋白转移到经甲醇活化的PVDF膜上,转膜完成后以TBST洗PVDF膜多次,加入5%脱脂奶粉封闭1 h,以20例过敏患者混合血清为一抗在4 ℃恒温条件下孵育过夜。加入Mouse Anti-Human IgE Fc-HRP为二抗,TBST洗膜去除未结合的二抗。ECL超敏发光试剂,在化学发光成像仪观察显色反应。
1.2.8Bla g 5的生物信息学分析 从GenBank中下载Bla g 5氨基酸序列(GenBank ID为U92412),通过SWISS-MODEL预测Bla g 5蛋白三维结构;通过DNA Star-LaserGene系统预测Bla g 5理化性质、二级结构、亲水性、表面可及性、抗原指数。并利用Pblast搜索Bla g 5的同源序列,并从检索结果中人工挑选出与Bla g 5同源的非冗余序列,对挑选出来的序列使用Clustal W 2.1进行多序列比对,为保证系统发生树的可靠性,本研究中同时采用NJ法、ML法两种方法建树,在构建NJ树之前计算pairwise Jukes-Cantor(JC)平均距离,(该值大于1时数据集不适合使用NJ法构建系统发生树),替代模型选择p-distance model,空位处理选择pairwise deletion。在构建ML树之前先预测最适合数据集的进化模型。NJ法与ML法均采用Bootstrap method进行检验,检验次数为500次,且建树过程均在MEGA-X中进行。
2 结 果
2.1Blag5基因表达载体的构建 将Blag5基因连接至pET-28a(+)载体,以限制酶BamHI、XhoI双酶切鉴定其为阳性,其核酸在琼脂糖电泳与Bla g 5 cDNA长度基本一致,pET-28a(+)-Bla g 5表达载体构建成功(图1)。

M:DNA Marker;1:pET-28a Blag 5 质粒双酶切后片段
2.2重组Bla g 5表达及纯化 工程菌Rosetta(DE3)经IPTG诱导表达及纯化后,其表达产物经SDS-PAGE可见25 kDa处有明显条带,与预期分子量接近,由此得到部分可溶性重组蛋白(图2)。重组蛋白大量表达后经Ni柱纯化,纯化蛋白经SDS-PAGE电泳结果显示在分子量25 kDa处可见明显条带(图3)。

M:Protein marker;1:诱导前; 2:37 ℃诱导全菌液; 3:37 ℃诱导上清;4:37 ℃诱导沉淀;5:16 ℃诱导全菌液;6:16 ℃诱导上清; 7.16 ℃诱导沉淀

图3 重组Bla g 5蛋白在大肠杆菌中的诱导表达及纯化
2.3重组Bla g 5的免疫原性鉴定 以20例过敏患者血清混合为一抗,以Mouse Anti-Human IgE Fc-HRP为二抗,血清特异性反应为阳性,而健康对照者血清反应为阴性(图4)。

M:Protein marker; 1:Bla g 5重组蛋白
2.4 Bla g 5 生物信息学分析
2.4.1SWISS-MODLE同源建模 GMQE值为0.99(GMQE为全局模型质量评估,其置信度范围为 0~1,越接近1,模型可信度越高)、QMEAN值为-0.24,提示预测可信度较高(其置信度范围应该-4~0,越接近0,模型可信度越高),同源建模提示Bla g 5为具有同源二聚体结构的谷胱甘肽-S-转移酶(图5)。
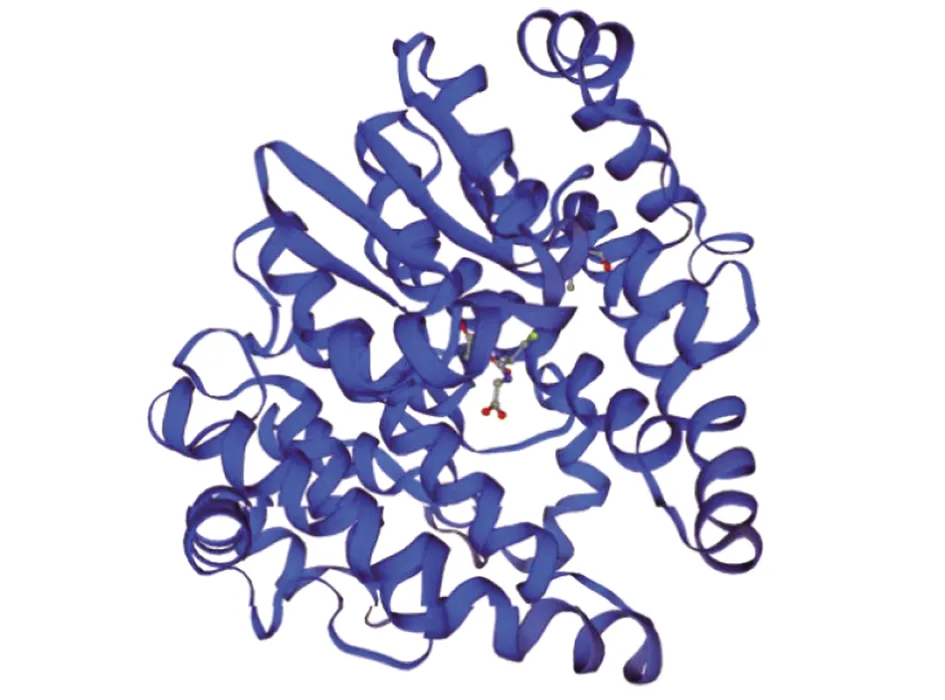
图5 Bla g 5的三维结构预测
2.4.2Bla g 5的理化性质预测 采用EditSeq对德国小蠊Bla g 5理化性质进行分析显示其理论分子量为22 947.21道尔顿,其理论等电点为6.620,组成Bla g 5的200个氨基酸中有28个强碱性氨基酸,29个强酸性氨基酸;71个疏水性氨基酸,42个亲水性氨基酸。
2.4.3Bla g 5二级结构预测 蛋白质二级结构主要包括α螺旋、β折叠、转角(Turn)、无规则卷曲(Coil)等。应用DNA Star Protean软件提供的模块,采用Garnier-Robson法预测Bla g 5二级结构,其共含200个氨基酸,二级结构以α螺旋为主,并伴有相当量的β折叠、Turn、Coil,结构较为复杂(图6)。
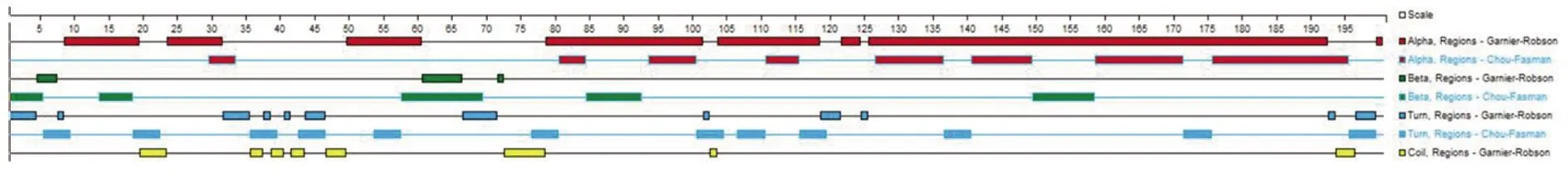
图6 Bla g5的二级结构预测
2.4.4Bla g 5亲水性预测 过敏原亲水性与过敏原表位相关性较高,蛋白质亲水性越高,亲水性区域暴露在表面更易形成抗原表位的可能性越大。应用DNA Star Protean软件提供的模块,采用Kyte-Doolittle 法预测Bla g 5亲水性,其亲水区域约占总序列的57%(图7)。

图7 Bla g 5的亲水性预测
2.4.5Bla g 5可塑性预测 一般来说,蛋白构象可塑性越强,越易形成抗原表位,应用DNA Star Protean软件提供的模块,采用Karplus-Schul 法预测Bla g 5可塑性,其可塑性区域占48%,提示Bla g 5可塑性较好,易形成抗原表位(图8)。

图8 Bla g5的可塑性预测
2.4.6Bla g 5抗原性预测 抗原性预测基于已研究透彻的蛋白质,抗原指数越高则说明该氨基酸在抗原区出现的频率越高,应用DNA Slar Prolean软件提供的模块,采用Jameson-Wolf 法预测Bla g 5抗原性(图9)。

图9 Bla g5的抗原性预测
2.4.7Bla g 5表面可及性预测 表面可及性代表蛋白质氨基酸残基被其他分子接触到的可能性,表面可及性越高越易形成抗原表位。应用DNA Slar Prolean软件提供的模块,采用Plot-Emini法预测Bla g5表面可及性,其表面可及性平均值为1.3(图 10),提示Bla g 5蛋白易形成抗原表位。

图10 Bla g5的表面可及性预测
2.4.8Bla g 5同源性分析 为了确定Bla g 5与同源序列之间的关系,我们利用pblast进行同源性搜索,并从检索结果中挑选出14条与Bla g 5同源的非冗余序列(表1)。在构建NJ树之前计算得pairwise Jukes-Cantor(JC)平均距离为0.38,表明数据集适合使用NJ法,最终得到NJ树如图11。在构建ML树之前,根据BIC标准选择最佳进化模型为LG+G(Lgmodel+Gamma distributed)最终得到ML树如图12。系统发生树结果显示,我们所选取的14个物种中与德国小蠊(Blattellagermanica)亲缘关系最近的是柑橘木虱(Diaphorinacitri),具有典型的谷胱甘肽硫转移酶(GST)特征。
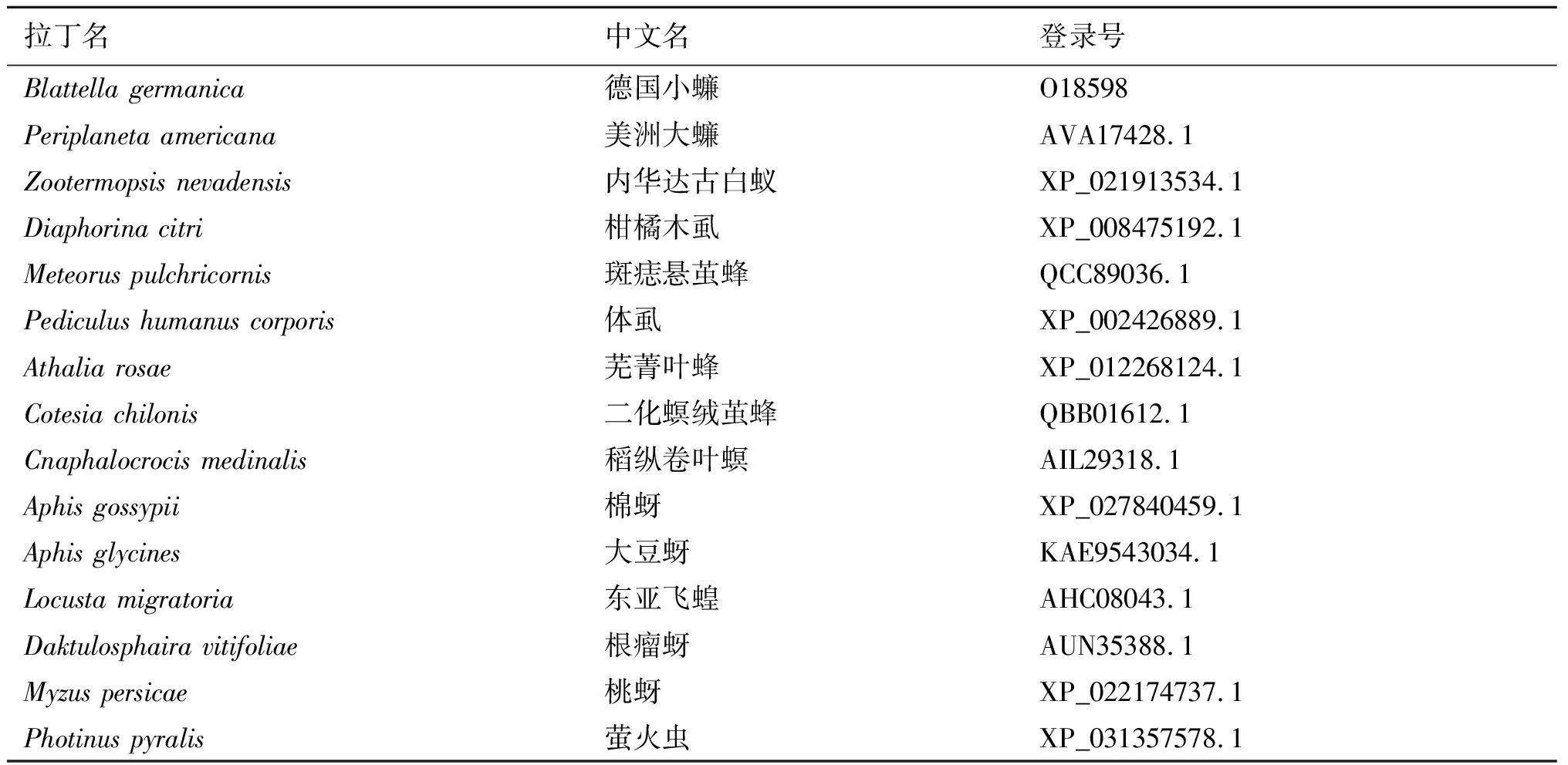
表1 Bla g 5同源序列
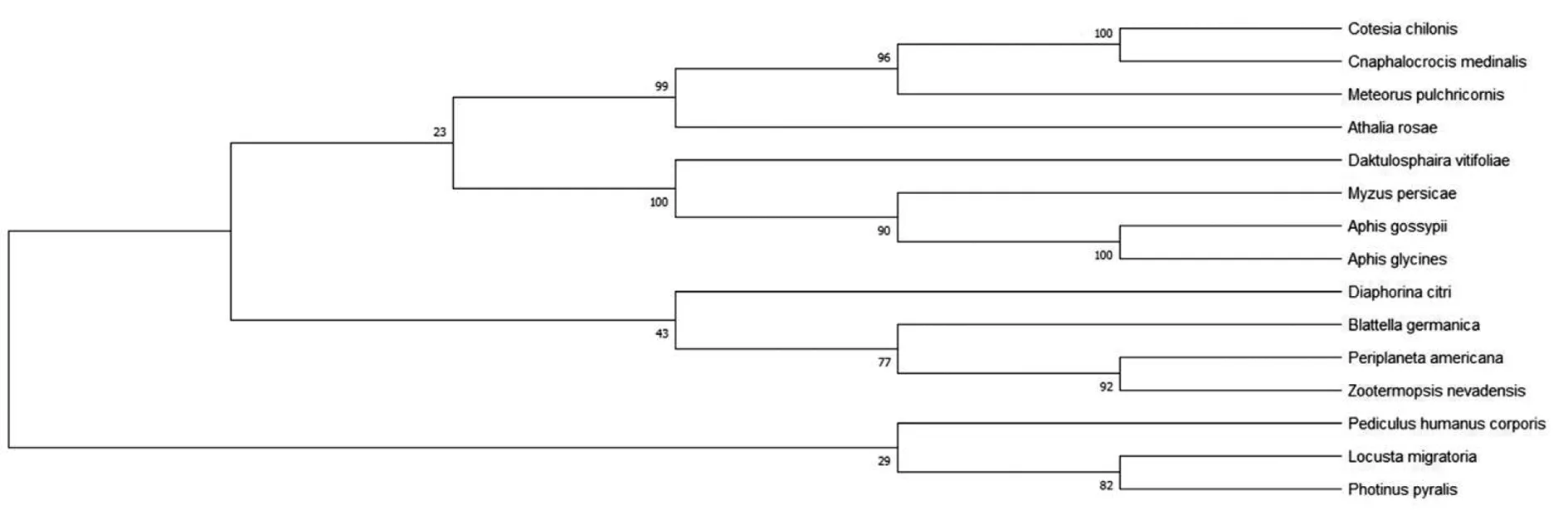
图11 Bla g 5系统进化树分析(NJ法)

注:本实验只旨在找出与Bla g 5进化距离最近的序列,进而推测Bla g 5的生物学性质,因而不需要引进外类群以确定谁是谁的祖先。
3 讨 论
德国小蠊(Blattellagermanica)是世界性家居卫生害虫之一,其繁殖能力强,德国小蠊从卵孵化到性成熟需15~30 d,且德国小蠊单个卵荚中所含卵数量大于其他蜚蠊目,雌虫可携带卵荚直至若虫孵化,避免了外界不利环境对德国小蠊幼虫的影响。由于其高繁殖潜力,其对杀虫剂的抗药性也越来越强[6-7],种种因素导致德国小蠊成为人类栖息地最常见害虫之一。
研究表明德国小蠊皮屑脱落物及排泄物和分泌物可诱导Ig E介导的I型超敏反应[8],吸入可累及皮肤、呼吸道、胃肠道,引起荨麻疹、鼻炎哮喘等过敏反应性疾病,L.Karla Arruda等人指出Bla g 5 本质为德国小蠊谷胱甘肽转移酶(GST)[9],昆虫GST被认为在蟑螂摄入的食物和其他物质的解毒过程中起着重要的生理作用。昆虫体内GST产量的上调与对杀虫剂(特别是有机磷)的抗药性有关。长时间使用杀虫剂以控制过敏患者家中的蟑螂种群可能会导致GST表达增加和患者对环境过敏原不同程度暴露。这些治疗方法对蟑螂过敏原水平的影响尚不清楚。L.Karla Arruda等人的研究显示,杀虫剂治疗可能会增加GST过敏原的暴露,这反过来可能会导致过敏症状的风险增加[9]。与其他昆虫GST相反,德国小蠊GST对CDNB(1-氯-2,4二硝基苯)底物的活性很低。这意味着德国小蠊GST对CDNB以外的底物有更高的亲和力(即德国小蠊GST具有不同寻常的底物特异性),或者德国小蠊会产生一种比Bla g 5变应原对CDNB特异性更高的GST同工酶。Kyoung-jin Jeong通过覆盖Bla g 5的1-175个氨基酸的3个肽片段来确定IgE表位区域,这3个肽片段没有表现出IgE反应性。该结果表明,Blag 5的表位位于176和201之间的C端区域[10]。Kyoung-jin Jeong猜测Blag 5在C末端区域可能会产生类似果蝇GST的域间裂隙结构,从而构成构象表位[10]。
我国临床流行病学调查显示蟑螂抗原皮肤点刺试验阳性率12.7%~79%[11],考虑到生物多样性,不同地区的生物其基因序列和氨基酸序列有一定差异,导致其免疫原性有所不同,为了提高我国过敏性疾病诊断的特异性和治疗疗效,因尽可能使用本地化过敏原。本实验研究的Blag5基因序列全长1 140 bp,编码Bla g 5蛋白共计200个氨基酸,通过基因重组技术将德国小蠊主要过敏原Blag5基因导入大肠埃希氏菌,通过纯化最终得到高纯度的Bla g 5重组蛋白,可应用于临床德国小蠊过敏的特应性诊断[11]。特异性免疫治疗(SIT)是目前认为最为有效的脱敏疗法,即通过对过敏者注射过敏原,诱导患者产生过敏反应,并逐渐增加剂量达到增强患者对其耐受,最终达到脱敏的目的[12],但目前临床上广泛使用的仍然是蟑螂粗提液,粗提液中含大量非致敏成分,其具有特异性差、稳定性差、治疗周期长、易产生不良反应等缺陷[13],而重组Bla g 5蛋白可用于标准化疫苗生产,从而避免蟑螂浸出液种种缺陷[14]。本研究通过SWISS-MODLE、DNAstar等生物信息学工具对Bla g 5的三维结构、二级结构、亲水性、表面可及性、抗原指数等理化性质进行预测,为德国小蠊过敏原的结构和功能的进一步研究提供了理论依据[13]。
利益冲突:无
