消退素E1对氧化应激下人牙髓干细胞生物学性能的影响
2021-01-06杨婷,陶硕,张旗
杨 婷,陶 硕,张 旗
活髓保存是临床上牙体牙髓病治疗的首要目标,主要通过促进牙本桥形成,隔绝外界刺激,进而使牙齿继续行使其各项生理功能[1],牙髓的自我损伤修复能力是其生物学基础。但最新研究表明[2-3],糖尿病可以引起牙髓组织损伤修复受损,在糖尿病大鼠直接盖髓实验中,成功率仅有53.8%,临床研究1年成功率仅有38.2%,这主要是由于糖尿病的氧化应激病理状态导致牙髓干细胞发生氧化损伤[4-5],增殖、分化等生物学性能减弱,而牙髓组织损伤的成功修复主要依赖于牙髓干细胞增殖、迁移和分化这些生物学性能的有效发挥[6]。
消退素E1(resolvin E1,RvE1)是近年来广泛研究的内源性脂质介质,由ω-3多不饱和脂肪酸衍生而来[7],可以通过促进过氧化物的清除和减少自由基的形成来发挥抗氧化作用[8-9],同时其还具有抗炎促消退、促进成骨、缓解疼痛、抗纤维化等生物学作用[10-12]。但RvE1能否对氧化应激下人牙髓干细胞(human dental pulp stem cells, hDPSCs)的生物学性能起保护作用仍不清楚,因此本研究旨在探索RvE1对氧化应激损伤的hDPSCs形态、增殖、迁移及成牙向分化这些生物学性能的影响。
1 材料与方法
1.1 主要试剂
α-MEM培养基、青霉素/链霉素双抗、PBS、0.25%胰蛋白酶(Hyclone,美国),胎牛血清(Excell Bio,澳大利亚),Ⅰ型胶原酶、分散酶、DAPI、地塞米松、β-甘油磷酸钠、抗环血酸(Sigma,美国),RvE1(Cayman Chemical,美国),ChemR23抗体(Abcam,美国),HE染色试剂盒(威奥生物科技有限公司,上海),鬼笔环肽(Invitrogen,美国),4%多聚甲醛(PFA)(联超生物科技有限公司,上海),cck-8检测试剂盒(同仁,日本),3%过氧化氢、碱性磷酸酶(ALP)检测试剂盒(青牧生物科技有限公司,上海)。
1.2 方法
1.2.1 hDPSCs体外分离培养与鉴定 取新鲜拔除、健康的第三恒磨牙(选择同济大学附属口腔医院口腔颌面外科患者,患者知情同意),用含有10%双抗的PBS清洗牙齿3次,骨凿劈开牙冠,暴露牙髓,无菌镊子取出牙髓组织用含10%双抗的PBS冲洗3次,将牙髓组织转移至含有3 g/L Ⅰ型胶原酶和4 g/L分散酶的1.5 mL EP管中,无菌眼科剪将牙髓组织剪碎,置于37 ℃培养箱消化1 h,1 200 r/min离心5 min,弃上清,将沉淀铺于25 mm2的培养瓶中,4 h后加入含10%FBS和1%双抗的培养液。每3 d换1次液,待细胞长至80%~90%时进行消化传代,运用有限元稀释法分离出牙髓干细胞并通过流式细胞术及成骨和成脂向诱导进行鉴定,继续培养,第3代细胞用于后续实验。
1.2.2 免疫荧光染色检测ChemR23表达 4%PFA固定hDPSCs 20 min,0.1%Triton-100通透细胞膜10 min,1∶300的比例孵育ChemR23抗体,4 ℃过夜,孵育荧光二抗,DAPI复染,荧光显微镜下观察、拍照。
1.2.3 cck-8检测消退素E1最佳作用浓度 将hDPSCs按3×103/孔的密度接种于96孔板,分别加入浓度为1、10、50、100、200 nmol/L的消退素E1,每组设5个复孔,分别于1、3、5、7 d后弃培养液用PBS清洗,按cck-8溶液∶培养基为1∶10的比例每孔加入100 μL的混合液,细胞培养箱孵育2 h,酶标仪测定450 nm波长每孔的光密度(OD)值。
1.2.4 HE染色和鬼笔环肽染色观察细胞形态 将hDPSCs按5×103个/孔的密度接种于24孔板中,实验分对照组、H2O2组和H2O2+RvE1组3组,每组设2个复孔,H2O2组和H2O2+RvE1组分别加入200 nmol/L H2O2预处理建立氧化应激模型,24 h后,对照组和H2O2组使用含10%血清和1%双抗的正常培养基继续培养, H2O2+RvE1组则使用加入100 nmol/L RvE1的正常培养基继续培养,24 h后,4%PFA固定20 min,按试剂盒说明进行HE和鬼笔环肽染色,显微镜下观察、拍照。
1.2.5 cck-8检测细胞增殖能力 将hDPSCs按3×103个/孔的密度接种于96孔板,按1.2.3分组,每组设5个复孔,同1.2.3处理,分别于0、1、4和7 d后弃培养液用PBS清洗,按cck-8溶液∶培养基为1∶10的比例每孔加入100 μL的混合液,细胞培养箱孵育2 h,酶标仪测定450 nm波长每孔的光密度(OD)值。
1.2.6 划痕检测细胞迁移能力 将hDPSCs按2×105个/孔的密度接种于背面划有横线6孔板,按1.2.3分组,H2O2预处理24 h后,用1 000 μL的枪头垂直6孔板背面直线划竖线,用PBS洗去脱落细胞,对照组和H2O2组加入无血清培养基继续培养,H2O2+RvE1组培养基中加入100 nmol/L RvE1,按0、12、24 h时间点取样拍照。
1.2.7 ALP染色检测细胞成牙向分化能力 将hDPSCs按5×103个/孔的密度接种于24孔板中,按1.2.3分组,H2O2预处理24 h后,对照组和H2O2组更换为加入含有1×10-8mol/L 地塞米松、10 mmol/L β-甘油磷酸钠和50 mg/L抗坏血酸的矿化诱导液,H2O2+RvE1组则使用加入100 nmol/L RvE1的矿化诱导液,7 d后取样,首先4%PFA固定20 min,PBS洗3次,加入配置好的ALP染液,避光孵育4 h,去离子水洗,显微镜下观察、拍照,同时,根据ALP活性检测试剂盒说明进行各组细胞ALP活性检测。
1.2.8 RT-qPCR检测细胞成牙向分化能力 将hDPSCs按1×104个/孔的密度接种于6孔板中,按1.2.3分组,H2O2预处理24 h后,对照组和H2O2组更换为矿化诱导液,H2O2+RvE1组则使用加入100 nmol/L RvE1的矿化诱导液,7 d后取样,提取细胞RNA并逆转录,最后进行RT-qPCR实验检测各组细胞DMP1和DSPP基因表达。
1.3 统计学方法
Graph Pad Prism 7统计软件进行统计分析并绘图,各组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结 果
2.1 hDPSCs鉴定结果
流式细胞术检测结果显示牙髓干细胞表面CD105、CD146、CD90的阳性率分别是92.7%、91.6%、87.3%;CD34、CD45的阳性率分别是0.089%、0.069%,证明实验所分离培养的hDPSCs是间充质组织来源,而非造血细胞来源。hDPSCs成骨向诱导14 d后,茜素红染色结果显示有大量红褐色结节形成,大小不等;hDPSCs成脂向诱导21 d后,油红O染色结果显示部分细胞内有橘红色脂滴形成,证明我们分离提取的hDPSCs具有成骨向及成脂向分化的潜能(图1)。
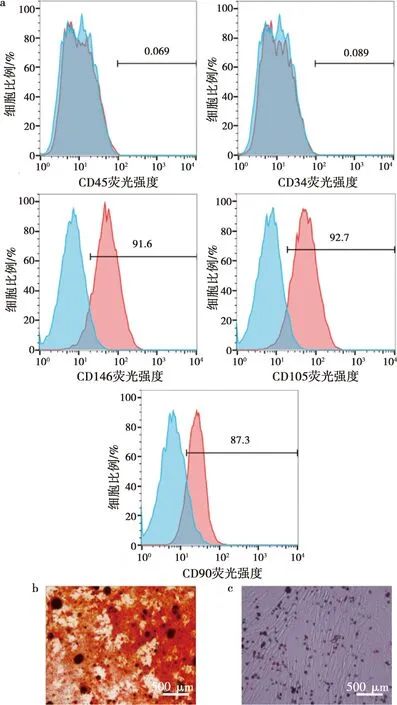
a: hDPSCs表面抗原流式分析结果;b:hDPSCs成骨向诱导分化结果;c:hDPSCs成脂向诱导分化结果
2.2 ChemR23在hDPSCs中的表达
免疫荧光染色结果显示,ChemR23在hDPSCs胞质中广泛表达,说明hDPSCs上有RvE1的作用位点(图2)。
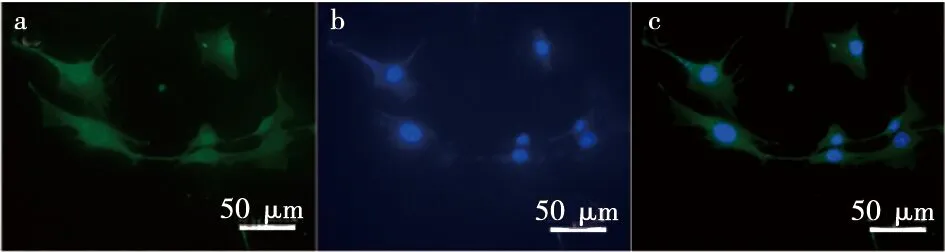
a:ChemR23表达;b:DAPI表达;c:ChemR23和DAPI合成图
2.3 消退素E1的最佳作用浓度
cck-8结果显示,在第5天和第7天的时候,10、100 nmol/L都可以促进牙髓干细胞增殖(P<0.05),在第7天时100 nmol/L的作用效果比10 nmol/L更强,因此选用100 nmol/L作为作用于牙髓干细胞最适宜的浓度(图3)。
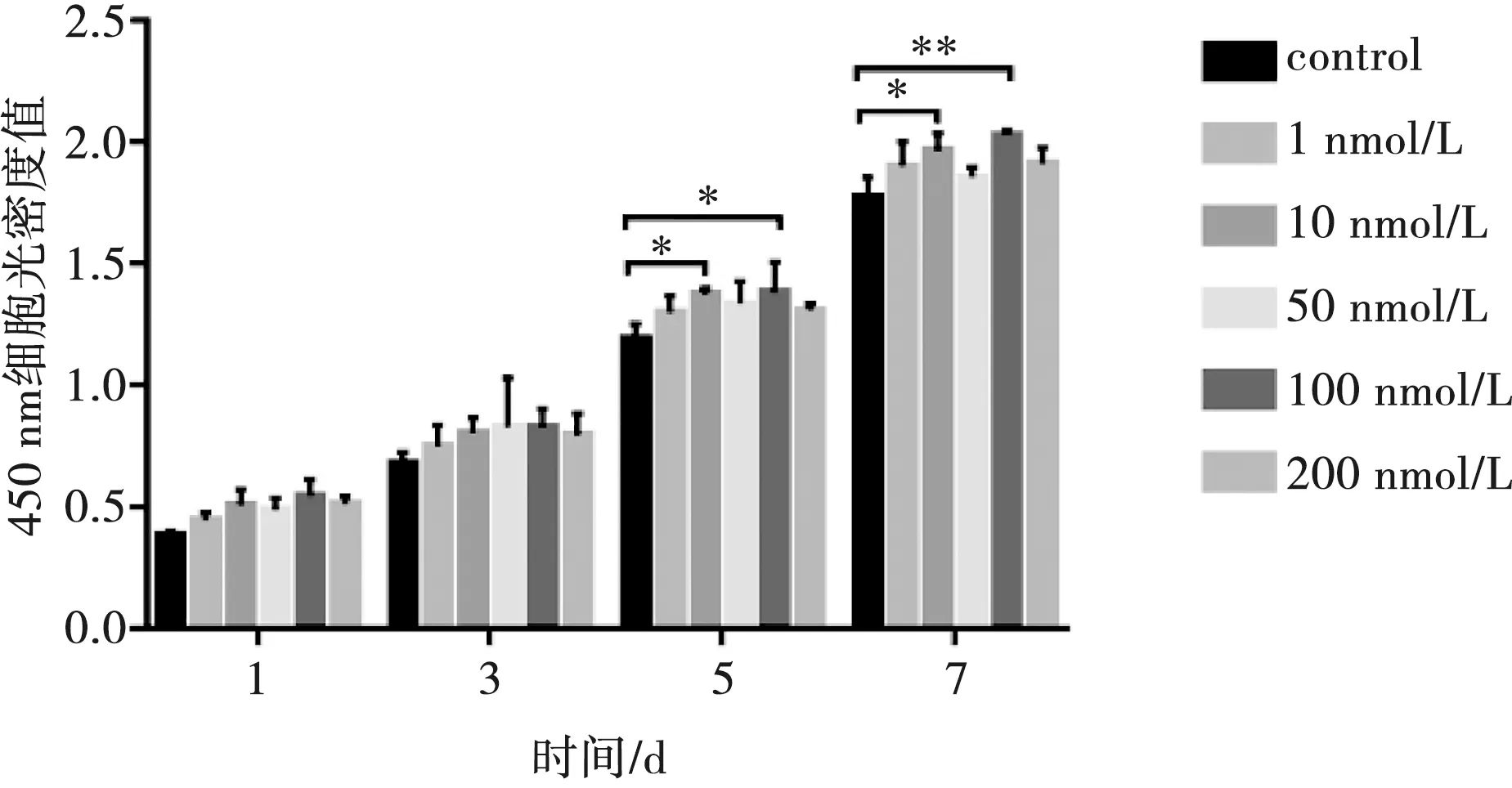
*:P<0.05;**:P<0.01
2.4 各组hDPSCs形态学观察
HE染色结果显示,对照组细胞形态呈典型的纺锤形或长梭形,贴壁好;而H2O2组细胞体积增大,失去原有的纺锤形形态,且细胞数目明显较对照组少;H2O2+RvE1组细胞变形程度轻于H2O2组,并且细胞数目较H2O2组多,但少于正常对照组。鬼笔环肽染色结果显示,与对照组相比,H2O2组细胞见不到清晰的肌动蛋白纤维,细胞内部失去清晰的网状结构,而H2O2+RvE1组细胞内部逐渐清晰,可见肌动蛋白纤维成网状排列(图4)。
2.5 各组hDPSCs增殖活性
cck-8检测结果可见hDPSCs经H2O2处理后,OD值显著下降,在第1天时比正常对照组降低31.2%(P<0.001);H2O2处理后给予RvE1处理,与H2O2组比较OD值明显增加(P<0.05),但是仍低于正常对照组,并且在第4天和第7天呈现相同的趋势(图5)。

a、b、c分别表示对照组、H2O2组、H2O2+RvE1组HE染色结果;d、e、f分别表示对照组、H2O2组、H2O2+RvE1组鬼笔环肽染色结果
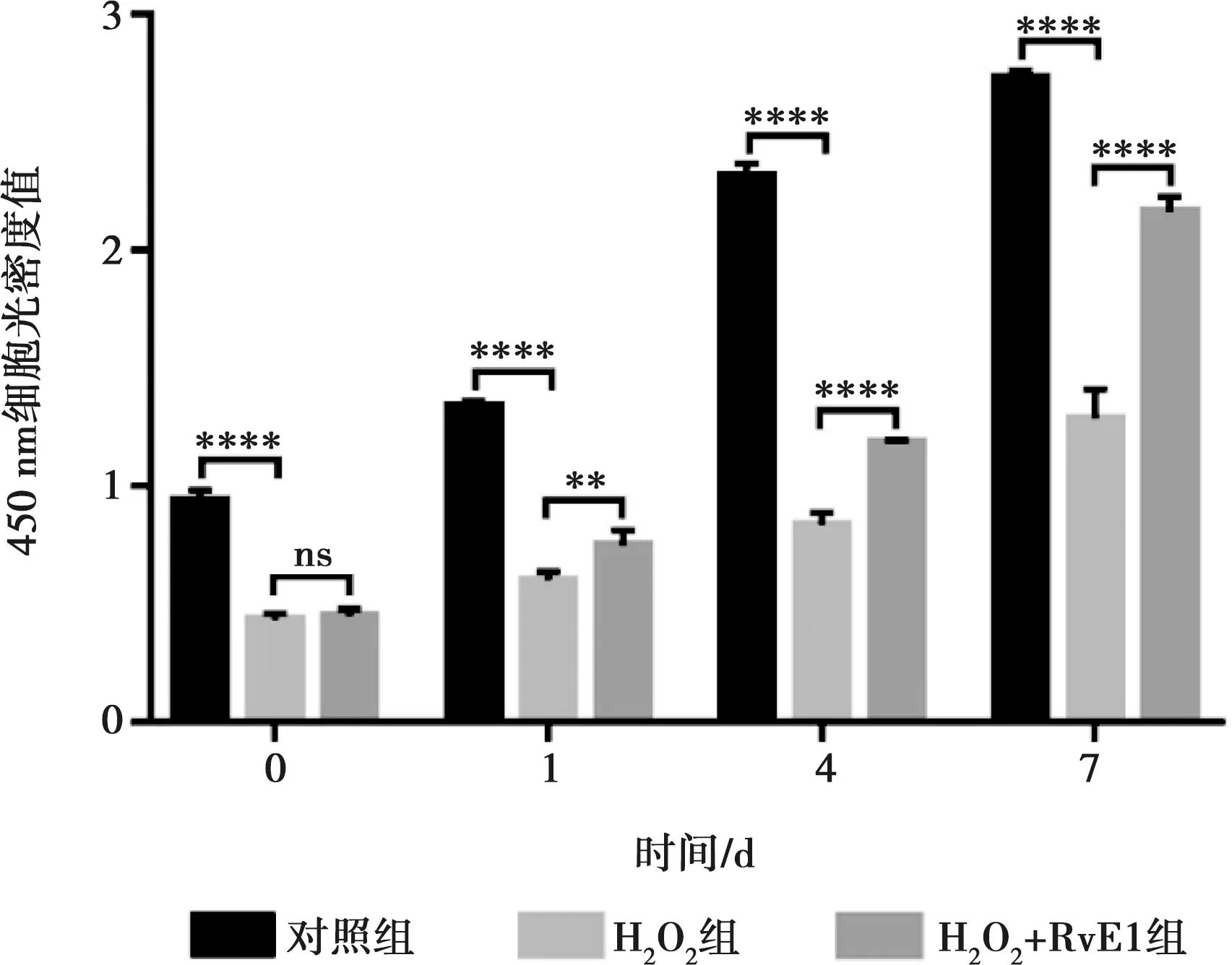
ns:P>0.05;**:P<0.01;****:P<0.000 1
2.6 各组hDPSCs迁移能力
划痕实验结果显示,在12 h和24 h时,H2O2组细胞迁移面积在12 h和24 h比对照组分别少了26.4%(P<0.001)和37.5%(P<0.001),而H2O2+RvE1组与H2O2组相比,细胞迁移面积分别在12 h和24 h增加了10.4%(P<0.001)和27.8%(P<0.001),但仍少于正常对照组(图6)。
2.7 各组hDPSCs成牙向分化能力
第7天的ALP染色结果显示,H2O2组细胞ALP阳性表达明显弱于正常对照组,而与H2O2组相比,H2O2+RvE1组细胞ALP阳性表达明显增强;对细胞染色结果通过Image J软件进行了半定量分析,结果显示,H2O2组细胞ALP阳性表达面积比对照组约低了24.0%(P<0.001),RvE1对过氧化氢诱导的hDPSCs氧化损伤起到了一定的挽救作用,使ALP阳性表达增加了11.5%(P<0.001)(图7)。
第7天的RT-qPCR结果显示,H2O2组细胞DMP1和DSPP基因表达水平明显低于正常对照组,而与H2O2组相比,H2O2+RvE1组细胞DMP1和DSPP基因表达水平明显升高(P>0.05)(图8)。

*:P<0.05;***:P<0.001;****:P<0.000 1;a、c、e分别表示对照组、H2O2组、H2O2+RvE1组在第7天ALP染色结果;b、d、f分别表示图a、图c、图e在24孔板中的全景图;g表示ALP染色的半定量结果;h表示各组细胞在第7天的ALP活性
3 讨 论
目前,体外分离培养人牙髓干细胞可作为研究牙髓干细胞生物学性能的经典模型。本研究通过流式细胞仪检测细胞表面抗原标志物及多向分化诱导进行鉴定,结果显示实验所分离培养的细胞是间充质组织来源,而非造血细胞来源。另外,我们对其成糖尿病宿主的氧化应激病理状态主要是活性氧在体内积聚过多导致的[13],H2O2是主要的活性氧之一,作为一种活性小分子,H2O2易于透过各种生物膜进入细胞内,发生反应并生成高活性的自由基,引发氧化应激[14],是糖尿病研究领域建立体外细胞氧化应激模型的经典刺激源[15]。高浓度(>300 μmol/L)的H2O2通过增加DNA碎片来降低细胞的存活率;而低浓度(100、200 μmol/L)的H2O2通过暂停细胞周期发挥调控作用,当H2O2浓度达到400 μmol/L时引起细胞死亡[16]。因此,本实验选用200 μmol/L H2O2处理来构建牙髓干细胞氧化应激微环境。研究结果也表明,H2O2诱导的氧化应激会导致hDPSCs氧化损伤,不仅表现在细胞会失去原有的细胞形态,其增殖、迁移和成牙向分化的能力也受到明显的抑制,这与Soares等报道[17]一致。

*:P<0.05;**:P<0.01;***:P<0.000 1;****:P<0.000 1;a:各组细胞在第7天DMP1的基因表达水平;b:各组细胞在第7天DSPP的基因表达水平骨及成脂向分化潜能进行了研究,在成骨诱导14 d后进行茜素红染色,发现有矿化结节形成,在成脂诱导21 d后,发现有脂滴形成,证明了我们提取的细胞是人牙髓干细胞。
RvE1是多不饱和脂肪酸衍生而来的新型抗炎促消退介质,具有抗炎促消退、促进成骨等多重作用[18],其抗氧化性是本实验研究的重点。结果表明,RvE1不仅可以恢复迁移及成牙向分化,对H2O2诱导的hDPSCs氧化损伤起保护作用。RvE1主要通过与其受体结合发挥生物学作用,其作用受体包括趋化样因子受体1(ChemR23)和白三烯B4受体1(BLT1)[19],单核细胞、中性粒细胞、巨噬细胞等免疫细胞和神经胶质细胞、肺成纤维细胞、脂肪细胞等基质细胞中均可见RvE1受体的表达,已有学者证实RvE1受体在牙髓成纤维细胞上也有表达[20],但是其在hDPSCs上的表达情况尚不清楚。因此,本研究首先检测了hDPSCs上RvE1受体的表达情况,结果显示ChemR23在其胞质内广泛表达,表明hDPSCs上存在RvE1的作用位点。鉴于上述实验结果,我们进一步探究RvE1对氧化损伤的hDPSCs形态学改变的作用,结果显示,加入RvE1的hDPSCs形态正常,数目增多,逐渐恢复其细胞内部网状结构。Hasturk等[21]证实,RvE1可以促进牙周膜干细胞、心肌干细胞等多种间充质干细胞的增殖,但关于其对hDPSCs作用尤其是氧化损伤的hDPSCs的作用尚罕见报道。本实验首次证实了RvE1可以促进氧化损伤的hDPSCs的增殖能力,因此推测H2O2组细胞数目相较于H2O2+RvE1组较少的原因可能是后者hDPSCs增殖能力增强的缘故,但不排除RvE1可能抑制了hDPSCs的部分凋亡,这需要进一步的实验证明。
综上所述,我们的研究结果为氧化应激导致的hDPSCs增殖、迁移及成牙向分化能力下降提供依据,并为RvE1在氧化应激病理状态疾病下活髓保存成为有潜力的治疗应用提供支持。因此,在临床接诊患有糖尿病这类氧化应激病理状态疾病患者时,应该更注意其牙髓状态的判断,并在诊疗过程中采取更合适的手段。
