高效絮凝菌的分离鉴定及其絮凝条件的优化
2021-01-05林映津陈倩曾小妹谢贻冬付洋
林映津 陈倩 曾小妹 谢贻冬 付洋



摘要 采用微生物分离纯化技术从底泥样品中筛选到一株絮凝菌,通过目标菌株的形态学特征和16S rRNA序列分析以鉴定其种屬,并对其发酵条件和絮凝条件进行优化。结果表明,XN1-4为黏质沙雷氏菌;XN1-4在发酵28 h后其发酵液的絮凝效果最好。菌株XN1-4的最佳培养条件为培养基初始pH 5.0、培养温度25 ℃、摇床转速150 r/min;最佳絮凝条件为发酵液投加量4%、助凝剂投加量4%。在最佳絮凝条件下,XN1-4的絮凝率达到98%,且絮凝活性成分主要存在于菌体本身。
关键词 絮凝菌;分离鉴定;培养条件;絮凝条件;优化
中图分类号 X52 文献标识码 A
文章编号 0517-6611(2021)24-0006-05
doi:10.3969/j.issn.0517-6611.2021.24.002
Isolation and Identification of High-efficiency Flocculating Bacteria and Optimization of Flocculation Conditions
LIN Ying-jin1,2,CHEN Qian1,ZENG Xiao-mei1,2 et al (1.Huachuan Technology Co.,Ltd.,Fuzhou,Fujian 350008;2.Fujian Engineering and Research Center of Ecological Restoration of Lake,Reseavoir & River Basin,Fuzhou,Fujian 350008)
Abstract Using microbial separation and purification technology,a flocculating bacteria was isolated from the sediment samples.The bacterial species were identified characterized based on morphological characteristics and 16S rRNA sequence analysis,and its fermentation and flocculation conditions were optimized.The results showed that the flocculating bacteria XN1-4 belonged to Serratia marcescens; strain XN1-4 had the best flocculation effect in the fermentation broth after cultured for 28 h.The optimal culture conditions of strain XN1-4 were the initial pH of the medium 5.0,the culture temperature of 25 ℃,and the rotating speed of the shaker 150 r/min;the optimal flocculation conditions were the fermentation broth dosage of 4% and the coagulant dosage of 4%.Under the optimal flocculation conditions,the flocculation rate of XN1-4 reached 98%,and the flocculating active components mainly existed in the bacteria itself.
Key words Flocculating bacteria;Isolation and identification;Culture conditions;Flocculation conditions;Optimization
基金项目 福州市科技计划项目(2019-S-110)。
作者简介 林映津(1965—),男,福建福州人,工程师,从事水污染生态与修复方面研究。
收稿日期 2021-04-20
随着社会经济的快速发展,人们生活水平的不断提高,日益凸显的河湖生态环境问题也越来越受到关注和重视。虽然,目前也采取了许多截污措施,但由于人口及工业的快速发展,水体富营养化等水生态环境问题仍然日益严重[1-3],许多地方的河流及湖泊均出现了不同程度的水体富营养化现象,藻类大量繁殖、水体透明度和溶解氧都明显降低[4],不仅严重影响了水体生态系统,而且严重危害了人类的身心健康[5]。因此,高效修复富营养化等被破坏的水体成为亟待解决的生态环境问题。然而,目前对富营养化等受到破坏的水体多采用物理或化学等方法,效果并不十分理想,并且容易产生二次污染等问题,因此,迫切需要寻找一种高效且不产生二次污染等问题的方法。
微生物絮凝剂是一类微生物在生长繁殖过程中代谢分泌产生的一种高分子活性物质[6],如蛋白质、多糖、脂类和核酸等[7-8],能够絮凝、沉降水体中的悬浮颗粒、色素等物质,具有安全高效、绿色环保、可生物降解等优点,不会引起二次污染[9-11]。陆洪省等[12]将絮凝菌SKDXN-1应用于富营养化水体的治理,该菌株处理富营养化水体10 d后,水中叶绿素a去除显著,去除率达89.10%,对水体总氮、总磷和COD的去除率分别为10.5%、15.6%和44.5%,具有一定的生态修复效果。但由于微生物絮凝剂在实际水污染治理应用方面存在用量大、成本高的问题[13],目前并没有被广泛应用于水体生态修复中,因此筛选高效絮凝剂产生菌、提高絮凝剂的絮凝效果、降低絮凝剂用量[14-15],是该领域当前研究的重点[16-17]。
目前,絮凝剂产生菌大多是从活性污泥、土壤、河流、深海等环境中筛选而来[18-19],以湖泊底泥为对象筛选絮凝菌的研究较少报道[20]。笔者以湖泊底泥为筛选对象,分离筛选到一株絮凝菌,通过形态学、生理生化以及16S rRNA进行菌种鉴定,并研究絮凝菌的最适培养条件和絮凝条件,为絮凝菌在水体生态修复中的应用奠定理论基础。
1 材料与方法
1.1 样品来源
现场利用柱状底泥采样器采集漳州市峰头水库浅层底泥,准确称取10 g浅层底泥样品于无菌的250 mL三角瓶中,加入适量无菌水和玻璃珠,在旋涡振荡器上充分振荡均匀。
1.2 培养基
富集培养基:牛肉膏 5 g、 蛋白胨 10 g、 氯化钠10 g,溶于蒸馏水中,调pH 7.2~7.4,定容至1 000 mL,121 ℃灭菌20 min。
分离培养基:在富集培养基的基础上加1.5% 的琼脂。通用发酵培养基:葡萄糖 20.0 g、KH2PO4 2.0 g、K2HPO4 5.0 g、 (NH4)2SO4 0.2 g、 NaCl 0.1 g、脲0.5 g、酵母膏 0.5 g、MgSO4·7H2O 0.2 g,溶于蒸馏水中,调pH 7.2~7.4,定容至1 000 mL,115 ℃灭菌30 min。
1.3 菌种富集与分离纯化
吸取10 mL充分混匀的样品溶液于装有100 mL富集培养基的 250 mL 三角瓶中, 30 ℃ 150 r/min 振荡培养48 h,待培养基浑浊后,再次转移10 mL溶液至新的富集培养基中,同等条件下振荡培养48 h,如此重复富集2~3次。取最终富集培养液,梯度稀释至1×10-6、1×10-7、1×10-8,分别取100 μL涂布于分离培养基上,30 ℃培养48 h。挑取表面光滑黏稠的单菌落, 于分离培养基上多次平板划线纯化直至得到单菌落,斜面保存备用。
1.4 高效絮凝菌的筛选
分别挑取已分离纯化的各菌株接种于装有100 mL 通用发酵培养基中,在 30 ℃、150 r/min 的条件下振荡培养 48 h后, 吸取2 mL菌液测定发酵液的絮凝活性,每次测定重复 3 次, 取平均值。
絮凝活性测定方法:取2 mL菌液、2 mL质量分数为1%的CaCl2溶液加入46 mL 0.4 g高岭土悬浮液中,置于磁力搅拌机上搅拌,控制条件为200 r/min下快搅1 min,然后100 r/min下慢搅3 min。静沉5 min,吸取上清液于550 nm下测定吸光度,同时以未接种的发酵培养基作为空白对照,确定菌株发酵液的絮凝活性。按照公式(1)计算絮凝率。
絮凝率=(A-B)/A×100%(1)
式中,A为未接种发酵培养基的OD550,B为样品的OD550,以蒸馏水做参比。
1.5 絮凝菌的鉴定
1.5.1 形态学鉴定和生化鉴定。
将筛选得到的菌种接种于营养琼脂培养基上, 在 30 ℃ 下培养 48 h, 对菌株进行革兰氏染色, 油镜下观察菌体形态。用富集培养基将菌株在 30 ℃ 下培养至对数生长期,将菌液按照无菌操作技术接入细菌生化鉴定管中, 30 ℃、150 r/min 条件下振荡培养 48 h 后观察记录结果。
1.5.2 16S rRNA基因序列的测定分析。
使用DNA提取试剂盒提取目标菌株的基因组DNA,采用16S rRNA基因通用引物扩增获得PCR产物,经电泳检测后,直接交由上海生工进行测序,要求双向测通。所得测序结果提交GenBank进行Blast序列比对分析。
1.6 絮凝菌的生长特性分析
将筛选获得的絮凝菌在富集培养基中活化培养24 h,作为种子液。取2%菌种液转接至通用发酵培养基中,培养温度为30 ℃,搖床转速为150 r/min,每隔4 h取样1次,取样时长为48 h,测定发酵液中的细菌密度(OD600)和絮凝率,以未接菌种液的培养液为对照。绘制菌株的生长曲线及絮凝率变化曲线,以确定最佳的发酵时间。
1.7 絮凝活性分布
吸取30 mL发酵液于50 mL离心管中,在5 000 r/min离心10 min,移取上清液至新的离心管中,用蒸馏水洗涤菌体沉淀2次,再用等体积的蒸馏水重悬菌体,制成细胞悬浮液。分别测定发酵原液(含细胞)、 上清液以及细胞悬浮液的絮凝率。
1.8 发酵条件优化
在其他培养条件不变(培养基初始pH为7.0,培养温度为30 ℃,转速为150 r/min)的基础上,以其中的一个单因素为变量,发酵培养48 h后取样测定絮凝率,分析不同培养条件对絮凝活性的影响,以得到目标菌株的最佳培养条件。①培养基初始pH:采用1 mol/L HCl和1 mol/L NaOH,将初始pH分别调为4.0、5.0、6.0、7.0、8.0、9.0。②培养温度:在上述已得到的最佳培养条件下,设定不同培养温度(20、25、30、35、40 ℃)。③转速:在上述已得到的最佳培养条件下,设定不同摇床转速(100、120、150、180、200 r/min)。
1.9 絮凝条件优化
在最佳培养条件下,探讨不同絮凝条件对目标菌株絮凝活性的影响,以确定最佳絮凝条件。①发酵液投加量:设定不同体积分数的发酵液投加量(1%、2%、3%、4%、5%)。②助凝剂投加量:设定不同体积分数的助凝剂投加量(1%、2%、3%、4%、5%)。
2 结果与分析
2.1 絮凝菌种筛选结果
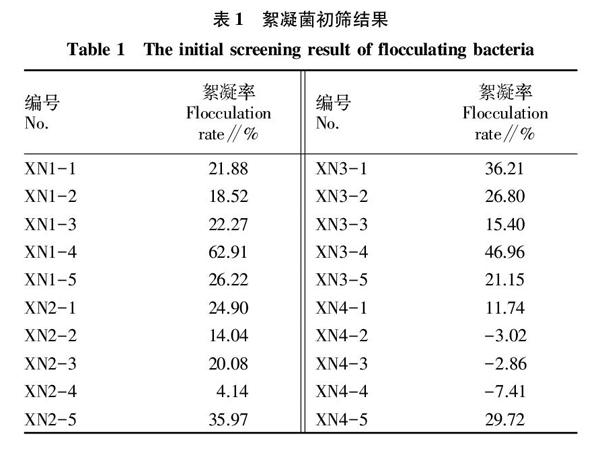
经富集、分离、纯化,从底泥样品中共分离出20株菌落表面光滑黏稠的菌株,其中有17株具有絮凝活性。由表1可知,XN1-4、XN2-5、XN3-1、XN3-4这4株的初筛絮凝率均超过30%,可作为复筛备用菌株。
将表1中筛出的4株絮凝活性较高的菌株进行复筛,测定絮凝率,每株重复3次,结果发现,
XN1-4、XN2-5、XN3-1、XN3-4的絮凝率分别为86.15%、42.60%、52.37%、57.14%,由此得到1株具有稳定高絮凝活性的微生物XN1-4,将其进行保种。
2.2 絮凝菌的鉴定
2.2.1 形态学和生理生化特征。
对菌株XN1-4进行了形态学和生理特征鉴定,结果见表2和图1。经检索常见细菌系统鉴定手册、伯杰细菌鉴定手册,XN1-4菌株的形态和生理生化特征与沙雷氏菌属一致。
2.2.2 16S rRNA基因序列的测定分析。
絮凝菌XN1-4的基因组DNA经提取后进行16S rRNA全长扩增,琼脂糖凝胶电泳结果见图2。扩增的16S rRNA片段经测序后得到长度为1 441 bp的基因序列,将基因序列提交GenBank进行Blast分析比对,结果显示(图3),XN1-4与黏质沙雷氏菌UMH2(Serratia marcescens strain UMH2)的序列有99%的同源性。根据菌株的生理生化试验结果和16S rRNA基因序列的测定结果,可以鉴定其为黏质沙雷氏菌(Serratia marcescens)。
2.3 絮凝菌的生长特性
从图4可以看出,XN1-4菌体均在接种的4 h后进入对数生长期,并且一直持续到20 h,接种后第20小时开始进入稳定期,一直持续到48 h。同时,XN1-4菌体在接种后的2 h开始合成絮凝物质,但此时菌体密度较低,因此生成的絮凝物质较少,絮凝率较低;随着培养时间的延长,絮凝率不断增加,其中,XN1-4菌体在接种的第28小时达到最大值,此时絮凝率为94.67%,之后絮凝率开始略微下降。这是由于发酵体系中产生的解絮凝酶和细菌内源呼吸引起的。由此可知,菌株XN1-4的最佳发酵时间为28 h。
2.4 絮凝活性分布
分别测定了菌株的发酵原液、上清液以及菌体细胞悬浮液的絮凝率,结果见图5。从图5可以看出,XN1-4菌体细胞悬浮液的絮凝率为98.14%,而上清液的絮凝率仅只有19.69%,这表明絮凝菌XN1-4的絮凝活性成分主要分布在菌体细胞本身,分泌到细胞外的活性成分很少。
2.5 发酵条件优化
2.5.1 培养基初始pH对絮凝效果的影响。
由图6可知,XN1-4絮凝生长的pH适应范围为4.0~9.0,当发酵培养基的初始pH为4.0~6.0时,菌体的絮凝活性较高;当初始pH达到5.0时,菌体的絮凝率最高,达96.45%;而当初始pH超过6.0时,随着初始pH不断增加,絮凝活性也随之降低。因此,培养基初始pH设定为5.0。
2.5.2 培养温度对絮凝效果的影响。
由图7可知,当XN1-4的培养温度为20~25 ℃时,随着温度的升高,菌株的絮凝率也升高,温度处于25 ℃时的絮凝率达到最高,为97.63%;而超过这一范围,随着温度的继续升高,絮凝率反而不断下降。因此,XN1-4的最适发酵温度为25 ℃。
2.5.3 转速对絮凝效果的影响
由图8可知,当摇床的转速为100~150 r/min时,随着转速的增加,XN1-4发酵液的絮凝率不断增加;转速达到150 r/min时,发酵液的絮凝活性最大,絮凝率为97.61%;而当转速由150 r/min继续增加到200 r/min 时,XN1-4的絮凝率却开始下降。因此,摇床的最适转速为150 r/min。
2.6 絮凝条件优化
2.6.1 发酵液投加量对絮凝效果的影响。
由图9可知,絮凝菌的发酵液存在最适的投加量,当发酵液投加量处于1%~4%时,XN1-4菌株的絮凝率随着投加量的增加而逐渐增大,XN1-4在投加量为4%时,絮凝率达到最大(97.65%);随着投加量的继续增加,絮凝率开始呈现下降趋势。因此,XN1-4菌株发酵液的最适投加量为4%。
2.6.2 助凝剂投加量对絮凝效果的影响。
由图10可知,当助凝剂CaCl2的投加量为1%~4%时,XN1-4的絮凝率随着投加量的增加而有明显的增大,当CaCl2的投加量达到4%时,菌株的絮凝率达到最大,为97.60%;当CaCl2的投加量继续增大时,菌株的絮凝率开始轻微下降。因此,助凝剂的最适投加量为4%。
3 讨论
目前,从自然界中分离所得的絮凝菌多为红平红球菌(Rhodococcus erythopolis)、芽孢杆菌属(Bacillus sp.)、类芽孢杆菌属(Paenibacillus sp.)、假单胞菌属(Pseudomonas sp.)、土壤杆菌属(Agrobacterium sp.)、不动杆菌属(Acinetobacter sp.)、曲霉属(Aspergillus sp.)等[21-23]。该研究从湖泊底泥中分离得到一株具有高效絮凝活性的菌株XN1-4,并经过形态学特征、 生理生化反应及 16S rRNA 序列同源性比对, 鉴定该菌為黏质沙雷氏菌。
黏质沙雷氏菌属于革兰氏阴性菌,兼性厌氧,在 25~30 ℃条件下培养,可形成圆形、光滑、不透明的菌落,该研究筛选到的黏质沙雷氏菌其活性成分主要分布在菌体细胞本身,这与酵母、放线菌等微生物的絮凝机理类似,均是直接利用微生物细胞作为絮凝剂参与絮凝反应[24]。此外,黏质沙雷氏菌的次生代谢产物——灵菌红素不仅具有抗菌、抗疟疾、抗肿瘤等生理活性[25],而且具有强烈的细胞溶解酶活性[26],对水华鱼腥藻、铜绿微囊藻、微小平裂藻和赤潮异弯藻有很高的致死性,并且在强光下可完全分解,不产生二次污染,因此是应急控藻和富营养化水体生态修复的优良选择[27-32]。
研究表明,微生物的培养条件对菌体细胞生长以及絮凝活性物质的生成有一定的影响,如改变絮凝菌的培养温度、培养基初始pH和摇床转速等条件,均会改变絮凝活性物质的合成过程,从而影响絮凝效果。
培养基初始pH不仅会影响菌体细胞表面的电荷状态,还会影响培养基中有机物的离子化,导致有机物与微生物细胞表面的吸附作用发生变化,进而影响微生物对有机物的利用。同时,在微生物合成絮凝物质中起催化作用的酶只有在最适pH条件下才能发挥其最大的催化活性[33]。该研究中,菌株XN1-4在培养基初始pH为4~6时,均能保持90%以上的絮凝活性,当初始pH达到5.0时的絮凝效果最好。
培养基的温度主要通过影响细胞内酶活性及其催化反应的速率来影响菌体絮凝物质的合成,从而影响絮凝效果。温度较低时,微生物生长代谢缓慢,生物酶活性降低,影响了絮凝物质的生成;而温度较高时,可能破坏了酶蛋白的结构和功能,使酶活降低或失活,从而影响细胞代谢进而影响絮凝物质的生成,降低絮凝活性[34]。该研究中,菌株XN1-4的培养温度为25~35 ℃时,菌株能保持75%以上的絮凝活性,其最适培养温度是25 ℃。
摇床转速主要是通过影响微生物的耗氧量来影响微生物的生长繁殖和絮凝物质的合成。合适的转速可以满足微生物对氧气的需求,也能防止菌体因黏附在一起,而影响正常的生长繁殖和絮凝物质的生成。该研究中,当摇床转速达到150 r/min时,菌株XN1-4的絮凝活性最大,但超过这一转速后,絮凝率却开始下降,这与吴敬荣等[35]的研究结果一致,其主要原因是转速过高时,培养基中溶解氧的增加使微生物细胞的生长繁殖速度加快,消耗了大量的营养物质,从而降低絮凝物质的合成,导致絮凝活性降低。
此外,絮凝菌的絮凝活性还受到发酵条件的影响,该研究针对絮凝菌发酵液的投加量和助凝剂的投加量进行了优化。发酵液作为絮凝体系的主体,其投加量将直接影响最终的絮凝效果和处理成本。该研究中发酵液的最适投加量是4%,当发酵液投加量较少时,絮凝作用达不到最佳的效果;而当发酵液过量时,高分子物质将胶体粒子包裹起来,影响了体系中脱稳作用和凝聚作用,使得絮凝效果变差[36]。在絮凝体系中添加适量的助凝剂可以有效提升絮凝效果,这是因为助凝剂CaCl2中的Ca2+可以中和胶体粒子表面的负电荷,减少胶体粒子之间的作用力,絮凝剂与胶体粒子碰撞之后能快速降低胶体表面的电位,使得胶体粒子脱稳并形成较大聚团而沉降下来。该试验中助凝剂CaCl2的投加量达到4%时,絮凝率最大;当CaCl2的投加量继续增大时,体系中过多的Ca2+离子会抢占絮凝分子的结合位点,使絮凝分子不能够与胶体粒子结合从而降低了絮凝效果[37-38]。
4 结论
该研究从漳州峰头水库底泥中分离到一株具有高絮凝活性的菌株XN1-4,经鉴定为黏质沙雷氏菌,其活性成分主要分布在菌体细胞本身,最佳培养条件为培养基初始pH 5.0、培养温度25 ℃、摇床转速150 r/min;最佳絮凝条件为发酵液投加量4%、助凝剂投加量4%,在此条件下,XN1-4的絮凝率可达98%。该研究不仅为研究絮凝微生物提供了良好的菌种资源,同时也为絮凝菌在水体生态修复中的应用奠定了基础。
参考文献
[1] LU Q Y,XIN W,NIE J L,et al.Present situation of eutrophication of landscape water body and its prevention and control measures[J].Asian agricultural research,2019,11(3):41-44.
[2] 刘飞.江阴城区黑臭水体调查及成因分析[C]//2020年(第八届)中国水利信息化技术论坛文集.北京:北京沃特咨询有限公司,2020:501-506.
[3] 陆洪省,曹晓强,昭日格图,等.水体富营养化控制的研究进展[J].环境研究与监测,2012(1):71-73.
[4] 金相灿,朱萱.我国主要湖泊和水库水体的营养特征及其变化[J].环境科学研究,1991,4(1):11-20.
[5] 孙霞,刘扬,王芳,等.固定化微生物技术在富营养化水体修复中的应用[J].生态与农村环境学报,2020,36(4):433-441.
[6] 沈永红,薛玉,刘宇鹏,等.高效微生物絮凝剂产生菌的筛选及复合菌群培养研究[J].河南大学学报(自然科学版),2015,45(3):334-338.
[7] PI S S,QIU J G,LI A,et al.Applied microbiology and biotechnology uncovering the biosynthetic pathway of polysaccharide-based microbial flocculant in Agrobacterium tumefaciens F2[J].Applied microbiology and biotechnology,2020,104(19):8479-8488.
[8] FU L L,JIANG B H,WEI J W,et al.Transcriptome analysis of polysaccharide-based microbial flocculant MBFA9 biosynthesis regulated by nitrogen source[J].Scientific reports,2020,10(1):1-10.
[9] 宋永慶,张龙,李南华,等.絮凝菌的筛选、培养条件优化及对屠宰场废水的处理[J].安全与环境学报,2016,16(3):211-215.
[10] 司晓光,张晓青,杜瑾,等.微生物絮凝剂产生菌的选育及发酵罐放大试验研究[J].化学与生物工程,2020,37(1):34-37.
[11] 栾丽杰,郑小菊,杨永涛.一株煤泥水微生物絮凝剂产生菌的筛选及鉴定[J].煤炭加工与综合利用,2018(5):10-12.
[12] 陆洪省,施耐克.微生物絮凝剂产生菌SKDXN-1的鉴定及其对富营养化水体的处理研究[J].内蒙古农业大学学报(自然科学版),2013,34(6):81-85.
[13] 李梦茜,蔡承儒,甘国源,等.一株假单胞菌的分离鉴定及其产絮凝剂絮凝特性的研究[J].食品工业科技,2020,41(21):122-127.
[14] YANG M Y,HAN F,TIAN J,et al.Screening of a microbial flocculant producing silicate bacteria MT5-2 and its flocculating activity[J].Advanced materials research,2012,599:3-8.
[15] 冯健玲,姚晓华,韦秉兴,等.稻草秸秆纤维素分解菌的分离筛选[J].基因组学与应用生物学,2009,28(3):477-480.
[16] 黄雅玲,强微,邱成书.微生物絮凝剂产生菌的筛选及絮凝特性的研究[J].贵州科学,2017,35(6):5-9.
[17] 李娜,范祎立,李雪,等.1株微生物絮凝剂产生菌的分离、鉴定与絮凝剂的成分分析[J].江苏农业科学,2019,47(13):288-292.
[18] 李潭,赵弘毅,王静,等.一株絮凝剂产生菌的筛选鉴定和培养条件优化[J].广西大学学报(自然科学版),2015,40(5):1305-1313.
[19] SALEHIZADEH H,YAN N.Recent advances in extracellular biopolymer flocculants[J].Biotechnology advances,2014,32(8):1506-1522.
[20] 朱丹,楊琳,苏鸿雁.洱海底泥絮凝剂产生菌分离及培养条件优化研究[J].大理学院学报,2010,9(10):43-45.
[21] GOMAA E Z.Production and characteristics of a heavy metals removing bioflocculant produced by Pseudomonas aeruginosa[J].Polish journal of microbiology,2012,61(4):281-289.
[22] 程艳茹,龚继文,封丽,等.水处理中微生物絮凝剂产生菌的选育及应用[J].环境监测管理与技术,2019,31(2):6-10,46.
[23] 张晓飞,孙云龙,韩国红,等.一株絮凝剂产生菌死谷芽孢杆菌Z11的筛选和鉴定[J].工业微生物,2020,50(6):18-24.
[24] 马放,段姝悦,孔祥震,等.微生物絮凝剂的研究现状及其发展趋势[J].中国给水排水,2012,28(2):14-17.
[25] GOHIL N,BHATTACHARJEE G,SINGH V.Synergistic bactericidal profiling of prodigiosin extracted from Serratia marcescens in combination with antibiotics against pathogenic bacteria[J/OL].Microbial pathogenesis,2020,149[2020-11-05].https://doi.org/10.1016/j.micpath.2020.104508.
[26] 王伊娜,王向东,张望,等.制酒废水培养复合型生物絮凝剂产生菌的研究[J].中国给水排水,2007,23(1):38-42.
[27] 刘伯雅,魏东芝,鲁思然,等.灵菌红素对有害藻类的除藻活性研究[J].中国环境科学,2010,30(4):477-482.
[28] LIU W J,YANG J,TIAN Y N,et al.An in situ extractive fermentation strategy for enhancing prodigiosin production from Serratia marcescens BWL1001 and its application to inhibiting the growth of Microcystis aeruginosa[J].Biochemical engineering journal,2020,166:1-10.
[29] ZHANG H J,WANG H,ZHENG W,et al.Toxic effects of prodigiosin secreted by Hahella sp. KA22 on harmful alga Phaeocystis globosa[J].Frontiers in microbiology,2017,8:1-12.
[30] ZHANG H J,PENG Y,ZHANG S,et al.Algicidal effects of prodigiosin on the harmful algae Phaeocystis globosa[J].Frontiers in microbiology,2016,7:1-9.
[31] ZHANG S,ZHENG W,WANG H.Physiological response and morphological changes of Heterosigma akashiwo to an algicidal compound prodigiosin-ScienceDirect[J/OL].Journal of hazardous materials,2020,385[2020-11-05].https://doi.org/10.1016/j.jhazmat.2019.121530.
[32] WEI J,XIE X,HUANG F Y,et al.Simultaneous Microcystis algicidal and microcystin synthesis inhibition by a red pigment prodigiosin[J].Environmental pollution,2020,256:1-7.
[33] 宫小燕,栾兆坤,王曙光,等.微生物絮凝剂絮凝特性的研究[J].环境化学,2001,20(6):550-556.
[34] 张鲁新.一株产絮凝剂菌种的筛选及其在猪场污水净化中的应用[D].合肥:安徽农业大学,2016.
[35] 吴敬荣,王广军,李志斐,等.一株絮凝剂产生菌的分离鉴定及其絮凝条件优化[J].西北农林科技大学学报(自然科学版),2017,45(1):175-184.
[36] 武晓畅,郑靖凡,李日强,等.微生物絮凝剂产生菌的鉴定及絮凝特性研究[J].山西大学学报(自然科学版),2019,42(2):435-442.
[37] 李婵娟,严鹤松.微生物絮凝剂产生菌的筛选及其絮凝特性研究[J].湖北农业科学,2014,53(14):3283-3286.
[38] 杨莹,马放,李芬,等.生物絮凝剂的絮凝形态及影响因素[J].东北林业大学学报,2009,37(12):91-94.
