超高效液相色谱-三重四极杆质谱法检测油脂和油炸食品中7种杂环胺类物质
2020-12-25张晨霞马宇翔赵天培史莉莉汪学德
张晨霞,马宇翔,赵天培,席 俊,李 潘,郭 庆,史莉莉,汪学德
(河南工业大学粮油食品学院,河南 郑州 450001)
杂环胺(heterocyclic aromatic amines,HCAs)是高温加工蛋白质丰富的食品时形成的一类致癌性、致突变性化合物[1-3],主要存在于油炸烧烤食品。HCAs在代谢过程中环外氨基经酶催化形成N-羟基衍生物,并进一步与DNA共价结合形成加合物。鼠伤寒沙门氏菌回复突变试验表明,HCAs有较强的致突变性[4-7]。长期动物实验证明,HCAs有致癌性,可以引起啮齿动物体内多种器官产生肿瘤,包括肝脏[4,8]、结肠[9]、乳腺[9,10]、大小肠[11]和胃[12]等。目前为止,分离和鉴定出超过25种HCAs。HCAs可以分为极性和非极性两类。极性杂环胺是碳水化合物、氨基酸和肌酸酐(肌酐)在150~250 ℃下形成的氨基喹喔啉类、氨基喹啉类和氨基吡啶类等化合物,而非极性HCAs是氨基酸在250 ℃下高温分解产生的咔啉类和苯基吡啶类化合物[13,14]。
目前还没有充足证据证明HCAs在人体器官中能诱导肿瘤细胞生成,但流行病学研究表明,高HCAs含量肉制品的食用与不同癌症之间有直接的相关性[15,16]。Wolk[17]强调50 g/d的加工肉制品的摄入可以增加患癌的可能性,患前列腺癌、结肠癌、乳腺癌和胰腺癌的风险分别增加4%、18%、9%和19%,其与加工肉制品中杂环胺类物质有关。虽然HCAs还没有标准限量的规定,但是国内外学者对HCAs的研究日益增多,主要集中在加工肉制品中HCAs的生成规律[18]和抑制作用研究[1,19]。
油脂和油炸食品的安全性备受关注,但目前针对油脂和油炸食品中HCAs的研究较少[18-23]。现在国外对油脂和油炸食品中极性组分、多环芳烃和杂环胺等有害物质的重视程度极高,并在HCAs生成的模拟体系中发现油脂氧化产物可以促进HCAs生成[20,24],因此,在油脂及油炸食品中HCAs的研究十分必要。
HCAs是弱碱性化合物,具有低挥发性、高水溶性,部分HCAs缺乏紫外生色团结构,还有部分HCAs没有荧光特性[25],故HCAs的检测方法一直是研究的难点。随着液相色谱-质谱法在食品中的应用,大多研究者采用该方法对HCAs进行检测[26-29]。GB 5009.243-2016标准适用于烤鱼、烤肉及其制品中HCAs的检测,采用氢氧化钠的甲醇溶液提取,苯乙烯二乙烯基苯共聚物固相萃取柱净化,其回收率为63.3%~124%,精密度为6.26%~18.2%。但目前还未有油脂和油炸食品中HCAs的检测标准[25]。油炸食品基质复杂,HCAs种类多,含量低[11],关于油炸食品中HCAs的检测方法一直是研究的重点和难点。目前油炸食品中HCAs的检测方法较少,油脂中HCAs的检测方法还未见报道。因此,本文通过碱性有机溶剂萃取,建立了超高效液相色谱-三重四极杆质谱测定油脂和油炸食品中HCAs含量的方法,为市场上油脂和油炸食品的含量水平检测提供方法依托,同时也为评价油脂和油炸食品的安全性提供实验依据。
1 实验部分
1.1 仪器、试剂与材料
Acquity UPLC CLASS超高效液相色谱仪、Xevo TQD三重四极杆质谱仪,配电喷雾电离(ESI)源(美国Waters公司);ME204E电子天平(感量0.1 mg)、XPE26DR电子天平(感量0.01 mg)(瑞士Mettler Toledo公司);Multipette E3x电动移液器(德国Eppendorf公司);FM 200间歇式高剪切均质机(德国Fluko公司);MTN-2800W氮吹浓缩仪(天津奥特赛恩斯仪器有限公司);Visiprep DL真空固相萃取装置(美国Supelco公司);摩尔细胞型超纯水器(电阻18.25 MΩ·cm)(重庆Molecular水处理设备有限公司)。
HCAs标准品(纯度>98%):2-氨基-3-甲基咪唑并[4,5-f]喹啉(IQ)、2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉(MeIQ)、2-氨基-3,8-二甲基咪唑并[4,5-f]喹喔啉(MeIQx)、2-氨基-3,4,8-三甲基咪唑并[4,5-f]喹喔啉(4,8-DiMeIQx)、2-氨基-3,4,7,8-四甲基咪唑并[4,5-f]喹喔啉(4,7,8-TriMeIQx)(内标物)、2-氨基-1-甲基-6-苯基-咪唑并[4,5-b]吡啶(PhIP)、1-甲基-9H-吡啶并[3,4-b]吲哚(Harman)、9H-吡啶并[3,4-b]吲哚(Norharman)购自上海源叶生物科技有限公司;乙腈、甲醇、正己烷(色谱纯,美国Sigma公司);甲酸铵(LC-MS级,美国Thermo Fisher公司);氨水(纯度25.0%~28.0%)、浓盐酸(纯度36.0%~38.0%)(天津科密欧试剂有限公司);超纯水为实验室自制。
1.2 标准溶液的配制
分别称取8种HCAs的标准品(精确至0.01 mg),置于10 mL棕色瓶中,用甲醇配制质量浓度为100 mg/L的单标准储备液,于-40 ℃储存。根据检测样品中HCAs的测定要求,用甲醇分别稀释成含20 μg/L内标物4,7,8-TriMeIQx的系列混合标准工作液,其中IQ、MeIQ、MeIQx、4,8-DiMeIQx稀释梯度为0.25、0.5、1、2、5、10、20 μg/L,PhIP、Harman、Norharman为1、2、5、10、25、50、100 μg/L,于-20 ℃棕色瓶中保存。
内标工作液:取4,7,8-TriMeIQx单标准储备液,用甲醇配制成500 μg/L的内标工作液,于-20 ℃棕色瓶中保存。
1.3 样品前处理
1.3.1提取
油炸食品:称取2 g试样(精确至0.01 g),置于50 mL聚丙烯离心管中,加入80 μL内标工作液、10 mL含1% (体积分数)氨水的乙腈溶液,以10 000 r/min均质提取1 min,以3 500 r/min离心5 min,收集上清液于另一个离心管中,再加入10 mL含1%(体积分数)浓氨水的乙腈溶液重复提取一次,合并两次上清液,加入10 mL乙腈饱和的正己烷脱脂,取10 mL提取液待净化。
油脂:称取1 g试样(精确至0.01 g),置于50 mL聚丙烯离心管中,加入80 μL内标工作液、10 mL含1% (体积分数)氨水的乙腈溶液,涡旋混合5 min,超声10 min,以3 500 r/min离心5 min,收集上清液于另一个离心管中,再加入10 mL含1%(体积分数)氨水的乙腈溶液重复提取一次,合并两次上清液,加入10 mL乙腈饱和的正己烷脱脂,取10 mL脱脂后的提取液待净化。
1.3.2净化
将10 mL提取液,上样于预先用3 mL甲醇、3 mL超纯水活化的PCX固相萃取柱,上样速度为1 mL/min,然后用3 mL 0.1 mol/L盐酸和3 mL甲醇淋洗,淋洗后抽干1 min,用3 mL甲醇-氨水(95∶5,v/v)洗脱,收集全部洗脱液,于45 ℃氮吹至近干,用500 μL甲醇复溶,过0.22 μm有机滤膜,待测定。
1.4 UPLC-ESI-MS/MS分析
色谱柱:Waters ACQUITY UPLC BEH C18柱(50 mm×2.1 mm,1.7 μm);柱温:20 ℃;流动相:A为10 mmol/L甲酸铵溶液(pH=6.80),B为乙腈;流速:0.3 mL/min。梯度洗脱程序:0~0.2 min,10%B;0.2~1.0 min,10%B~30%B;1.0~3.0 min,30%B~60%B;3.0~3.5 min,60%B~90%B;3.5~5.0 min,90%B。进样体积:1 μL。
离子源:ESI源,正离子模式;离子源温度:110 ℃;毛细管电压:0.5 kV;脱溶剂温度:650 ℃;脱溶剂气(N2,纯度99.9%)流速:1 000 L/h;锥孔气(N2,纯度99.9%)流速:50 L/h;碰撞气:氩气,纯度99.9%。采用多反应监测模式进行检测,其他质谱参数见表1。
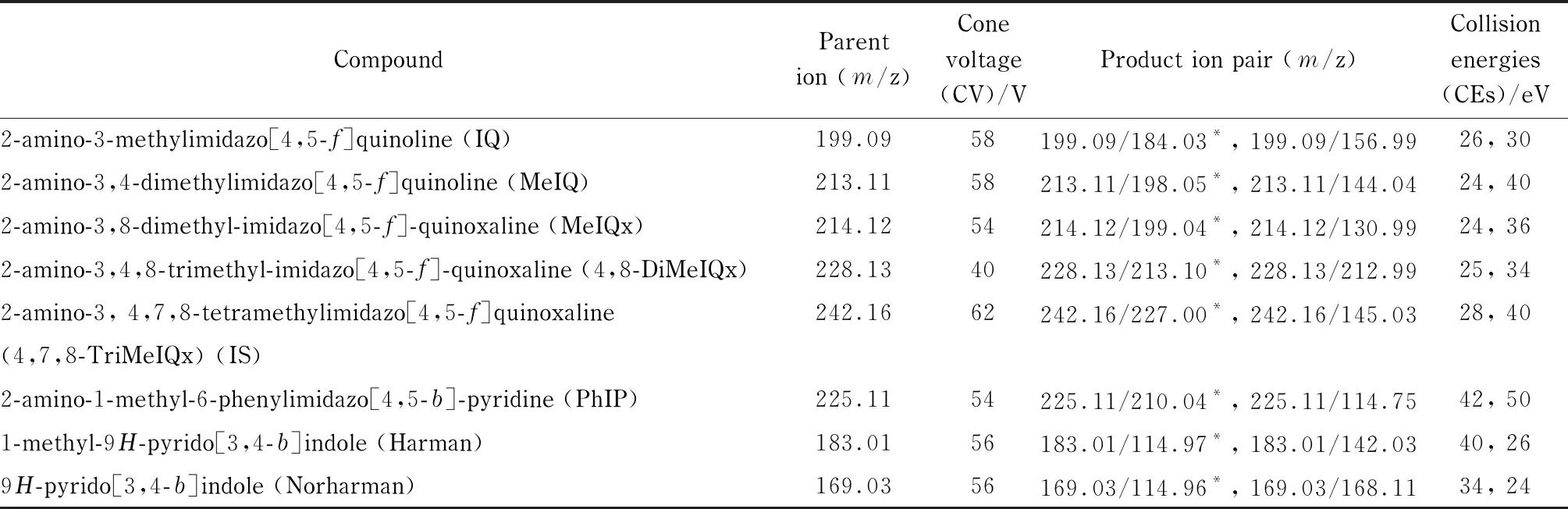
表1 7种HCAs的质谱参数Table 1 MS parameters of the seven heterocyclic aromatic amines (HCAs)
* Quantitative ion.
2 结果与讨论
2.1 质谱条件的优化
首先将质量浓度为500 μg/L的杂环胺化合物标准溶液在正离子模式下进行母离子全扫描,然后根据Masslynx 4.1自动调谐功能进行调谐,在MRM模式下优化各种质谱参数,得到最佳质谱条件,7种HCAs的质谱参数见表1。
2.2 流动相条件的优化
流动相的选择显著影响HCAs在色谱柱上的分离和保留行为。8种HCAs均为弱碱性化合物,其在流动相中的解离能力和溶解性随着流动相的变化而变化。有文献[30,31]报道,在流动相中添加有机酸盐,如甲酸铵和乙酸铵等可以提高HCAs的离子化效率,改善峰形,提高灵敏度。本研究考察了在流动相中添加甲酸铵对HCAs分离效果的影响。结果发现,10 mmol/L甲酸铵溶液能使 7 种HCAs的响应值增加,得到的色谱峰峰形较窄,峰对称性良好。
有文献[25]表明,有机酸,如甲酸、乙酸等的添加可以增加HCAs的离子化效率,同时影响色谱柱填料与HCAs之间的作用力,使得HCAs的保留时间缩短。为了进一步缩短分析时间,本实验考察在流动相中添加甲酸对HCAs分离效果的影响。结果发现,IQ、MeIQx的色谱峰峰形较宽,色谱峰发生重叠,其原因可能是甲酸的添加使得色谱柱对IQ、MeIQx两种物质的保留能力较弱。
综合考虑,最终选择10 mmol/L甲酸铵溶液作为流动相中的水相,得到的色谱峰峰形尖锐,对称性好,在5 min内可实现对HCAs的快速分离。
2.3 提取和净化条件的优化
油脂和油炸食品成分复杂,其中HCAs的含量较低,在对HCAs分析时,通常需对样品进行萃取、富集和净化等前处理操作。
固相萃取方法被广泛应用于样品净化操作。为了达到较佳的净化效果,Gross和Grüter[14]使用丙基磺酸阳离子固相萃取柱和C18小柱串联对提取液富集净化,可以完成对极性和非极性HCAs的分离,但两个固相萃取柱串联的净化操作成本较高,过程繁琐,且溶液转移时易造成损失,对操作要求严格。混合阳离子交换小柱,填料为改性的苯乙烯-二乙烯苯共聚物,对碱性和中性化合物有着很好的选择性,广泛应用于食品基质中目标产物的检测。本实验分别考察了PCX (60 mg/3 mL)、MCX (60 mg/3 mL)和Lichrolut EN®(60 mg/3 mL)固相萃取柱对HCAs回收率的影响。Lichrolut EN®属于苯乙烯二乙烯基苯共聚物固相萃取柱,对极性有机物有较强的吸附能力,但是对7种HCAs的回收率较低,可能与所选洗脱溶剂关。PCX和MCX小柱属于混合阳离子交换柱,吸附目标性较强,对7种HCAs的回收率分别为80.40%~99.60%和74.01%~89.36%,相对来说,采用PCX小柱时HCAs的回收率更高。因此,实验最终确定PCX柱对样品溶液进行净化,可以较好去除极性和非极性物质,达到净化要求的同时可获得较高的回收率。
HCAs易溶于水和有机溶剂。常用的提取溶液有NaOH、乙腈、乙酸乙酯、二氯甲烷等[32,33]。油脂及油炸食品中脂肪含量较高,提取溶液的选择极其重要。选择的提取溶液既要对HCAs有较高的提取效率,又要在提取过程中易与基质分离,有利于后续固相萃取操作。乙腈被认为是一种极性中等偏强的有机溶剂(极性系数为5.8),乙腈与甘三酯类物质不互溶或者微溶,常用于油脂中有害物质的提取,如多环芳烃和杂环胺[34,35],同时具有较低的黏度和密度,更加有利于样品中固体杂质与提取溶液的分层,便于分离操作。Yan等[34]用乙腈提取HCAs时,加标回收率仅为42.5%~99.0%,需要进行优化。杂环胺为碱性物质,其回收率取决于提取溶液的pH值。随着提取溶液pH值的增加,杂环胺的去离子化程度增大,疏水性加强,其在有机溶剂中的溶解度增大,从而提高杂环胺的回收率[27]。郭海涛等[27]研究了提取溶液NaOH溶液的浓度变化对HCAs的影响,发现随着NaOH浓度的增加,极性和非极性杂环胺的回收率呈上升趋势。Zhang等[31]表明IQ、MeIQ、MeIQx和4,8-DiMeIQx在提取溶液偏碱性(pH值为7.0~8.5)时的回收率高。

图1 提取溶剂对HCAs回收率的影响(n=3)Fig.1 Effect of extraction solvents on the recoveries of the HCAs (n=3) ACN:acetonitrile;alkalized ACN:ACN containing 1% (v/v)ammonia water;oil:soybean oil;food:fried chicken breast.
本文考察了乙腈和含1%(体积分数)氨水的乙腈溶液作为提取溶液时油脂和油炸食品中HCAs的提取效率(见图1)。结果显示,采用乙腈溶剂提取时HCAs的回收率为51.57%~94.42%;采用含1%(体积分数)氨水的乙腈溶液为提取溶液时,IQ、4,8-DiMeIQx、PhIP、Harman、Norharman的回收率的均在70%以上,而MeIQ和MeIQx的回收率有所降低,但均大于68%。氨水可以改变乙腈的pH值,使HCAs更容易溶解于有机溶剂中,从而使得回收率提高。因此,本研究采用含1% (体积分数)氨水的乙腈溶液作为提取溶液。需要注意的是,乙腈和氨水均有刺鼻气味,因此前处理操作最好在通风橱中进行。

图2 (a)甲醇、(b)大豆油提取液、(c)油炸鸡胸肉提取液和(d)混合标准溶液(20 μg/L)中7种HCAs的MRM色谱图Fig.2 MRM chromatograms of the seven HCAs in (a)methanol,(b)soybean oil extracted solution,(c)fried chicken breast extracted solution and (d)mixed standard solution (20 μg/L)1.IQ;2.MeIQ;3.MeIQx;4.4,8-DiMeIQx;5.4,7,8-TriMeIQx (IS);6.PhIP;7.Harman;8.Norharman.
2.4 样品基质效应的消除
ESI源在质谱分析过程中容易受到样品基质的影响,样品基质对离子化有非常强的抑制或促进作用,直接影响分析结果。液相色谱-质谱法开发和确证过程中需要对基质效应做出评价[36]。一般认为,基质匹配校正曲线斜率与标准曲线斜率的比值在0.85~1.15之间不存在基质效应[37]。为了评估基质效应对定量结果的影响,以甲醇、大豆油提取液和油炸鸡胸肉提取液为对象,比较了纯溶剂、油脂基质和油炸食品基质对HCAs测定的影响(见图2)。在油脂基质中,MeIQ、MeIQx、4,8-DiMeIQx、Harman和Norharman的斜率比值为0.72~0.97,IQ和PhIP的斜率比值为1.01~1.06。在油炸食品基质中,IQ、MeIQ、Harman和Norharman的斜率比值为0.84~0.95,MeIQx、4,8-DiMeIQx、PhIP的斜率比值为1.02~1.16。因此,本文用相对应的基质匹配标准曲线定量。从而确保研究结果的准确性和可靠性。
2.5 方法学考察
在最优的分析条件下,以甲醇、大豆油提取液和油炸鸡胸肉提取液稀释标准混合工作液,按照1.2节描述配制7种HCAs系列混合基质标准溶液(含内标20 μg/L),所得结果经过SPSS 21软件处理,以标准溶液中目标组分的峰面积对内标物的峰面积之比为纵坐标(y),相应的质量浓度之比为横坐标(x),建立基质匹配标准曲线。以3倍和10倍信噪比(S/N)确定方法的检出限(LOD)和定量限(LOQ)。不同基质下,7种HCAs的线性关系、相关系数(R2)、检出限和定量限的结果见表2。结果表明,在不同的基质下,7种HCAs均有较好的线性关系,其相关系数均大于0.999。7种HCAs的LOD和LOQ分别为0.01~0.14 ng/g和0.09~0.38 ng/g。

表2 不同基质下7种HCAs的线性范围、线性方程、相关系数、检出限和定量限Table 2 Linear ranges,linear equations,correlation coefficients (R2),limits of detection (LODs)and limits of quantification (LOQs)of the seven HCAs in different matrices
y:the ratio of the peak area of the target component to the peak area of the internal standard;x:the ratio of the mass concentration of the target component to the mass concentration of the internal standard.
2.6 加标回收率和相对标准偏差
选用不含7种待测组分的大豆油和油炸鸡胸肉为空白样品,进行低、中、高3个水平的加标回收试验,每个水平重复5次。按最优条件分析测定加标回收率和RSD值(见表3)。结果显示,油脂体系中,7种HCAs的平均加标回收率为69.30%~108.4%,RSD为0.97%~9.26%;油炸食品体系中,7种不同HCAs的回收率为64.31%~113.8%,RSD为0.18%~7.89%。Yan等[34]采用乙腈溶液对肉制品中17种HCAs进行测定,其加标回收率为42.5%~99.0%。本研究中7种HCAs的加标回收率均高于64%,其精密度满足油脂和油炸食品中HCAs的含量检测要求。

表3 大豆油和油炸鸡胸肉样品中7种HCAs的加标回收率和精密度(n=5)Table 3 Spiked recoveries and precisions of the seven HCAs in soybean oil and fried chicken breast samples (n=5)
2.7 实际样品检测
应用所建立的超高效液相色谱-三重四极杆质谱法对油脂和油炸食品样品中HCAs含量进行测定(见图3),用基质匹配校正曲线进行定量,其具体含量见表4。

图3 油脂和油炸食品样品中7种HCAs的色谱图Fig.3 Chromatograms of the seven HCAs in oil and fried food samplesPeaks 1-8 were the same as that in Fig.2.
测定的油脂样品包括大豆油、花生油、芝麻油、亚麻籽油和葵花籽油。结果显示,油脂样品中均能检出HCAs,主要为Harman和Norharman。由表4可知,HCAs污染水平顺序为芝麻油>亚麻籽油>葵花籽油>花生油>大豆油。究其原因,可能是浓香油脂生产过程中,油籽高温焙炒,焙炒过程中发生美拉德反应,使得油脂中HCAs的含量增加。同时,由于不同油料的油脂生产工艺不同,油脂中HCAs分布情况不同。
检测的油炸食品包括油炸鸡肉丸、豆腐、油条和土豆。在油炸鸡肉丸中检出MeIQ、MeIQx、4,8-DiMeIQx、PhIP、Harman和Norharman等6种杂环胺类物质,其含量顺序为PhIP>MeIQx>Norharman>Harman>4,8-DiMeIQx>MeIQ。此外,油炸豆腐、油炸油条和油炸土豆中检出PhIP、Harman和Norharman 3种杂环胺类物质,其中以Norharman含量最高,这可能与油炸食品的种类和加工条件等有关。
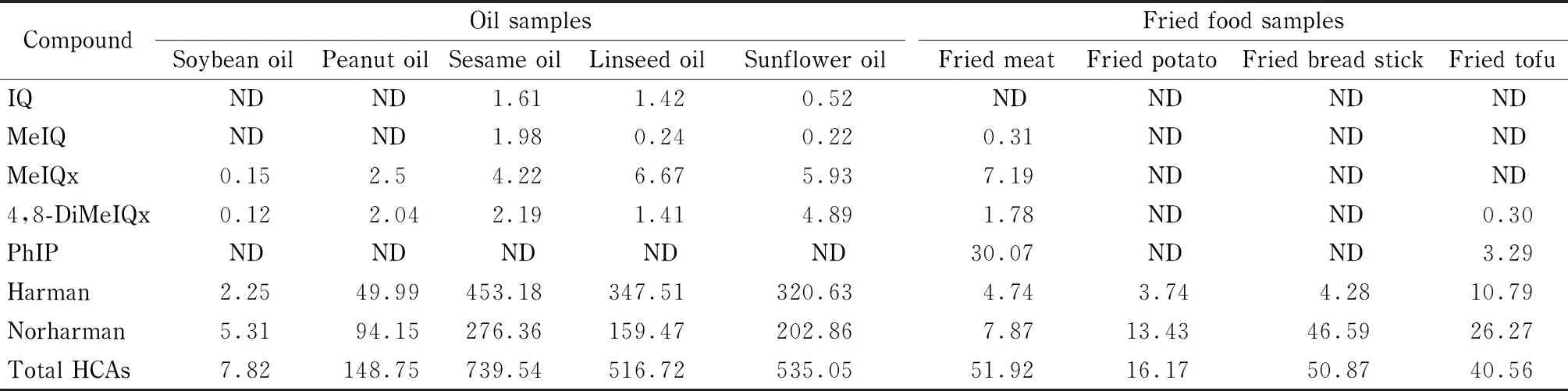
表4 油脂和油炸食品样品中7种HCAs的含量Table 4 Contents of the seven HCAs in oil samples and fried food samples ng/g
ND:not detected.
3 结论
本文建立了一种碱性有机溶剂萃取,PCX固相萃取柱净化,超高效液相色谱-三重四极杆质谱测定油脂和油炸食品中7种HCAs的检测方法。该方法采用一步式溶剂萃取,操作简便,分析速度快,能够满足HCAs的检测要求,适用于油脂和油炸食品中HCAs的检测,为油脂和油炸食品中HCAs的生成与抑制分析提供了分析手段。
