初始Ⅳ期乳腺癌预后因素分析
2020-12-25
(中国医科大学附属第一医院肿瘤内科,沈阳 110001)
乳腺癌是威胁女性健康的常见恶性肿瘤之一,发病率居全世界女性恶性肿瘤第一位[1]。乳腺癌一旦发生远处转移便不可治愈,我国乳腺癌死亡率居女性恶性肿瘤第二位[2],严重威胁女性的健康。初始Ⅳ期乳腺癌约占晚期乳腺癌5%~9%[3]。相关研究[4]表明初始Ⅳ期乳腺癌患者中位生存期(mediansurvival time,MST)2.91年(0.11~11.76年),比晚期转移性乳腺癌(metastatic breast cancer,MBC)患者[2.28年(0.02~10.55年)]长,因此可能具有更好预后。目前,初始Ⅳ期乳腺癌人群以全身综合治疗为主,患者能否从切除原发病治疗中获益尚存争议。一项来自土耳其的MF07-01前瞻性研究[5]结果显示激素受体(hormone receptor,HR)阳性、人类表皮生长因子受体 2(human epidermal growth factor recptor-2,HER2)无扩增型、单纯骨转移和年龄<55岁的患者,更容易从先局部手术治疗再综合治疗中获益。而一项来自美国波士顿的TBCRC013的前瞻性研究[6]表明,在全身治疗有效的状况下,行乳腺癌原发病灶切除也许并不能提高晚期乳腺癌患者的预后。如何综合评估患者预后因素,针对初始Ⅳ期乳腺癌患者制订个体化综合治疗策略,仍是目前急需解决的医学难题。
对影响初始Ⅳ期乳腺癌预后的因素的研究多数以临床病理特征来判定患者的预后,但临床预后指标在初始Ⅳ期乳腺癌中的地位尚存争论。WU等[7]分析了远处转移是影响预后不利的独立因素,其中肝转移和脑转移是影响总生存期(overall survival,OS)的独立不良预后因素。LEONE等[8]研究表明在任何内脏受累患者中,转移器官的数量是初始Ⅳ期乳腺癌的预后因素。BERTAUT 等[9]证实了HR阳性的患者生存率比HR阴性患者高。OGIYA 等[10]研究表明初始Ⅳ期乳腺癌年轻患者(<40岁)治疗有效时间更长,因为可能存在与年龄相关的基因组或生物学差异。综合各项研究可见,年龄、内脏转移、分子分型、手术状态等因素可能与预后相关,但多数回顾性研究集中于分析单因素对患者预后的影响,现有多因素影响患者预后的研究尚不全面。利用多因素变量建立初始Ⅳ期乳腺癌的预后模型的诸多尝试结果并不令人满意。LIN等[11]针对原发灶手术对初始Ⅳ期乳腺癌患者的预后研究建立了Fine-Gray竞争风险模型,该模型仅包含转移部位分类的参数,无法准确进行预测。而一项针对验证亚洲现有初始Ⅳ期乳腺癌预测模型的研究表明[12],现有预测模型的区分性能不高,无法准确、直观预测。
列线图是应用已知的预后因素构建的图形计算模型,用一组平行的线段展示多个独立变量之间函数关系,可产生临床事件的数值概率[13]。列线图是能直观地将预测结果以图表形式展现的数学模型,具有较强优势。列线图在预测乳腺癌复发和远处转移方面已被广泛应用,且具有明显优势[14]。本研究分析影响初始Ⅳ期乳腺癌预后的危险因素,构建直观、简洁、易普及的列线图预后模型来量化初始Ⅳ期乳腺癌患者的生存率,旨在为初始Ⅳ期乳腺癌个体化治疗策略的制定提供帮助。
1 材料与方法
1.1 研究对象
收集2003年1月1日至2019年1月1日于中国医科大学附属第一医院肿瘤内科就诊的216例初始诊断为Ⅳ期乳腺癌患者临床资料。通过查阅患者电子病历系统(HIS系统)、纸质病史记录及患者随访表,确认患者门诊及住院治疗情况,并于2018年1月1日始每6个月进行1次电话随访,末次随访时间为2019年8月31日。
纳入标准:(1)初始诊断为Ⅳ期乳腺癌患者;(2)穿刺或术后病理证实为浸润性乳腺癌;(3)影像学或体检首次确诊同时远处转移(cM1)和(或)组织学证实超过0.2 mm的转移灶(pM1);(4)美国东部肿瘤协作组(eastern cooperative oncology,ECOG)体能状况评分[15]≤2分;(5)预计生存期≥3个月。排除标准:(1)首次诊断时患有≥2种原发恶性肿瘤;(2)乳腺癌诊断前合并有其他恶性肿瘤;(3)临床病理资料(一般资料、临床病理特征等)不全;(4)随访信息(生存状态、死亡时间及原因、失访情况及时间)不完整;(5)存在严重的、不能控制的系统性疾病。最终204例患者纳入本研究。
1.2 研究方法
患者临床和病理特征数据来自于中国医科大学附属第一医院肿瘤内科数据库。收集患者姓名、年龄、体质量指数(body mass index,BMI)、ECOG体能状况评分、诊断时月经状态、组织学分级,雌激素受体(estrogen receptor,ER),孕激素受体(progesterone receptor,PR),HER2,分子分型、原发肿瘤T分期、区域淋巴结N分期(临床分期)、有无内脏转移、内脏转移部位数量、是否接受乳腺手术及全身治疗情况。
通过病理活检或手术确定原发灶病理诊断,通过超声或CT引导下穿刺活检或影像学检查确定疾病转移以及转移部位和数目。OS定义为初始Ⅳ期诊断日期至因疾病进展或任何原因引起死亡的时间间隔,未死亡患者的截点为末次随访日期。HR阳性[16]:ER或PR≥1%。HER2阳性[17]:标准免疫组织化学检测HER2为“3+”;标准免疫组织化学检测HER2为“2+”时,需进一步完善FISH检测,根据2013版ASCO/CAP标 准[18],HER2/CEP17≥2.0或HER2基因拷贝数≥6时HER2阳性。依据HR及HER2,分子分型分类为HR+HER2-;HR+HER2+;HR-HER2-;HRHER2+。
1.3 统计学分析
采用SPSS 23.0软件处理数据,计数资料以百分率(%)表示;临床病理特征与预后相关性分析采用Pearsonχ2检验及Fisher精确概率法。采用Kaplan-Meier法绘制生存曲线;利用Cox风险比例回归模型分析OS的影响因素,P<0.05为差异有统计学意义。
采用The R Project for Statistical Computing 3.6.2软件进行列线图模型建立及验证,调用survival and rms程序包。将Cox风险比例回归模型多因素分析所得的独立预后因素纳入列线图中[19],列线图中患者的存活概率通过将因素得分相加来假设,得分越高代表生存率越高。采用1 000次Bootstrap自抽样法进行内部验证及校准,用一致性系数(Harrell’s concordance index,C-index)衡量本模型的预测精准程度[20]。C-index:0.5~0.7,准确度较低;0.7~0.9,准确度较良好;0.9,准确度高,C-index的95%置信区间用于量化歧视,范围从0~1(<0.5,绝对不一致;0.5,机会均等;1,最好的一致性)。使用校正曲线比较1年、3年和5年的实际生存概率和预测生存概率,校正曲线越靠近对角线,预测模型的符合度越高。
2 结果
2.1 初始Ⅳ期乳腺癌患者的一般资料及临床病理特征
截至2019年8月31日随访结束,中位随访时间34个月(4~171个月),患者中位年龄52岁(27~76岁),共发生OS事件147例(72.1%),1年、3年、5年OS分别为81.4%、51.5%、41.2%。
204例患者中39例患者BMI缺失(19.1%);其中只行原发灶局部手术患者89例(43.6%),只行远处转移病灶手术患者3例(1.5%),行原发灶及远处转移病灶手术患者6例(2.9%),见表1。
2.2 影响初始Ⅳ期乳腺癌患者OS的因素
采用Kaplan-Meier法进行OS生存分析,结果显示,是否接受手术(P=0.000 2)、分子分型(P=0.021 7)、有无内脏转移(P=0.000 65)与初始Ⅳ期乳腺癌患者OS有关。Kaplan-Meier曲线显示接受手术患者预后好于未接受手术患者,见图1;分子分型为HR+HER2-患者预后最好;HR-HER2-患者预后最差,见图2;无内脏转移患者预后明显好于有内脏转移患者,见图3。

表1 初始Ⅳ期乳腺癌患者一般资料及临床病理特征Tab.1 General data and clinicopathological characteristics of patients with initial stage Ⅳ breast cancer

(续表)

图1 手术对初始Ⅳ期乳腺癌患者预后OS影响Fig.1 Effect of surgery on overall survival in patients with initial stage Ⅳ breast cancer
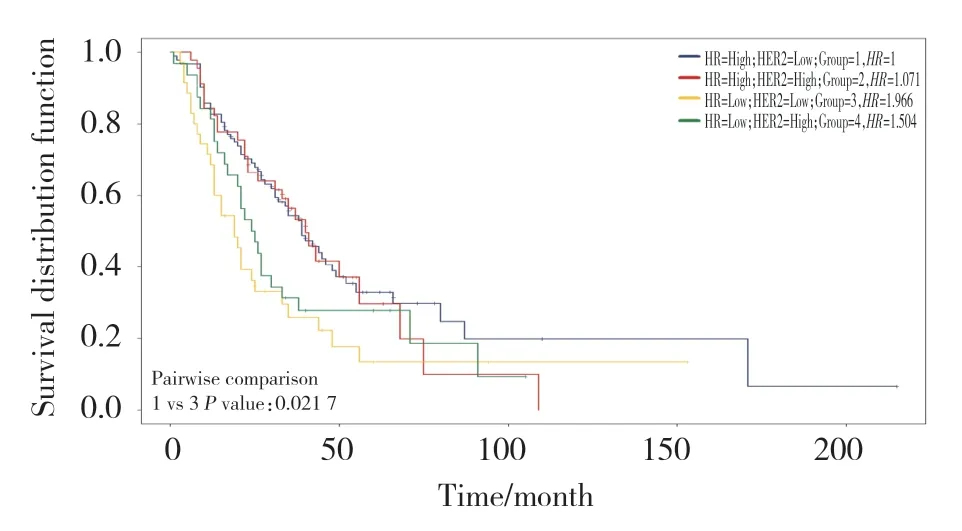
图2 分子分型对初始Ⅳ期乳腺癌患者预后OS影响Fig.2 Effect of molecular typing on overall survival in patients with initial stage Ⅳ breast cancer
2.3 Cox回归分析初始Ⅳ期乳腺癌患者的预后影响因素
单因素分析结果显示,患者是否接受乳腺局部手术(P<0.001)、ECOG评分(P=0.038)、ER状态(P=0.002)、分子分型(P=0.015)、有无骨转移(P=0.013)、有无内脏转移(P=0.001)、内脏转移部位数目(P=0.024)与初始Ⅳ期乳腺癌患者OS有关(P<0.05)。本研究回顾性收集患者信息时,有87例(42.6%)患者组织学分级缺失,且考虑ER状态与分子分型会产生交互作用,避免影响列线图预后模型的准确性及实用性,所以多因素分析时不纳入组织学分级及ER状态。多因素分析结果显示,是否接受手术(P=0.001)、分子分型(P=0.009)及内脏转移(P=0.019)是影响OS的独立因素,见表2。
2.4 建立OS列线图预后模型
将多因素分析所得的影响预后因素(有无内脏转移、分子分型、是否接受手术)带入列线图预后模型。根据列线图模型得到积分、总分及1年、3年、5年总生存概率。建立预测初始Ⅳ期乳腺癌患者预后的列线图模型,见图4。1年、3年、5年预测值输出变量的范围分别为(0.9,0.4)、(0.7,0.1)、(0.6,0.1),总分值越小表示患者总生存概率越大。

图3 内脏转移对初始Ⅳ期乳腺癌患者预后OS影响Fig.3 Effect of visceral metastasis on overall survival in patients with initial stage Ⅳ breast cancer

图4 预测初始Ⅳ期乳腺癌患者预后的列线图模型Fig.4 Nomogram model for predicting prognosis in patients with initial stage Ⅳ breast cancer

表2 影响初始Ⅳ期乳腺癌患者OS的单因素及多因素分析Tab.2 Univariate and multivariate analysis of overall survival in patients with initial stage Ⅳ breast cancer
该列线图模型经1 000次 Bootstrap自抽样内部验证,内部验证后的C-index为0.671(95%CI:0.647~0.695,P<0.001),列线图模型分辨度良好。根据比较Cox风险比例模型计算出1年、3年5年预测生存概率和实际生存概率,分别绘制校正曲线,校正曲线与对角线贴合度较高,说明该预测模型与实际情况的符合度较高,见图5~7。绘制时间依赖性受试者工作特征(receiver operating characteristic,ROC)曲线[21],ROC曲线下面积(area under curve,AUC)0.5~0.7,模型效果较低;0.7~0.85,模型效果较好;0.85~0.95,模型效果好[22]。以随访时间为x轴,以AUC为y轴,可见该模型AUC=[0.7,0.8],说明该预测模型真实性较高,见图8。

图5 患者1年OS的列线图预测的校准曲线Fig.5 Calibration curve of nomogram prediction for 1-year overall survival

图6 患者3年OS的列线图预测的校准曲线Fig.6 Calibration curve of nomogram prediction for 3-year overall survival

图7 患者5年OS的列线图预测的校准曲线Fig.7 Calibration curve of nomogram prediction for 5-year overall survival
2.5 列线图模型的临床应用

图8 列线图模型的时间依赖性ROC曲线Fig.8 Time-dependent receiver operating characteristic curve of the nomogram model

图9 列线图模型的DCA曲线Fig.9 DCA curve of the nomogram model
采用决策曲线分析(decision curve analysis,DCA)来评估列线图对患者OS的预测作用,见图9。准确判断临床和组织学特征对初始Ⅳ期乳腺癌患者预后的影响对于临床决策有着很重要的作用[23]。相对于患者均无相关独立因素影响(用None代表,即水平线)和均有相关独立因素影响(用All代表,即斜线),采用本列线图进行决策的净获益更高。尤其在<25%阈值概率区间,利用这一预测模型对于评估初始Ⅳ期乳腺癌患者预后具有较高应用价值。
根据列线图模型可知HR+HER2-为0分,HRHER2-为100 分,手术为0分,未手术为75分,无内脏转移为0分,有内脏转移为55分。根据是否接受手术、有无内脏转移、分子分型状态排列组合所对应的总分值,总分值的中位数为92.5,总分值>92.5时为高危组,共92例(45.1%);总分值<92.5时为低危组,共112例(54.9%)。采用Kaplan-Meier法对低危组和高危组进行OS生存分析结果显示,该模型准确性和实用性较高(P=0.006 5),见图10。
3 讨论

图10 低危组和高危组对OS的影响Fig.10 Effects of low-risk and high-risk groups on overall survival
晚期乳腺癌的治疗目的是缓解症状,提高患者生存质量,治疗原则应该是以最小的毒性获得最大的生存获益。由于不同的个体肿瘤存在异质性,临床病理特征及肿瘤负荷相同的患者采用同类治疗方案,其预后会有显著不同。因此单个临床病理因素难以预测患者的预后,需要对患者进行综合评估,制定包含多个预测因素的预后模型来预测患者死亡风险,有利于实施个体化治疗。本研究纳入204例初始Ⅳ期乳腺癌患者,对影响患者预后的临床病理因素及治疗因素进行了生存分析,单因素分析结果显示ECOG评分、ER状态、分子分型、有无骨转移、有无内脏转移,内脏转移部位数目以及是否接受乳腺局部手术与初始Ⅳ期乳腺癌患者OS有关。多因素分析结果显示有无乳腺局部手术、分子分型、有无内脏转移是影响患者预后的独立因素。因此,依靠单个临床病理因素难以预测初始Ⅳ期乳腺癌患者的预后,临床病理因素对患者预后的影响是综合因素所致,在临床决策中需要综合分析、全面评估肿瘤负荷和分子分型及局部治疗等因素。
既往有关分子分型影响初始Ⅳ期乳腺癌患者预后的研究,多倾向于明确HR状态与HER2状态分别的影响,以及HER2+患者应用靶向药后对预后的影响[9]。而本研究通过将患者详细分类,分析了4种分子分型对患者预后影响,其中HR+HER2-患者预后最好,HR-HER2-患者预后最差。有关内脏转移对患者预后的影响[7-8],本研究与既往研究结果一致,表明远处转移是影响初始Ⅳ期乳腺癌的独立且不利因素,且转移器官的数量也是影响预后的因素。目前初始Ⅳ期乳腺癌人群以全身综合治疗为主,各大国际指南缺乏原发病灶手术在这部分人群的明确推荐。本研究回顾性分析结果显示乳腺局部手术治疗只是影响预后的因素之一。原发灶手术主要目的在于减轻肿瘤负荷,在未获得前瞻性生存获益证据及相关指南出台前,初始Ⅳ期乳腺癌患者乳腺局部手术应该慎重考虑。
现有利用多因素变量所建立的大量初始Ⅳ期乳腺癌预后模型存在区分性能低,无法准确直观地进行预测等缺陷,其结果并不满意[24]。尽管一些临床病理和组织学特征对初始Ⅳ期乳腺癌患者预后的影响在临床治疗中取得一些共识,但尚无公认诊断指南明确指出。就我国而言,检测标准、行业规范以及专家共识仍存在大量争议,针对我国患者的数据也很少。列线图已被成功地用于至少十年来预测基于临床和实验室数据组合的临床结果。与传统的分类预测变量比较,列线图以简单的图形方式显示了影响患者预后的因素,使临床医生和患者直观了解临床病理特征及其在预后的影响,并且在给定一组已知协变量的情况下,可以直接计算患者生存率,能更真实地反映疾病发展过程。本研究构造了包括手术状态、分子分型和内脏转移的列线图。通过C-index、校正曲线及时间依赖性ROC曲线验证了列线图的准确性及稳定性,DCA曲线及危险因素对OS生存分析证明该列线图具有较高临床应用价值。根据列线图可知,HR+、无内脏转移且接受手术患者预后较好;分子分型为HR-HER2-、有内脏转移、未接受手术患者预后最差。统一综合化的预后标准是为初始Ⅳ期乳腺癌患者提供获益更高的系统治疗方案选择的关键,而系统治疗前采取局部手术治疗是否能提高患者预后尚无定论。本研究认为,在明确患者分子分型及有无内脏转移的情况下,患者接受手术较不接受手术会有更好的预后。
当前的研究有一些局限性。本研究为单中心回顾性研究,纳入的样本数量有限,且随访时间较长,存在患者临床信息和随访信息不完善等情况,其中少数患者初诊有脑转移,患者手术信息及患者治疗具体情况缺失较多,可能对结果造成一定影响,因此仍需进行大样本、多中心的外部验证,并从多方面多角度进一步探讨初始Ⅳ期乳腺癌预后的因素。
综上所述,是否接受乳腺局部手术、分子分型和有无内脏转移是影响初始Ⅳ期乳腺癌患者预后的临床病理因素;利用本研究所建立的列线图可预测初始Ⅳ期乳腺癌患者预后,能够为患者制定个体化治疗策略提供帮助。
