循环肿瘤细胞分型与非小细胞肺癌临床病理特征相关性研究
2020-12-23黄祥奇李文娟梁静潘宇航陈健宁何丹
黄祥奇?李文娟?梁静?潘宇航?陈健宁?何丹


【摘要】目的 探討不同类型循环肿瘤细胞(CTC)与非小细胞肺癌(NSCLC)临床病理特征的相关性。方法 选取121例NSCLC患者(NSCLC组)作为研究对象,另以40例非肿瘤肺部良性病变患者(良性病变组)和10名健康志愿者(健康对照组)作为对照。采集所有患者静脉血,使用纳米膜富集技术过滤分离CTC,再用mRNA多重原位杂交法分析检测CTC上皮或间质基因,比较不同组CTC阳性率的差异,探讨NSCLC患者CTC与临床病理特征的相关性。结果 NSCLC组患者的CTC阳性率为86%,其中上皮型、混合型、间质型阳性率分别为31%、74%及23%;良性病变组的CTC阳性率为15%,其中上皮型、混合型、间质型阳性率分别为3%、15%及0%,健康对照组未检出CTC。NSCLC组CTC阳性率及混合型CTC阳性率均高于良性病变组及健康对照组(P均< 0.017)。121例NSCLC患者中,临床分期高(Ⅲ ~ Ⅳ期)者的CTC阳性率高于临床分期低(Ⅰ ~ Ⅱ期)者,有淋巴结转移(N1 ~ N3)者的CTC阳性率高于无淋巴结转移者(N0)者(P均< 0.05)。Spearman秩相关分析显示,CTC总数与临床分期呈正相关(rs = 0.254,P = 0.005),其中上皮型CTC(r = 0.202,P = 0.026)、混合型CTC(rs = 0.247,P = 0.006)的数量均与临床分期呈正相关,而间质型CTC与临床分期无关(P > 0.05)。CTC总数与淋巴结转移呈正相关(rs = 0.218,P = 0.016),其中混合型CTC的数量与淋巴结转移的发生呈正相关(rs = 0.247,P = 0.006),而上皮型CTC及间质型CTC的数量与淋巴结转移并无关(P均> 0.05)。结论 NSCLC患者CTC阳性率与肿瘤分期及淋巴结转移有关,可考虑作为临床分期及预后评估的附加指标。
【关键词】非小细胞肺癌;循环肿瘤细胞;临床病理特征
Correlation between types of circulating tumor cells and clinicopathological features of patients with non-small cell lung cancer Huang Xiangqi, Li Wenjuan, Liang Jing, Pan Yuhang, Chen Jianning, He Dan. Department of Pathology, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, He Dan, E-mail: hedan76@ 126. com
【Abstract】Objective To explore the correlation between different types of circulating tumor cells (CTCs) and the clinicopathological features of patients with non-small cell lung cancer (NSCLC). Methods In total, 121 NSCLC patients were assigned into the NSCLC group, 40 patients with benign lung diseases into the benign lung disease group and 10 healthy volunteers into the control group, respectively. The venous blood of all patients was collected, and the epithelial or mesenchymal genes of CTCs in the peripheral blood were detected by Nanofilm enrichment technology and multiple mRNA-ISH analysis. The positive rates of CTCs were statistically compared among different groups. The correlation between CTCs type and clinicopathological characteristics in the peripheral blood of NSCLC patients was analyzed. Results In the NSCLC group, the positive rate of CTCs was 86%, and the positive rates of epithelial, biophenotypic and mesenchymal CTCs were 31% (38/121), 74% (90/121) and 23% (24/121), respectively. The positive rates of epithelial, biophenotypic and mesenchymal CTCs in the benign lung lesion group were 3% (3/40), 15.0% (6/40) and 0% (0/40), respectively. No CTCs were detected in the healthy volunteers. The positive rate of CTCs and biophenotypic CTCs in the NSCLC group were significantly higher compared with those in the benign lung lesion and healthy control groups. Among 121 NSCLC patients, the positive rate of CTCs in patients with stage Ⅲ and Ⅳ NSCLC was significantly higher than that in their counterparts with stageⅠand Ⅱ NSCLC, and the positive rate of CTCs in patients with lymph node metastasis (N1-N3) was remarkably higher than that in those without lymph node metastasis (N0) (both P < 0.05). Spearman correlation analysis demonstrated that the total count of CTCs was positively correlated with clinical staging (rs = 0.254, P = 0.005). The count of epithelial and biophenotypic CTCs was positively associated with clinical staging (rs = 0.202, P = 0.026; rs = 0.247, P = 0.006), whereas that of mesenchymal CTCs was not correlated with clinical staging (P > 0.05). The total count of CTCs was positively correlated with lymph node metastasis (rs = 0.218, P = 0.016). The count of biophenotypic CTCs was positively associated with lymph node metastasis (rs = 0.247, P = 0.006), whereas those of epithelial and mesenchymal CTCs were not associated with lymph node metastasis (both P > 0.05). Conclusion The positive rate of CTCs in the peripheral blood of NSCLC patients is correlated with clinical staging of NSCLC and lymph node metastasis, which can be considered as an additional parameter to evaluate tumor staging and clinical prognosis.
【Key words】Non-small cell lung cancer;Circulating tumor cell;Clinicopathological feature
肺癌是成人中最常见的呼吸系统恶性肿瘤,据WHO 2018年统计,我国肺癌新增病例数和死亡人数均居恶性肿瘤发病率和死亡原因首位[1]。非小细胞肺癌(NSCLC)与小细胞肺癌(SCLC)相比,癌细胞生长和分裂相对缓慢,肿瘤的增殖和远处转移相对较晚,但不幸的是,这些患者在得到明确诊断时,多数已经错过了最佳手术时间[2]。如果能更早地获得准确诊断,NSCLC患者将获得更全面的术后复发评估及治疗策略选择机会,使整体治疗效果或生存质量有明显的提升[3]。
循环肿瘤细胞(CTC)最早是由澳大利亚Thomas Ashwoth于1869年在一名男性转移癌患者的血液中发现[4]。CTC是从肿瘤组织中脱离出来的肿瘤细胞,通过血管内壁进入血液循环,进行远处播散和转移[5]。近年的多项研究表明,干细胞特性的CTC具有上皮-间质转化(EMT)的能力,是肝癌、乳腺癌、结直肠、肺癌等恶性肿瘤复发转移的主要始动因素,在临床分期中具有潜在应用价值,可预测多种实体瘤的预后。但由于富集技术和鉴定方法的不确定性,目前尚无用于肺癌临床的CTC检测方法[6]。因此,本研究采用纳米膜过滤富集技术,进一步用mRNA多重原位杂交法检测其类型,分析不同类型CTC与NSCLC临床病理特征相关性及其在临床应用中的价值。
对象与方法
一、研究对象
选择2016年3月至2019年10月在我院住院的121例NSCLC患者(NSCLC组)作为研究对象,患者年龄59 (31,78) 岁,其中男76例、女45例。另外选取同期在我院住院的40例非肿瘤肺部良性病变患者(良性病变组)和10名健康志愿者(健康对照组)作为对照,入选者年龄50(22,83)岁,男14例、女36例。NSCLC组纳入标准:病理诊断为NSCLC。排除标准:合并其他恶性肿瘤。良性病变组和健康对照组纳入标准:病理及臨床诊断排除恶性肿瘤的肺部良性病变患者或健康人。研究方案经医院医学伦理委员会批准,入组者均已经签署知情同意书。
二、组织学评估
收集121例NSCLC术中切除标本及活组织检查(活检)标本以4%中性缓冲甲醛固定,采用石蜡包埋,3.5 μm厚切片,HE染色光镜下观察。根据“2015年WHO肺部肿瘤组织学分类标准”,由1名中级和1名副高级病理专科医师同时诊断。具体根据组织学诊断,分为肺腺癌、肺鳞癌、腺鳞癌及大细胞癌。
三、CTC检测方法
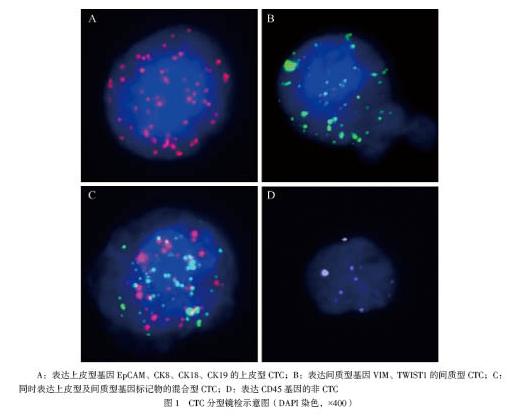
分别收集3组的外周血,采用益善公司Can PatrolTM CTC 二代技术,先使用纳米膜过滤分离CTC,再用基于分支DNA信号扩增技术进行RNA原位杂交,根据EMT标志物区分不同类型CTC。操作如下:将患者外周血5 ml移入乙二胺四乙酸二钾抗凝管,用连通器转移至红细胞裂解缓冲液处理完全混合30 min,室温下1850转/分离心5 min,然后用直径8 μm纳米膜过滤器进行分离和过滤,一般固定后,在1 ml 50%、70%、100%梯度乙醇脱水各2 min。细胞消化预处理后,使用上皮细胞黏附分子(EpCAM)、细胞角蛋白8(CK8)、CK18、CK19、波形蛋白(VIM)、TWIST转录因子1(TWIST1)和CD45基因RNA捕获探针40℃充分杂交3 h,洗涤后用支链DNA信号扩增探针40 ℃进行30 min扩增放大,使用显色缓冲液40℃温育20 min,最后DAPI染液复染全自动扫描镜检。
四、结果判定标准
根据核型特征及不同颜色荧光表达水平对细胞进行分型:镜下细胞核上有红色信号基因表达EpCAM(+)、CK8(+)、CK18(+)、CK19(+)且DAPI(+)、CD45(-)为上皮型CTC;有绿色信号基因表达VIM(+)、TWIST1(+)且DAPI(+)、CD45(-)为间质型CTC;有红色及绿色两种荧光同时表达为混合型CTC;有白色荧光信号点表达CD45(+)为非CTC;红绿白信号点均以≥7为有效表达。同一细胞仅出现上述其中一种表达,同一患者可以同时出现上述4种细胞,总的CTC数量为上皮型、间质型和混合型CTC数量之和。CTC数量≥3个/5 ml定为阳性,反之为阴性。
五、统计学处理
所有数据使用SPSS 23.0进行统计分析。计量资料因不符合正态分布,故用中位数(下四分位数,上四分位数)表示;计数资料用例(%)表示,组间比较采用χ2检验或Fisher确切概率法,两两比较采用Bonferroni法;等级资料相关性应用Spearman秩相关分析。α= 0.05。
结果
一、CTC分型检测结果
上皮型CTC、间质型CTC、混合型CTC的表达见图1。
二、NSCLC组、良性病变组及健康对照组各型CTC阳性率比较
NSCLC患者CTC阳性率及混合型CTC均高于良性病变组及健康对照组(P均< 0.017),良性病变组与健康对照组3种型别CTC阳性率比较差异均无统计学意义(P均> 0.05),见表1。
三、不同临床病理特征NSCLC患者的CTC阳性率分布
121例NSCLC患者中,临床分期高(Ⅲ ~ Ⅳ期)者的CTC阳性率高于临床分期低(Ⅰ ~ Ⅱ期)者,有淋巴结转移(N1 ~ N3)者的CTC阳性率高于无淋巴结转移者(N0)者(P均< 0.05)。不同性别、年龄、是否吸烟、有无胸腔积液、组织分型、肿瘤大小间NSCLC患者CTC阳性率比较差异无统计学意义(P均> 0.05),见表2。
四、临床分期、淋巴结转移与CTC数量的相关性分析
Spearman秩相关分析显示,CTC总数与临床分期呈正相关(rs = 0.254,P = 0.005),其中上皮型CTC(rs = 0.202,P = 0.026)、混合型CTC的数量均与临床分期呈正相关(rs = 0.247,P = 0.006),而间质型CTC与临床分期无关(P > 0.05)。CTC总数与淋巴结转移呈正相关(rs = 0.218,P = 0.016),其中混合型CTC的数量与淋巴结转移的发生呈正相关(rs = 0.247,P = 0.006),而上皮型CTC及间质型CTC的数量与淋巴结转移并无关(P均> 0.05),见表3。
讨论
近年来,为了追求精准的肿瘤治疗,对肿瘤靶向分子的精准检测提出更高的要求。NSCLC的精准治疗需要高度依赖肿瘤驱动基因的检测。然而,单纯活检并不能反映肿瘤的所有分子改变。要持续监测和了解肿瘤耐药进展中的分子变化,就不可避免地会对患者产生影响,进行复杂的有创性二次活检。目前,CTC作为液体活检三驾马车之一,为肿瘤患者实现肿瘤动态监测开辟了新的可能。由于外周血易于获得,且可以均质化的反映肿瘤细胞的全貌,对其可行性的研究也越来越多。因此,循环中的肿瘤细胞作为动态观察肿瘤预后的重要手段之一越来越受到重视[7]。
本研究通过对121例NSCLC患者、40例非肿瘤肺部良性病变和10名健康志愿者的CTC计数结果显示,NSCLC 患者CTC阳性率高于良性病变组和健康对照组。值得注意的是,有6例良性病变组患者CTC呈阳性。此前,有针对168例COPD患者进行CTC检测的报道,6例阳性患者在随后的1~4年中肺部出现了小结节,最终被确诊为早期原位癌[8]。CTC检测可能是NSCLC重要的早期筛查手段之一[9]。
本研究中,NSCLC组不同性别、年龄、吸烟、有无胸腔积液、病理组织学分型、肿瘤分化程度、肿瘤大小者其CTC阳性比较差异均无统计学意义,但CTC阳性率与临床分期和淋巴结转移有关。相关性分析表明,临床分期为Ⅲ ~ Ⅳ期患者阳性检出率及CTC总个数高于Ⅰ ~ Ⅱ期患者,且NSCLC临床分期總CTC数呈正相关,说明分期水平越高,CTC阳性率越高。Wei等[10]对73例不同临床阶段的NSCLC患者进行了CTC检测,发现Ⅳ期患者CTC多于Ⅰ期、Ⅱ期、Ⅲ期患者,与本研究结果基本一致。因此,CTC检测可考虑作为临床分期指标的潜在补充,使目前的分期方法更为准确,更好地反映患者预后[11]。
与结直肠癌、乳腺癌、肝癌等实体瘤等一样,肿瘤转移几乎成为患者死亡的直接原因。同时,CTC已被证实与多种实体瘤患者的生存期相关,有望成为独立于TNM分期的一种新的预后评估生物标记物[12]。鉴于CTC作为早期诊断和治疗指标的重要性,本研究分析了CTC与NSCLC淋巴结转移的关系,结果显示NSCLC患者的CTC阳性率与总CTC数和淋巴结转移有关。经亚组分析,上皮型和间质型CTC数与淋巴结转移无关,混合型CTC与淋巴结转移呈正相关。同时笔者还注意到,CTC阳性以混合型为主,提示CTC经历EMT的过程或疾病向严重发展[13]。这些数据有助于阐明CTC在NSCLC转移中的作用。然而,亦有研究者用同类检测方法得出不同结论,Xie等[14]的研究中仅间质型CTC与NSCLC临床病理分期呈正相关,而上皮型CTC和混合型CTC与TNM分期无关。这可能与不同实验室不同解释标准和技术方法的稳定性有关,说明该技术的稳定性还有改进空间。
综上所述,NSCLC患者中CTC的检出率较高,且与临床病理特征有一定关系,可为NSCLC筛查提供一种参考手段,也可作为临床分期的一个潜在附加指标。但由于CTC富集分离技术方法多样性,以及肿瘤细胞鉴定方法的优缺点,目前不同实体瘤的诊断界值也没有统一标准,NSCLC患者CTC与肿瘤TNM的相关性与临床应用仍存在争议[15-19]。由于本研究样本量较少,仍有必要进一步进行多中心的临床研究加以验证。
参 考 文 献
[1] Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2018, 68(6):394-424.
[2] Kastner J, Hossain R, White CS. Epidemiology of lung cancer. Semin Roentgenol, 2020, 55(1):23-40.
[3] Blandin Knight S, Crosbie PA, Balata H, Chudziak J, Hussell T, Dive C. Progress and prospects of early detection in lung cancer. Open Biol, 2017, 7(9):170070.
[4] Paterlini-Brechot P, Benali NL. Circulating tumor cells (CTC) detection: clinical impact and future directions. Cancer Lett, 2007, 253(2):180-204.
[5] Lozar T, Gersak K, Cemazar M, Kuhar CG, Jesenko T. The biology and clinical potential of circulating tumor cells. Radiol Oncol, 2019, 53(2):131-147.
[6] Yeung KT, Yang J. Epithelial-mesenchymal transition in tumor metastasis. Mol Oncol, 2017, 11(1):28-39.
[7] Geeurickx E, Hendrix A. Targets, pitfalls and reference materials for liquid biopsy tests in cancer diagnostics. Mol Aspects Med, 2020, 72:100828.
[8] Ilie M, Hofman V, Long-Mira E, Selva E, Vignaud JM, Padovani B, Mouroux J, Marquette CH, Hofman P. "Sentinel" circulating tumor cells allow early diagnosis of lung cancer in patients with chronic obstructive pulmonary disease. PLoS One, 2014, 9(10):e111597.
[9] He Y, Shi J, Schmidt B, Liu Q, Shi G, Xu X, Liu C, Gao Z, Guo T, Shan B. Circulating tumor cells as a biomarker to assist molecular diagnosis for early stage non-small cell lung cancer. Cancer Manag Res, 2020, 12:841-854.
[10] Wei T, Zhu D, Yang Y, Yuan G, Xie H, Shen R. The application of nano-enrichment in CTC detection and the clinical significance of CTCs in non-small cell lung cancer (NSCLC) treatment. PLoS One, 2019, 14(7):e0219129.
[11] Wang X, Ma K, Yang Z, Cui J, He H, Hoffman AR, Hu JF, Li W. Systematic correlation analyses of circulating tumor cells with clinical variables and tumor markers in lung cancer patients. J Cancer, 2017, 8(15):3099-3104.
[12] Zhang C, Wang L, Guan Y, Sun Y, Liu X, Zhu D, Guo Q. Progress of circulating tumor cells in cancer management. Technol Cancer Res Treat, 2016, 15(3):509-516.
[13] Zhang X, Wei L, Li J, Zheng J, Zhang S, Zhou J. Epithelial?mesenchymal transition phenotype of circulating tumor cells is associated with distant metastasis in patients with NSCLC. Mol Med Rep,2019,19(1):601-608.
[14] Xie Z, Gao X, Cheng K, Yu L. Correlation between the presence of circulating tumor cells and the pathologic type and staging of non-small cell lung cancer during the early postoperative period. Oncol Lett, 2017, 14(5):5825-5830.
[15] Scharpenseel H, Hanssen A, Loges S, Mohme M, Bernreuther C, Peine S, Lamszus K, Goy Y, Petersen C, Westphal M, Glatzel M, Riethdorf S, Pantel K, Wikman H. EGFR and HER3 expression in circulating tumor cells and tumor tissue from non-small cell lung cancer patients. Sci Rep, 2019, 9(1):7406.
[16] 徐敏,何婉,李岚,朱美琴,陈亦欣,许瑞莲. 外周血循环肿瘤DNA基因突变检测在非小细胞肺癌中的应用价值. 新医学,2016,47(6):380-383.
[17] Tan CL, Lim TH, Lim TKh, Tan DS, Chua YW, Ang MK, Pang B, Lim CT, Takano A, Lim AS, Leong MC, Lim WT. Concordance of anaplastic lymphoma kinase (ALK) gene rearrangements between circulating tumor cells and tumor in non-small cell lung cancer. Oncotarget, 2016, 7(17):23251-23262.
[18] Pailler E, Auger N, Lindsay CR, Vielh P, Islas-Morris-Hernandez A, Borget I, Ngo-Camus M, Planchard D, Soria JC, Besse B, Farace F. High level of chromosomal instability in circulating tumor cells of ROS1-rearranged non-small-cell lung cancer. Ann Oncol, 2015, 26(7):1408-1415.
(收稿日期:2020-04-20)
(本文编辑:林燕薇)
