甲状腺球蛋白基因对CH患儿诊断、早期干预疗效及影响因素分析
2020-12-22郑康宁
唐 华 周 莹 郑康宁 王 华 喻 容
1.湖南省妇幼保健院(长沙,410008);2.湖南省长沙市中心医院
先天性甲状腺功能低下(CH)是儿科最常见内分泌疾病之一,胚胎发育过程中各种原因导致的发育异常均可导致甲状腺先天性发育不良、缺如、异位,导致患儿智能发育障碍或痴呆、矮小,俗称呆小症。CH患儿在早期因缺乏疾病典型、特异性症状或症状较轻,常被误诊、漏诊,从而耽误最佳治疗时机,发病率1/3000~4000[1-2]。当患者出现典型临床症状已丧失最佳治疗时机,诱发不可逆性智力损伤、发育低下[3]。随着新生儿疾病筛查的广泛开展,对CH认识也愈加深入[4]。但与CH相关的甲状腺球蛋白基因(TG)研究报道较少。本文通过对湖南省新生儿疾病筛查中心确诊的CH患儿进行TG基因筛查,并对所有病例追踪随访,分析CH患儿的患病影响因素,为湖南省CH疾病的研究提供参考依据。
1 资料与方法
1.1 一般资料
收集经湖南省新生儿筛查中心确诊为先天性甲状腺功能减低症患儿43例(男性23例、女性20例)。所有患儿均经甲状腺超声诊断,并利用改良型变性高效液相层析技术(DHPLC)高通量多态/突变筛选平台对TG基因的启动子区域及全部外显子进行基因突变筛查。根据治疗时机的不同分两组;<30 d组25例(男性13例、女性12例),胎龄(36.7±3.1)周(33~41周),体重(3.79±0.72)kg,出生身长(51.11±3.12)cm;≥30 d组18例(男性10例、女性8例),胎龄(36.6±3.1)周(33~40周),体重(3.71±0.75)kg,出生身长(51.09±3.09)cm。两组患儿在性别、胎龄、体质量以及出生身长等比较无差异(P>0.05)。同期选取60例健康新生儿为对照组。本研究经本院伦理委员会审批。
1.2 研究方法
1.2.1 CH基因筛查经患儿家属知情并签订知情同意书后,取患儿静脉血3 ml,EDTA抗凝处理,送至杭州甄元科技有限公司进行改良型变性高效液相层析技术高通量多态/突变筛选平台TG基因启动子区域及全部外显子进行基因突变筛查。
1.2.2治疗方法两组患儿均实施左甲状腺素(8~10 μg/kg/d)治疗,后续定期检测甲状腺素,根据患儿年龄、甲状腺功能相关指标等变化调整用药剂量,对血清促甲状腺素(TSH)、游离三碘甲状腺原氨酸(FT3)以及游离甲状腺素(FT4)指标正常且没有明显症状患儿维持剂量治疗,治疗后15 d、30 d复查、调整剂量。<1周岁患儿每3个月复查1次,≥1周岁患儿每6个月复查1次,记录患儿甲状腺素指标、智力发育及生长状况等。
1.3 评估指标
①智力发育、体格生长指标:分别对患儿6月、1岁及2岁时采用Gessell婴幼儿发育量表[5]对新生儿智力发育程度即发育商(DQ)评价;同时记录患儿体格生长指标,其中体重、身长等体格生长指标参考相关文献评估[6-7]。②甲状腺激素:分别统计分析两组患儿6月、1岁及2岁时静脉血清TSH、FT3、FT4水平。
1.4 统计分析
应用SPSS 22.0统计分析两组患儿智力发育、体格生长以及甲状腺激素水平,行t检验;并对CH患儿患病主要危险因素进行单因素与多因素 logistic回归分析。P<0.05为差异具有统计学意义。
2 结果
2.1 TG突变筛查
43例先天性甲状腺功能减低症患儿,筛查出TG突变36例(83.7%),7例(16.3%)未检出。
2.2 智力发育及体格生长指标
分析表1可知,在6月时DQ在CH患儿<30 d组高于≥30 d组(P<0.05);在1岁、2岁时同组DQ值无差异(P>0.05),但<30 d组高于≥30 d组(P<0.05)。<30 d组CH患儿6月、1年、2年时体质量与身长均大于≥30 d组患儿(P<0.05)。
2.3 甲状腺激素水平
分析表2可知,两组CH患儿在6月、1岁以及2岁时FT3、FT4、TSH水平均无差异(P>0.05)。
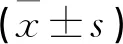
表1 两组CH患儿不同发育阶段智力发育及体格生长指标比较
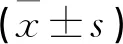
表2 两组CH患儿不同发育阶段甲状腺激素水平比较
2.4 CH患病单因素分析
分析表3可知,孕妇年龄、先兆流产、妊娠期高血压、妊娠期糖尿病、妊娠期甲状腺、甲状腺疾病家族史以及用药史孕妇的CH患儿与健康新生儿存在差异(P<0.05)。
2.5 CH患病多因素 logistic回归分析
通过分析可知,孕妇年龄≥35岁、妊娠期并发甲状腺疾病、有甲状腺家族史、有用药史等均为CH患病危险因素。见表4。
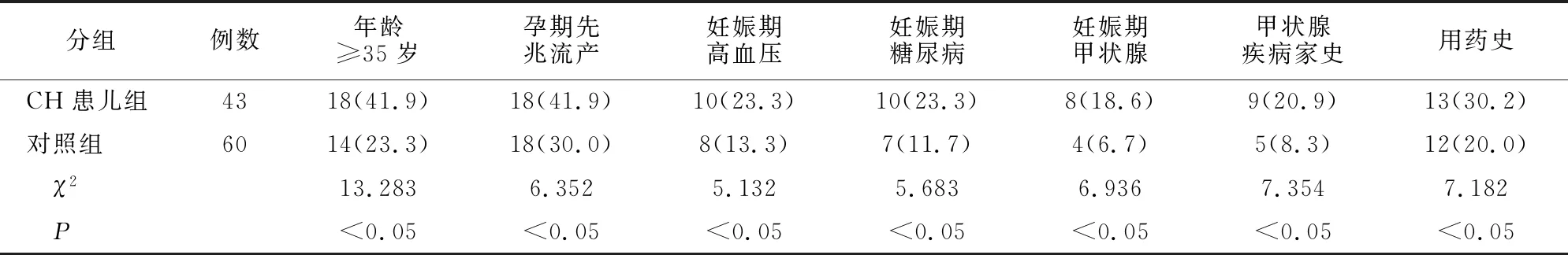
表3 CH患儿患病单因素分析[例(%)]
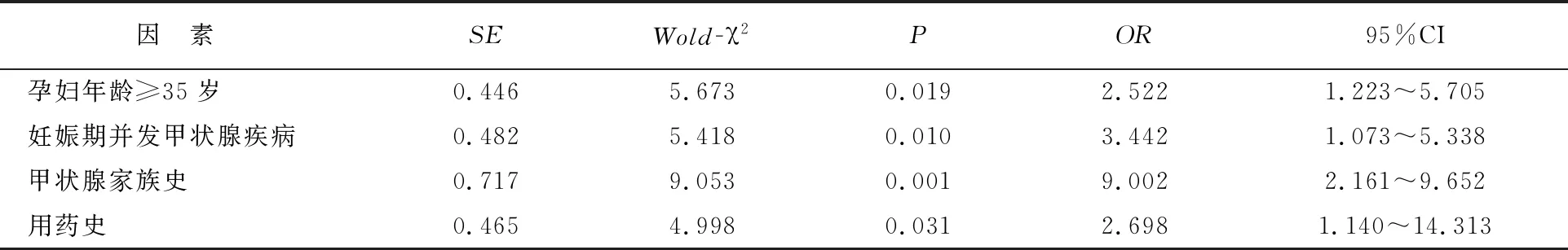
表4 CH患儿患病危险因素logistic回归分析
3 讨论
甲状腺不发育、发育不全或异位,是造成先天性甲状腺功能低下最主要的原因,占80%~85%,其中1/3病例为甲状腺完全缺失,其余为发育不全或在下移过程中停留在异常部位形成异位甲状腺,部分或完全丧失其功能[8-9]。造成甲状腺发育异常的原因尚未阐明,目前认为可能与甲状腺转录因子(如TITF-1,TIF-2,PAX8)的基因突变关系密切[7-8]。CH治疗越早预后越佳,一般认为如果在2个月内发现,及时治疗,终身服药,智力基本正常。新生儿疾病筛查使患儿有可能在出生后1~3周得到确诊和治疗[10-13]。由于CH是儿童时期常见的致残致愚性疾病,对社会和家庭造成沉重负担[14-15]。因此,研究CH的分子遗传学机制,摸清CH患者致病基因的种类及其常见基因突变类型,不仅可为阐明CH的发生机理和遗传学干预提供理论依据,为基因治疗奠定基础,而且有利于开展产前诊断,及早发现带有严重不良基因的胎儿。
本文再次证实新生儿筛查意义重大,可结合临床治疗方案对患儿进行评估;对于可能出现不严重、干预效果较好的基因可实施临床干预而实现优生目的。在因甲状腺激素合成缺陷导致CH的众多基因中(如NIS、PDS、TPO、DUOX2、DUOXA2、DEHAL1等),TG基因突变的研究受到国际同行越来越多的关注。本研究收集湖南省新生儿疾病筛查确诊先天性甲状腺功能减低症患儿血液样本,结合患儿甲状腺超声结果,利用改良型的变性高效液相层析技术(DHPLC)高通量多态/突变筛选平台对甲状腺球蛋白基因的启动子区域及全部外显子进行基因突变筛查,诊断出TG突变36例(83.7%)。此外,基因诊断CH灵敏度低于传统方法,可能是由于除了TG突变外,其它基因突变可能诱发CH疾病;另外,CH发病受多种因素影响,如高龄孕妇、妊娠期并发甲状腺疾病、甲状腺家族史以及用药史等。
现阶段临床主要利用甲状腺制剂实施替代治疗,促进患儿甲状腺功能逐步恢复。甲状腺素对脑组织生长发育有重要促进作用,缺乏时会对神经系统发育造成严重影响;此外,甲状腺素对牙齿、骨骼的生长具有很强的促进作用,合成不足则会对小儿体格发育造成严重影响。本文研究表明,<30 d治疗的产妇CH患儿在6月时DQ值更高,以及患儿6月、1年、2年时体质量和身长均更高,表明对CH患儿及时治疗有助于促进患儿的生长发育。此外,本文研究发现,孕妇年龄≥35岁、妊娠期并发甲状腺疾病、甲状腺家族史以及用药史均为CH患病主要危险因素,提示对产前指导有一定参考。
