阳光玫瑰葡萄酵母菌多样性及酿造学特性分析
2020-12-22刘晓柱张远林曾爽黎华张松黄名正
刘晓柱,张远林,曾爽,黎华,张松,黄名正
(贵州理工学院,贵州贵阳550003)
葡萄酒的发酵是一个复杂的多菌种参与的过程,酵母菌在其中发挥着至关重要的作用[1]。根据酵母菌株酒精产能差异,将酵母菌分为酿酒酵母(Saccharomyces cerevisiae)和非酿酒酵母(non-Saccharomyces yeast)两大类[2]。酿酒酵母酒精代谢能力强,发酵过程中产生大量的乙醇[3]。非酿酒酵母主要在发酵前期发挥作用,其产生的甘油、酸类、酯类、醛类、高级醇等次级代谢物,决定着葡萄酒的复杂度和丰富性,最终影响葡萄酒的品质,使得葡萄酒具有独特的典型性[4]。因而,采用不同酵母菌株酿造的葡萄酒品质具有差异性。然而,酵母菌的分布具有地域时空性,分析特定品种、特定地域的酵母菌株多样性,对进一步开发利用酵母菌资源具有重要的意义[5]。
阳光玫瑰(Shine Muscat),鲜食葡萄的一种,为“安芸津21号”与“白南”两个品种的杂交后代,属于欧美杂交品种,被称为葡萄界的“爱马仕”[6]。该品种果肉脆硬,糖度高达18%以上,玫瑰香味浓郁,无核,营养丰富以及独特的风味特点,深受广大消费者的喜爱[7]。此外,该品种还具有抗病性较强,果实不易裂,耐贮运等优点[8]。目前在我国西北地区[9]、华北地区[10]、中部地区[11]以及南部地区[12]均有广泛种植。
目前国内外,对葡萄酵母菌的研究主要集中在酿酒葡萄品种,对于鲜食葡萄酵母菌资源的研究和开发程度还比较低,更未见有对阳光玫瑰葡萄中酵母菌多样性以及酿酒特性的研究报道。因此,本研究采用传统的分离方法,并结合分子生物学技术,对阳光玫瑰葡萄酵母菌资源多样性进行分析。并从糖发酵性能、生长特性、糖耐受性、酒精耐受性、二氧化硫耐受性以及酸耐受性等方面分析酵母菌的酿酒特性,对生产优质葡萄酒提供潜在优质酵母菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
阳光玫瑰葡萄:2018年9月采自贵州省开阳县禾丰霖葡萄庄园。采集大小均一,无病害的葡萄样品,带至实验室,进行酵母菌的分离。
1.1.2 试剂
赖氨酸固体培养基、酵母提取物蛋白胨葡萄糖培养基(yeast extract peptone dextrose medium,YEPD)、WL 培养基(wallerstein laboratory nutrient agar,WL)、亚硫酸铋、葡萄糖、蛋白胨、酵母粉、琼脂粉:贵州博奥瑞杰生物科技有限公司;对硝基苯基-β-D吡喃葡萄糖苷(p-nitrophenyl-β-D glucopyranoside,p-NPG):中国上海源叶生物公司;ZYMAFLORE X16(简称X16)酿酒酵母:法国LAFFORT公司;其余试剂均为国产分析纯。
1.2 仪器设备
紫外分光光度计(UH5300):日本日立公司;pH仪(雷磁PHSJ-3F):上海仪电科学仪器股份有限公司;倒置显微镜(CKX41):日本OLYMPUS公司;体视显微镜(SZM):中国宁波舜禹仪器有限公司;PCR仪(Biorad T100TM):美国伯乐公司。
1.3 方法
1.3.1 菌株分离
参考徐建坤等[13]、刘小珍等[14]方法进行阳光玫瑰葡萄酵母菌的分离。取2 g阳光玫瑰葡萄皮,装于含100 mL已灭菌的YEPD液体培养基中,28℃,160 r/min摇床培养,富集培养48 h后取培养液,按照梯度稀释法,进行梯度稀释,稀释液取 10-4、10-5、10-63个梯度,涂布在YPD固体培养基上,28℃,培养48 h。然后挑取每个平板上的单克隆,多次划线于YPD固体培养基上,直至获得纯的单克隆为止。
1.3.2 菌株鉴定
挑取YPD培养基上分离的单克隆,继续划线于赖氨酸培养基上,28℃,培养72 h,根据赖氨酸培养基上菌落长势特点,进行初步分类。
挑取YPD培养基上分离的单克隆,继续划线于WL固体培养基上,28℃,培养72 h,根据WL培养基上菌落的颜色、形态、光泽等表型,进一步进行分类采用体式显微镜进行菌落特征的拍照。
对WL培养基上分类的菌株,挑选出代表菌株,进行结晶紫染色,于光学显微镜下,观察细胞形态,并拍照。
挑取WL培养基上代表菌株,YPD培养基培养24h,参考Holm C等方法[15]提取酵母菌DNA,并进行26S rDNA D1/D2区域的聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR反应体系为:25 μL Taq PCR Master Mix(2×),2 μL 的 NL1 引物(10 μmol),2μL 的NL4 引物(10 μmol),DNA 100 ng,反应总体积 50 μL。PCR结束后,取PCR反应液5 μL,1%琼脂糖凝胶电泳进行扩增产物的检测。PCR产物送至生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI上进行BLAST同源序列搜索比对。
1.3.3 菌株酿造学特性分析
1.3.3.1 生长曲线测定
将鉴定出的各类酵母代表性菌株以108cfu/mL接种至YPD液体培养基中,28℃、180 r/min恒温培养,每间隔4 h取样一次,平行重复3次,在600 nm波长处分别测定菌液OD值。取样时间40 h,共计取样10次。根据每个时间点及测定的OD600nm值绘制菌株生长曲线。
1.3.3.2 糖发酵试验
将各供试菌株分别以108cfu/mL接种于含终浓度为2%葡萄糖、蔗糖、麦芽糖、乳糖、半乳糖的0.6%的酵母浸粉溶液中,酵母浸粉溶液置于含杜氏小管的试管中,28℃恒温培养48 h,观察此间杜氏小管顶部是否有气泡。若有气泡产生,记为“+”(阳性反应),反之,则记为“-”(阴性反应)。
1.3.3.3 生理耐受性测定
葡萄糖耐受性:将各供试菌株以108cfu/mL接种于含葡萄糖质量浓度分别为 100、150、200、250、300 g/L 的YPD液体培养基中,平行重复3次,28℃、180r/min培养34 h。培养结束后,在600nm波长处分别测定菌液OD值。
酒精耐受性:将各供试菌株以108cfu/mL接种于含酒精体积分数分别为3%、6%、9%、12%、15%的YPD液体培养基中,平行重复3次,28℃、180r/min培养34h。培养结束后,在600 nm波长处分别测定菌液OD值。
SO2耐受性:将各供试菌株以108cfu/mL接种于含SO2质量浓度分别为 50、100、150、200、300 mg/L 的 YPD 液体培养基中,平行重复3次,28℃、180 r/min培养34 h。培养结束后,在600 nm波长处分别测定菌液OD值。
酸耐性:将各供试菌株以108cfu/mL接种于含柠檬酸酸度分别为1.5%、2.0%、2.5%、3.0%的YPD液体培养基中,平行重复3次,28℃、180 r/min培养34 h。培养结束后,在600 nm波长处分别测定菌液OD值。
1.3.3.4 β-葡萄糖苷酶测定
采用对硝基苯基-β-D吡喃葡萄糖苷(p-NPG)法分各供试菌株产β-葡萄糖苷酶能力[16]。将各供试菌株以106cfu/mL接种于YPD培养基中,28℃、200 r/min培养72 h,取发酵液于离心管中,4℃、8 000 r/min,离心10min,上清液作为粗酶液。取100μL粗酶液与200μL 35 mmol/L p-NPG混匀,40℃保温30 min,加入2 mL 1 mol/L Na2CO3终止反应,平行重复3次,400 nm波长处测定OD。酶活力单位(U)定义为:50℃、pH 5.0条件下,1 min水解p-NPG产生1 μmol对硝基苯酚所需酶量。
1.3.3.5 硫化氢测定
取10 μL浓度为108cfu/mL的各供试菌株的菌液滴加至亚硫酸铋培养基表面上的无菌滤纸片上,液体完全吸收后,28℃倒置培养5 d,观察滤纸片变色情况。菌株产硫化氢能力由高到低,显色情况分别为显棕黑色、棕色、墨绿色、淡墨绿色及不显色。
1.4 数据分析
采用Excell 2007对数据进行整理和作图,数据结果以平均值±标准差表示。AdobePhotoshopCS辅助作图。
2 结果与分析
2.1 酵母菌株的分离与鉴定
从YPD液体培养基富集培养液中,共分离到72株微生物菌株,编号为YM1~YM72,结合其在YPD培养基上的形态特征,初步鉴定46株为酵母菌。
46株酵母菌株划线于赖氨酸培养基上,结果发现基本上不生长。继续将这46株酵母菌株划线于WL培养基上,其形态特征见表1和图1。

表1 酵母菌在WL培养基上菌落形态Table 1 Morphology of yeasts on WL medium

图1 各类型代表菌株在WL培养基上的菌落特征和显微细胞特征Fig.1 Colony characteristics and microscopic cell characteristics of the representative strains from different types on WL medium
所有菌落形态几乎为圆形或者椭圆形,菌落颜色多为白色,淡黄色或者绿色(图1)。选取每一类别中典型菌株1例,结晶紫染色,显微镜下观察细胞形态特点,发现大部分细胞为柠檬状、椭圆形或者圆形。
采用分子生物学方法继续对46株酵母菌进行鉴定,结果表明第一类菌株属于葡萄汁有孢汉逊酵母(Hanseniaspora uvarum);第二类酵母属于盔形毕赤酵母(Pichia manshurica);第三类属于季也蒙毕赤酵母(Meyerozyma guilliermondii);第四类属于加利福尼亚假丝酵母(Candida californica);第五类属于茶叶籽酵母(Meyerozyma caribbica);第六类属于异常汉姆酵母(Wickerhamomyces anomalus);第七类属于拜耳结合酵母(Zygosaccharomyces bailii);第八类属于尖端假丝酵母(Candida apicola);第九类属于 Starmerella bacillaris;第十类属于西文毕赤酵母(Pichia occidentalis)。
2.2 酵母菌株生长曲线
法测定各菌株的生长曲线。菌株的生长曲线如图2所示。
由图2可知,与商业化酿酒酵母X16相比,YM2、YM21、YM15在整个检测生长周期内,生长速度和菌体浓度均低于X16。YM68在整个生长周期内,菌体变化趋势与X16较为一致。YM3、YM13、YM18和YM50在对数生长期前,其菌体浓度均低于X16。酿酒酵母X16培养12 h即可达到对数生长期,YM21在12 h也可达到对数生长期,但菌体整体浓度要低于X16。YM3、YM18、YM62培养16 h方可达到对数生长期。

图2 10株酵母菌生长曲线Fig.2 The growth curve of sugar of 10 yeasts
2.3 酵母菌株糖代谢能力
10株酵母菌糖发酵试验见表2。

表2 10株酵母菌糖发酵试验Table 2 Results of sugar fermentation tests of 10 yeasts
由表2结果可知,除了YM2不能利用半乳糖发酵外,其它所有酵母菌株均可以利用葡萄糖、蔗糖、麦芽糖、乳糖和半乳糖进行发酵。
2.4 酵母菌株生理耐受性
10株酵母菌糖耐受性结果见图3。

图3 10株酵母菌糖耐受性结果Fig.3 Results of sugar tolerance tests of 10 yeasts
所有酵母菌株糖耐受性均低于酿酒酵母X16,特别是菌株YM13、YM21和YM50糖耐受性较差。菌株YM62在250 g/L葡萄糖浓度范围内,菌株生长情况与X16较为一致。菌株YM13、YM15、YM68菌体浓度随着葡萄糖浓度的增加,呈降低趋势;相反,菌株YM2、YM18、YM21、YM39、YM62 菌体浓度随着葡萄糖浓度的增加,出现先增加,后降低的趋势。
10株酵母菌乙醇耐受性结果见图4,10株酵母菌二氧化硫耐受性结果见图5。

图4 10株酵母菌乙醇耐受性结果Fig.4 Results of ethanol tolerance tests of 10 yeasts
由图4可知,与酿酒酵母X16相比,绝大部分菌株乙醇耐受性较差,乙醇耐受性低于9%。菌株YM39在3%的乙醇浓度处理下,菌株生长较差,YM68可耐受9%的乙醇浓度。
由图 5 可知,菌株 YM3、YM15、YM18、YM62、YM68对二氧化硫具有较好的耐受性,可耐受300 mg/L的二氧化硫。菌株YM13、YM39、YM50对二氧化硫耐受性相对较差。菌株YM39菌体浓度随着二氧化硫浓度增加,呈现出增大的趋势。
10株酵母菌酸耐受性结果见图6。
绝大部分菌株对酸具有较好的耐受性,可耐受35 mg/L的柠檬酸处理,但菌株YM21酸耐受性较差。菌株YM39可耐受25 mg/L的柠檬酸处理。
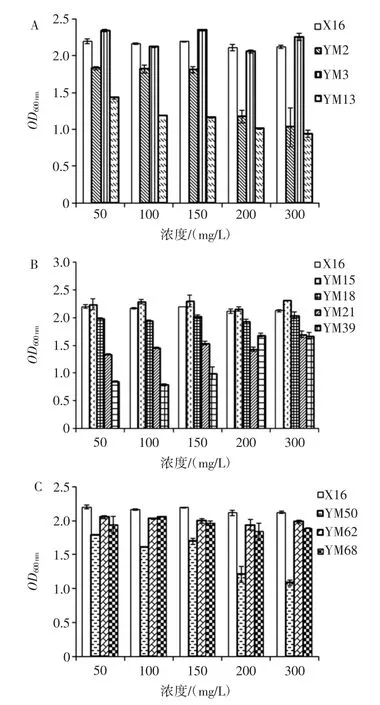
图5 10株酵母菌二氧化硫耐受性结果Fig.5 Results of sulfur dioxide tolerance tests of 10 yeasts
2.5 β-糖苷酶产生能力
采用p-NPG显色法分析10株酵母菌β-糖苷酶产生能力,标准曲线方程式为y=21.76x+0.015,R2=0.999,吸光值与对硝基苯酚浓度之间为线性关系。菌株产β-糖苷酶结果见表3。
菌株YM21、YM15主要为胞外产酶,胞内酶活和细胞壁酶活较低;菌株YM2、YM13胞内和胞外酶活都较高;菌株YM18细胞3个部位的产酶均较高;菌株YM68细胞壁的酶活最高。
2.6 硫化氢产生能力
分析10株酵母菌β-糖苷酶产生能力,结果见图7。
菌株YM21、YM13滤纸片不显色,不产硫化氢;菌株YM2、YM18、YM50滤纸片显棕黑色,产硫化氢能力较强;菌株 YM3、YM15、YM62、YM68 滤纸片显棕色,且颜色比对照组X16深,因此产硫化氢能力超过X16。

图6 10株酵母菌酸耐受性结果Fig.6 Results of acid tolerance tests of 10 yeasts

表3 10株酵母菌β-葡萄糖苷酶产生能力Table 3 Determination of β-glucosidase production of 10 yeasts mU/mL
3 结论
阳光玫瑰为日本农业食品产业技术综合研究机构培育的一种欧美杂交种,其果皮黄绿色,具有浓郁的玫瑰香气,含糖量也较高。自2006年前后由日本引入中国,并迅速在中国传播开来。目前,几乎涵盖了中国全部省域。作为鲜食葡萄的一种,目前对其研究主要集中在栽培方面,其它方面的研究还几乎一片空白。本研究,以西南地域的贵州省栽培阳光玫瑰为研究对象,分离并鉴定了其酵母菌群的结构特征,进而分析了菌群的酿酒特性。结果表明,从阳光玫瑰上酵母菌种类较多,共分离鉴定到10大类,包含汉逊酵母属(Hanseniaspora sp.)、毕赤酵母属(Pichia sp.)、假丝酵母属(Candida sp.)以及威克酵母属(Wickerhamomyces sp.)等。
菌群酿造学特性分析结果表明,阳光玫瑰品种上存在着一些具有较好酿造特性的菌种,如产硫化氢较低的YM21、YM13,β-糖苷酶较高的YM18菌株以及生理耐受性较好的YM68菌株等。但还需从不同水平进行发酵试验,以进一步评价其生产性能。本研究首次系统分析了阳光玫瑰酵母种群多样性,并进一步分析了其酿造特性,为进一步开发利用阳光玫瑰野生酵母菌资源提供理论参考。
