扁桃属植物的化学成分及药理作用研究进展
2020-12-14李倩权博文常虹周红兵白万富石松利
李倩 权博文 常虹 周红兵 白万富 石松利

摘 要 目的:为综合利用与深入研究扁桃属植物资源提供理论依据。方法:在查阅历代古籍的基础上,以“扁桃属”“蒙古扁桃”“长梗扁桃”“西康扁桃”“榆叶梅”“扁桃”“矮扁桃”“化学成分”“药理作用”等为中英文关键词,在中国知网、万方数据、维普等数据库中组合检索1985年1月-2020年6月发表的相关文献,对扁桃属植物的化学成分、药理作用及其他用途进行综述。结果与结论:蔷薇科扁桃属植物最早记载于《神农本草经》,是我国少数民族常用药;在我国主要有蒙古扁桃Amygdalus mongolica(Maxim.)Ricker、长梗扁桃A. pedunculata Pall、西康扁桃A. tangutica (Batal.)Korsh、榆叶梅A. triloba (Lindl.) Ricker、扁桃A. communis L.、矮扁桃A. nana L.等6种;其化学成分主要有黄酮类、氰苷类、不饱和脂肪酸类等,可通过增强器官组织抗氧化酶的活力、降低炎症及纤维化相关指标水平、干预纤维化相关关键生物标志物的生成,参与精氨酸/脯氨酸、烟酸/烟酰胺、戊糖/葡萄糖等代谢通路来发挥降血脂、抗氧化、抗纤维化等多种药理活性;同时,其在绿色农药、植物活性炭、冷饮食品等农业、工业、食品行业还具有其他利用价值。目前,关于扁桃属植物槲皮素、山柰酚、苦杏仁等以及其他有待发现的单体化合物的挖掘,发挥的药效是基于单体化学成分还是多种化学成分联合作用及药理作用机制的探索,关于该属植物降血脂、抗器官纤维化、抗炎、增强免疫等临床研究尚待进一步研究。
关键词 扁桃属;化学成分;药理作用;研究进展
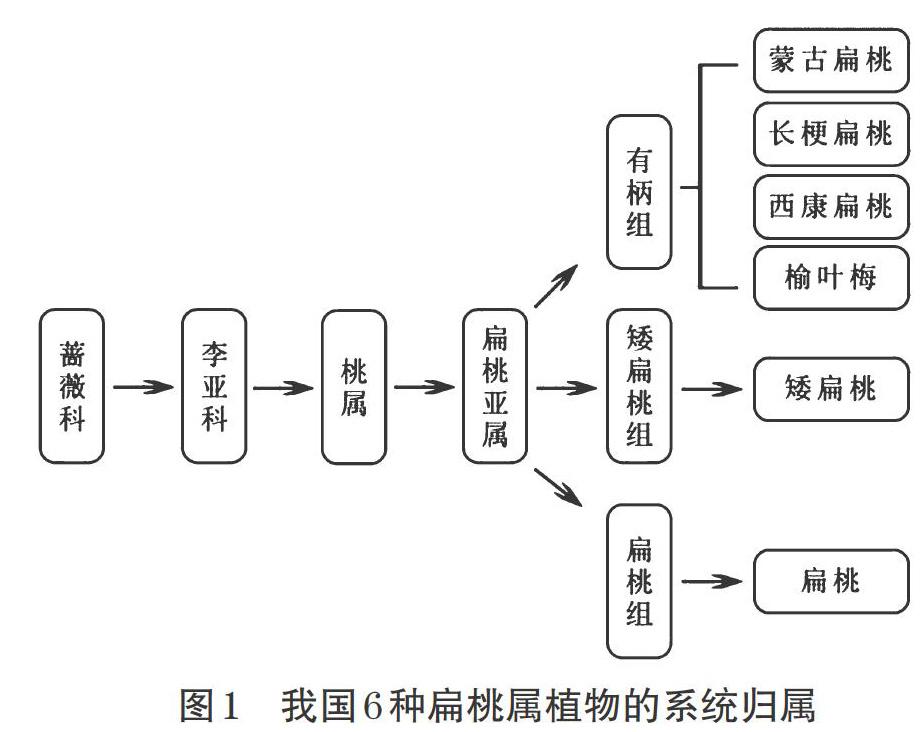
扁桃属(狭义称之为“扁桃亚属”[1])植物隶属于蔷薇科李亚科,世界上有52~53个种,主要分布于亚洲、欧洲的多个国家,我国现有包括野生和栽培种扁桃共6种,分别为蒙古扁桃Amygdalus mongolica(Maxim.)Ricker、长梗扁桃A. pedunculata Pall、西康扁桃A. tangutica (Batal.)Korsh、榆叶梅A. triloba (Lindl.) Ricker、扁桃A. communis L.、矮扁桃A. nana L.,主产于内蒙古、甘肃、宁夏、新疆塔城、东北三省等地[2],结合《中国植物志》对上述6种扁桃属植物进行系统归属[3],如图1所示。
扁桃,出自古波斯国,唐代时传入中国,唐代段成式在《酉阳杂俎》中记载“西域诸国并珍之[4]”,后通过丝绸之路在我国新疆及陕甘宁地区栽培,便有了“扁桃出回回旧地,今关西诸土亦有[5]”。郁李仁作为长梗扁桃的干燥成熟种子,首次作为中药记载于《神农本草经》:“郁李仁,味酸、平。主大腹水肿,面目四肢浮肿,利小便水道”;之后,《本草经疏》《本草新编》《滇南本草》等著作均对扁桃的利水消肿、润燥通便、止咳平喘等功效有所记载[6]。蒙古扁桃作为一味传统中药材,可代“郁李仁”以种仁入药[7],其性平、味苦,主治咽喉干燥、干咳及支气管炎、阴虚便秘,具有润肠通便、利尿的功效[8]。《维吾尔药志》记载,扁桃具有健脑、润肠等作用,对高血压、肺病、肠胃病等有显著疗效[9]。如今,蒙古扁桃、矮扁桃等已被《中国植物红皮书》收录为珍稀濒危植物,并被确定为国家二级保护植物[10]。
扁桃属植物是一种药食同源植物,富含黄酮类、氰苷类、不饱和脂肪酸类、维生素及矿物质元素等多种化学成分,可通过增强器官组织抗氧化酶的活力、减轻炎症及纤维化相关指标、干预纤维化相关关键生物标志物及参与代谢通路、调节磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)/B细胞淋巴瘤2-基因(Bcl-2)/Bcl-2相关X蛋白(Bax)通路等發挥降血脂、抗氧化、降血糖、抗纤维化、抗炎、增强免疫等药理作用;此外,在农业、工业、食品业等也有很好的开发前景[11-15]。
笔者在查阅历代古籍的基础上,以“扁桃属”“蒙古扁桃”“长梗扁桃”“西康扁桃”“榆叶梅”“扁桃”“矮扁桃”“化学成分”“药理作用”等为中英文关键词,在中国知网、万方数据、维普等数据库中组合检索1985年1月-2020年6月发表的相关文献,对扁桃属植物化学成分、药理作用及其他用途进行归纳与总结,从多角度、全方面阐明扁桃属药用及其他使用价值,以期为其临床应用提供理论基础,同时为扁桃属植物资源在食药同源产业的合理开发利用开辟新思路。
1 化学成分
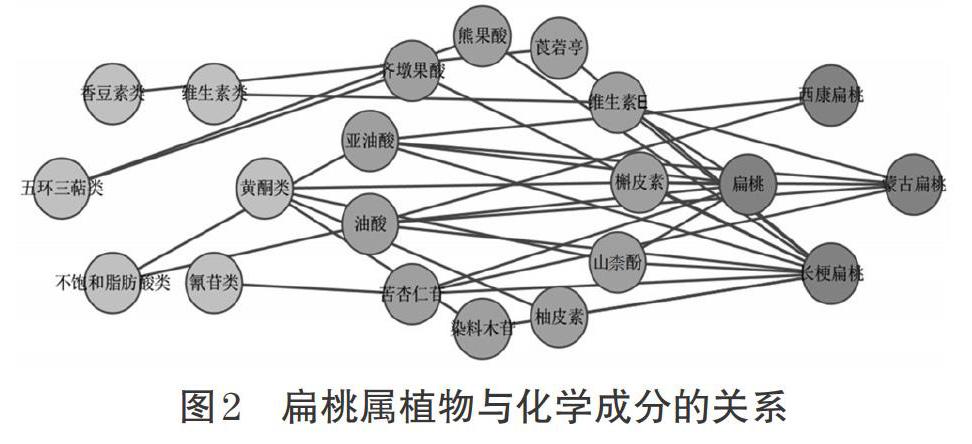
化学成分是发挥药理作用的物质基础,扁桃属植物富含黄酮类、氰苷类、不饱和脂肪酸类、生物碱类、多糖类、萜类、香豆素类、有机酸、维生素类、矿物质元素、蛋白质、氨基酸等多种药用及营养成分。扁桃属植物与其所含各类化学成分的关系示意图见图2。
1.1 生物碱类
生物碱类天然产物数量众多,作用广泛,可抗高血压[16]、调节血糖、血脂[17]、抗菌[18]、抗肿瘤、提高机体免疫功能等[19],具有广阔的开发前景。贾小叶等[20]采用酸性染料比色法测得蒙古扁桃药材种仁总生物碱含量为0.182 0 mg/g。周红兵等[21]采用同样的方法比较蒙古扁桃及长梗扁桃叶片与种仁中生物碱含量,测得蒙古扁桃与长梗扁桃药材种仁中总生物碱含量分别为0.203 9、0.147 2 mg/g,叶片中总生物碱含量分别为0.343 8、0.321 5 mg/g,表明蒙古扁桃总生物碱含量明显高于长梗扁桃总生物碱含量。上述研究为扁桃属药用植物总生物碱的提取及含量测定提供了方法指导,但目前扁桃属植物生物碱单体化合物的分离鉴定还亟需深入研究。
1.2 黄酮类
黄酮类化合物是一类低毒、高效的天然抗氧化剂,主要包括黄酮与黄酮醇、二氢黄酮与二氢黄酮醇、异黄酮与查尔酮等16类,可预防衰老并治疗自由基引发的相关疾病[22];具有抗炎镇痛、调节免疫、抗肿瘤、抗心肌及脑缺血、降糖降脂、改善胰岛素抵抗等作用[23-24]。有研究采用紫外-可见分光光度法分别对扁桃属植物总黄酮含量进行测定,结果蒙古扁桃总黄酮含量为22.73~32.79 mg/g[25]、长梗扁桃总黄酮含量为1.603 mg/g[26]、榆叶梅总黄酮含量为15.546%[27]、扁桃总黄酮含量为12.77 mg/g[28]。有研究者使用高效液相色谱(HPLC)法确定了扁桃属植物长梗扁桃中黄酮醇类单体化合物山柰酚及槲皮素、二氢黄酮类柚皮素及异黄酮类染料木苷含量[29-32],结果见表1。目前,所发现的扁桃属单体化合物数量并不多,仍有很大的探索空间。
1.3 氰苷类
苦杏仁苷作为氰苷类化合物,已成为一些药物的有效成分,可用于治疗哮喘、支气管炎、肺气肿等多种疾病[33]。苦杏仁苷又称扁桃苷,广泛存在于蔷薇科植物种仁中,是扁桃属植物的主要化学成分,在防治肝、肾、肺纤维化方面具有特殊的药用价值[34]。另外,苦杏仁苷还具有抗动脉粥样硬化、免疫调节、镇痛消炎、抗肿瘤等药理作用[35-36]。目前,采用HPLC法测得的蒙古扁桃中苦杏仁苷含量为1.38%~4.8%、长梗扁桃中含量为3%、扁桃中含量为1.03%[37-39],见表1。笔者推测,扁桃属中仍有其他植物能发现苦杏仁苷化合物。
1.4 其他
多糖作为构成生命的四大基础物质之一,具有免疫调节[40]、提高免疫功能及抗肿瘤作用[41],在治疗糖尿病肾病上有极大潜力[42]。目前研究发现,蒙古扁桃中多糖含量为7.78%[43]、榆叶梅中含量为2.809%[44]。蛋白质与机体的发育密不可分,有研究使用凯氏定氮法测得扁桃属植物中蛋白质含量为:蒙古扁桃种仁22.21%、蒙古扁桃叶片12.99%[45]、长梗扁桃25.7%[46]、榆叶梅60.12%[47]。扁桃属植物富含油脂,种仁出油率可达50%以上[48],有研究者采用气相色谱-质谱联用(GC-MS)法对其成分进行分析,发现种仁油脂中含有锌、铁、钙等矿物质元素及多种维生素,富含以油酸、亚油酸(含量见表1)为主的16种不饱和脂肪酸,且氨基酸含量丰富、种类齐全,必需氨基酸含量较高[49],符合国家食用油三级质量标准要求,是西北地区具有很高开发价值的营养保健油脂[50-55]。从扁桃属植物中提取的天然维生素E为低α型混合生育酚,有研究者采用HPLC法测得其含量(见表1),可作为抗氧化剂用于医药、食品等各个方面[56-58]。扁桃属植物五环三萜类化合物,有研究者采用HPLC法测得长梗扁桃中齐墩果酸、熊果酸及香豆素类化合物莨菪亭等含量[30](见表1)。郑东华等[59]采用酸碱返滴定法测得蒙古扁桃药材中有机酸含量为2.56%。李聪[60]研究发现,扁桃属植物可能含酚类、鞣质类、甾体类、皂苷类化合物等,值得进一步深入挖掘。
2 药理作用
2.1 降血脂、抗氧化、降血糖
高血脂已经成为心血管疾病的危险因素,而黄酮类、多糖类、生物碱类、挥发油及不饱和脂肪酸类等中药有效成分具有良好的降血脂作用[61]。Zheng QN等[11]研究发现,蒙古扁桃油可显著降低高脂血症模型大鼠血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)水平和肝脏中丙二醛(MDA)含量,提高肝脏超氧化物歧化酶(SOD)活性和还原型谷胱甘肽(GSH)含量,表明蒙古扁桃油中丰富的不饱和脂肪酸可通过增强肝脏组织抗氧化酶的活力来修复肝脏组织。随后该课题组研究发现,蒙古扁桃种仁正丁醇提取物[62]、石油醚提取物同样具有降血脂作用[63];长梗扁桃正丁醇部位同样能显著降低血清TC、三酰甘油(TG)、LDL-C、MDA、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和碱性磷酸酶(ALP)水平,以及肝系数和动脉硬化指数,可显著提高SOD活性、SOD/MDA和HDL-C/TC比值,在降血脂的同时对肝脏也有保护作用[64]。
人体的抗氧化系统越完善,机体抗氧化能力则越强。宋根伟等[65]研究扁桃的体外抗氧化活性作用,发现其石油醚、乙酸乙酯、正丁醇提取物均表现出较好的还原力、清除羥自由基和超氧阴离子自由基的能力。近些年,全球糖尿病的发病率呈逐年上升趋势,其并发症已严重影响到人们的生活质量。吴培赛等[66]建立2型糖尿病大鼠模型,以水煎法制备蒙古扁桃提取物后对模型大鼠给药,结果显示,大鼠空腹血糖显著降低、糖耐量显著升高、胰腺内胰岛素阳性表达显著增加,其作用机制可能是蒙古扁桃提取物通过提高胰岛素的表达水平,从而降低模型大鼠的空腹血糖、提高其糖耐量。
2.2 抗纤维化
2.2.1 抗肝纤维化 肝纤维化是各种慢性肝病向肝硬化发展过程中的关键步骤,目前尚无有效的干预手段,应尽早对其进行早期诊断和评估。现代医学对肝纤维化的治疗多采用干扰素、核苷类似物等药物,但易产生耐药性[67]。蒙医学根据其独特理论及治疗方法,采用德都红花-7味散、蒙古山萝卜、额力根等传统单方或复方治疗肝纤维化,不良反应较轻[68]。吴桐等[69]研究发现,蒙古扁桃石油醚提取物可提高四氯化碳所致肝纤维化模型大鼠血清SOD含量,同时降低ALT、AST、ALP活性以及降低肝纤维化指标透明质酸(HA)、Ⅲ型前胶原(PCⅢ)、MDA的含量和肝组织羟脯氨酸(HYP)水平,对模型大鼠肝纤维化有保护作用。随着蒙医学对肝纤维化的认识不断深入,扁桃属植物防治纤维化的研究取得了一定的进展,但尚不明确其药效物质及作用机制。因此,将传统医学的优势与现代科学技术相结合,应用于中药物质基础及作用机制研究,可促进肝纤维化的治疗和研究发展。
2.2.2 抗肾纤维化 肾纤维化是慢性肾脏病进展的共同病理特点,部分中药可通过减轻氧化应激、炎症反应、调节免疫等改善肾纤维化的程度,从而延缓慢性肾脏病进展[70]。贾小叶等[71]采用单侧输尿管结扎术构造肾纤维化大鼠模型,发现蒙古扁桃石油醚、正丁醇提取物可增强模型大鼠肾组织及血清中SOD活性,降低组织和血清中MDA水平、组织中HYP水平以及血清中肌酐、尿素氮、白蛋白水平,可有效抗肾纤维化。在此基础上,Chang H等[12]研究显示,蒙古扁桃石油醚、正丁醇提取物可通过干预S-腺苷甲硫氨酸、烟酸-D-核糖核苷酸等8个与肾纤维化相关的关键生物标志物,参与精氨酸/脯氨酸、烟酸/烟酰胺等6条代谢通路,从而有效缓解大鼠肾纤维化,并首次从代谢活性的角度揭示了其抗纤维化作用的机制。此外,郝海梅等[13]发现,蒙古扁桃总提物具有抗肾纤维化的作用,可通过干预吲哚葡萄糖醛酸酯、鸟氨酸、4-咪唑酮-5-丙酸等7个与肾纤维化相关的关键生物标志物,参与戊糖/葡萄糖合成、抗坏血酸/醛糖代谢等5条代谢通路,初步从代谢物的角度阐明蒙古扁桃总提物抗大鼠肾纤维化的作用机制。
2.2.3 抗肺纖维化 肺纤维化是以肺泡上皮细胞损伤、成纤维细胞过度增殖并伴炎症损伤、肺组织结构破坏等为主要病理特征的肺破坏性疾病[72]。目前,西医治疗药物多为糖皮质激素、免疫抑制剂和细胞毒性药物等,其不良反应多、远期疗效不稳定,而中医药在防治肺纤维化中取得了较好的进展[73]。权博文等[74]通过气管内滴注博莱霉素建立肺纤维化大鼠模型,观察蒙古扁桃4种极性部位(石油醚、乙酸乙酯、正丁醇和水)提取物对大鼠肺纤维化形成的影响,结果发现石油醚、正丁醇提取物可显著升高肺纤维化大鼠肺组织SOD活性,降低肺指数、肺组织中MDA含量及转化生长因子β1、Smad3蛋白表达水平和α-平滑肌肌动蛋白mRNA的表达水平,从而减轻大鼠肺泡炎症和肺纤维化程度,发挥抗肺纤维化的作用。
2.3 抗炎、扩张血管及降低血液黏度
刘灿辉等[75]在研究西康扁桃对兔及小鼠炎症状态、出血和凝血时间的影响中发现,用药后兔的耳血管灌流液流量增加,表明西康扁桃有明显的扩张血管作用;对10%鸡蛋清所致的小鼠足趾炎症有缓解效果,抗炎作用良好;能明显延长小鼠出血时间,但对凝血时间无影响。曾晓会等[14]研究扁桃苷和羟基红花黄色素A联合用药对激素性股骨头坏死大鼠的作用机制,结果显示两者联合用药可能通过调节PI3K/Akt/Bcl-2/Bax通路来降低大鼠的血液黏度,改善股骨头的病理性损伤,可为临床治疗提供理论依据。
2.4 增强免疫
研究表明,中药多糖、苷类、生物碱类、黄酮类活性物质对机体的免疫促进或抑制作用显著[76]。邓淑文等[77]研究发现,加饲扁桃浸出液后,可使小鼠体内血清溶血素含量增加,提示对小鼠体液免疫有显著影响;以1.0 g/kg扁桃浸出液促进刀豆蛋白A刺激引起的淋巴细胞增殖,表明其可促T细胞成熟,而且能对抗免疫抑制剂环磷酰胺引起的免疫缺陷,进一步证实扁桃对免疫活性的影响。扁桃可能通过不同途径作用于免疫系统,具体起效的活性因子有待进一步研究。
3 其他用途
在扁桃属植物的创新研究中发现,许多高附加值产品提高了扁桃属植物的综合利用率[15]。目前,开发高效、低毒、低残留的新型无公害农药成为热点,例如王宏喜[78]研究发现,蒙古扁桃叶水煮膏随着浓度的增加,对小菜蛾幼虫触杀与拒食的作用增强。有研究通过活性部位筛选发现,蒙古扁桃叶片乙醇提取物可抑制小菜蛾的生长发育[79],长柄扁桃叶的水提物具有很好的杀灭指环虫作用[80],显示出扁桃属植物具有开发为绿色农药的潜在价值。以长梗扁桃种壳为原料制得的活性炭吸附能力良好,可作为植物活性炭进行开发[81]。李聪等[82]发现,炒制冷榨工艺适合长柄扁桃油生产,出油率达46.2%,可将其放大工业化生产。榆叶梅花色素属黄酮类色素适用于冷饮食品,对防腐剂、蔗糖以及金属离子等均具有良好的耐受性,因此可与这些添加剂同时使用[83]。以扁桃和牛乳为原料设计制备的复合双蛋白乳固体饮料[84]、扁桃红枣汁复合饮料[85]等,风味独特且营养价值极高。由此可见,扁桃属植物在发挥药理作用的同时,在农业、工业、食品业等领域也显示出很好的开发前景,这也为扁桃属植物资源在食药同源产业的合理开发利用开辟了新思路。
4 结语
综上所述,目前对扁桃属植物化学成分的研究多集中于黄酮类及不饱和脂肪酸类,并以蒙古扁桃、长梗扁桃的研究较多。随着近年来对扁桃属植物药理活性的研究,除传统的抗氧化、降血脂作用外,还发现扁桃属植物在抗纤维化、辅助抗肿瘤方面也发挥了一定的作用,但其作用机制有待进一步深入研究。然而,目前对扁桃属植物的研究多集中于基础性药理研究,临床应用研究较少,因此可利用现代医药学技术,结合细胞生物学、分子生物学等相关领域知识,更深入地探索与开拓扁桃属植物的应用前景。
参考文献
[ 1 ] 赵一之.蒙古扁桃的植物区系地理分布研究[J].内蒙古大学学报(自然科学版),1995,26(6):713-715.
[ 2 ] 曾斌,李疆,罗淑萍,等.扁桃属植物种质资源鉴定的SSR分析研究[J].新疆农业科学,2009,46(1):18-22.
[ 3 ] 中国科学院植物志委员会.中国植物志.第三十八卷[M].北京:科学出版社,1986:28-30.
[ 4 ] 赵阳阳.略论古代丝绸之路中西动植物物种的交流[J].历史教学问题,2015,29(1):122-125.
[ 5 ] 罗琼.《本草纲目》中蔷薇科和百合科药物基原考[D].北京:中国中医科学院,2007.
[ 6 ] 刘星劼,张永清,李佳.中药郁李仁本草考证及化学成分研究[J].辽宁中医药大学学报,2017,19(12):100-103.
[ 7 ] 斯琴巴特尔.蒙古扁桃[J].生物学通报,2003,38(8):23- 24.
[ 8 ] 中国环保局.中国珍稀濒危保护植物名录:第一册[M].北京:科学出版社,1987:28-30.
[ 9 ] 刘勇民.维吾尔药志[M].乌鲁木齐:新疆科技卫生出版社,1999:39-42.
[10] 牛锦凤.八种珍稀濒危树种种质资源现状初报及保护与利用建议[J].宁夏林业通讯,2010(1):31-33.
[11] ZHENG QN,WANG J,ZHOU HB,et al. Effectiveness of amygdalus mongolica oil in hyperlipidemic rats and underlying antioxidant processes[J]. Toxicol Environ Health A,2017,80(22):1193-1198.
[12] CHANG H,LIU Q,BAI WF,et al. Protective effects of Amygdalus mongolica on rats with renal fibrosis based on serum metabolomics[J]. J Ethnopharmacol,2020. DOI:org/10.1016/j.jep.2020.112858.
[13] 郝海梅,贾小叶,周红兵,等.基于代谢组学的蒙古扁桃药材抗大鼠肾纤维化作用机制研究[J/OL].药学学报,2020:1-18[2020-06-19]. http://kns.cnki.net/kcms/detail/11.2163.R.20200619.1007.003.html.
[14] 曾晓会,卓俊城,杨帆,等.羟基红花黄色素A联合扁桃苷对激素性股骨头坏死大鼠的作用研究[J].中药新药与临床药理,2019,30(11):1284-1290.
[15] 罗竹梅,杨涛,施智宝,等.长柄扁桃油料开发现状及产业发展建议[J].安徽农业科学,2020,48(15):136-137、168.
[16] GUO Z,SUN H,ZHANG H,et al. Anti-hypertensive and renoprotective effects of berberine in spontaneously hypertensive rats[J]. Clin Exp Hypertens,2015,37(4):332- 339.
[17] 邱艳萍.黄连化学成分与药理作用研究进展[J].中医临床研究,2018,10(22):141-143.
[18] 李杨,左国营.生物碱类化合物抗菌活性研究进展[J].中草药,2010,41(6):1006-1014.
[19] 陈宁,张成志,赵丹,等.生物碱类化合物的抗肿瘤研究概况[J].食品与药品,2018,20(4):317-321.
[20] 贾小叶,高晨,刘庆,等.蒙古扁桃药材总生物碱的含量测定[J].广州化工,2018,46(19):100-102.
[21] 周红兵,郝海梅,刘庆,等.蒙古扁桃药材和柄扁桃药材不同部位生物碱含量测定及比较[J].包头医学院学报,2019,35(10):51-55.
[22] 王忠雷,杨丽燕,张小华,等.中药黄酮类抗氧化活性成分研究进展[J].世界科学技术-中医药现代化,2013,15(3):551-554.
[23] 马锐,吴胜本.中药黄酮类化合物药理作用及作用机制研究进展[J].中国药物警戒,2013,10(5):286-290.
[24] 薛燕芳,杨丽霞,范强,等.中药黄酮类化合物抗糖尿病作用机制研究述评[J].时珍国医国药,2017,28(8):1967- 1970.
[25] 杨美青,周红兵,白迎春,等.不同产地蒙古扁桃叶片总黄酮含量的测定[J].广州化工,2018,46(7):77-79.
[26] 白迎春,石松利,程向晖,等.长柄扁桃种仁中总黄酮的提取及含量测定[J].内蒙古中医药,2017,36(3):139、180.
[27] 李怡华,陈媛梅.重瓣榆叶梅花中黄酮的提取、动态含量及抗氧化活性测定[J].中国农业大学学报,2019,24(7):64-70.
[28] 买买提·吐尔逊,阿不力米提·那士,司马义·巴拉提.不同品种巴旦杏仁中微量元素及总黄酮含量的比较研究[J].广东微量元素科学,2009,16(7):25-29.
[29] 谢勇,范志平,施伽,等.苦杏仁苷的分析及生物功能研究进展[J].北方园艺,2017,41(6):190-195.
[30] 高雅.长柄扁桃叶乙酸乙酯萃取物的提取、分离及结构鉴定[D].西安:西北大学,2017.
[31] 白万富,石松利,郑倩男,等.不同产地蒙古扁桃叶中槲皮素含量的比较研究[J].西部中医药,2016,29(3):30-32.
[32] 买买提·吐尔逊,陈娟,古丽巴哈尔·达吾提,等.高效液相色谱-二极管阵列检测法同时测定不同品种巴旦杏中槲皮素、山奈酚的含量[J].食品科学,2014,35(2):182-185.
[33] 吾热娅提古丽·克维尔,艾百拉·热合曼,依米提·热合曼.苦杏仁苷研究进展[J].绿色科技,2015(10):286-288.
[34] 赵鑫,吕文良,李娟梅,等.苦杏仁苷抗纤维化作用机制研究进展[J/OL].中华中医药学刊,2020:1-4[2020-06-21]. http://kns.cnki.net/kcms/detail/21.1546.R.20200616.1020. 054.html.
[35] 柳松,王晓倩,廖广辉,等.苦杏仁苷抗肿瘤作用及机制研究进展[J].上海中医药杂志,2017,51(7):99-101.
[36] 李露,戴婷,李小龙,等.苦杏仁苷药理作用的研究进展[J].吉林医药学院学报,2016,37(1):63-66.
[37] 白万富,石松利,周红兵,等.不同产地蒙古扁桃仁中苦杏仁苷的含量比较[J].中国卫生检验杂志,2015,25(3):315-317.
[38] 候国峰,李聪,陈邦,等.不同产地长柄扁桃种仁成分分析[J].西北植物学报,2014,34(9):1843-1848.
[39] 韩海霞,杨晓君,阿依古丽·艾合买提,等. HPLC法测定新疆巴旦杏中苦杏仁苷的含量[J].新疆农业科学,2008,45(4):717-721.
[40] 郭新华,章世元,佟建明,等.中药多糖的免疫调节作用及機制的研究进展[J].饲料研究,2007,30(11):6-8.
[41] 李玉芳,王杰.中药多糖抗肿瘤机制研究进展[J].实用癌症杂志,2007,18(5):546-547、550.
[42] 王永胜,周思彤,杨丽霞.中药多糖类化合物防治糖尿病肾病药理研究进展[J].中国中医药信息杂志,2017,24(5):129-132.
[43] 石松利,白迎春,周红兵,等.蒙古扁桃药材中多糖的提取及含量测定[J].时珍国医国药,2013,24(2):257-258.
[44] 李姣姣,陈媛梅.重瓣榆叶梅花中多糖提取工艺及动态含量研究[J].中国农业大学学报,2018,23(1):71-79.
[45] 周红兵,钮树芳,石松利,等.蒙古扁桃药材不同部位蛋白质含量测定[J].包头医学院学报,2015,31(4):3-4.
[46] 李皓瑜,雷二强.长柄扁桃种仁蛋白质提取工艺研究[J].广州化工,2017,45(17):47-49.
[47] 郭元平,周亚翠,时云峰.东北榆叶梅果仁蛋白质的提取工艺研究[J].安徽农业科学,2012,40(11):6496-6497、6518.
[48] 张小秋,斯琴巴特尔,乌日古玛拉.蒙古扁桃油油脂化学特征常数的测定[J].集宁师范学院学报,2016,38(2):13-15.
[49] 秦芳玲.五种野生扁桃亚属植物种子营养组成和生境胁迫响应蛋白组学研究[D].西安:西北大学,2019.
[50] 张小秋.蒙古扁桃种仁油脂特性及其品质的研究[D].呼和浩特:内蒙古师范大学,2017.
[51] 王娅丽,李永华,王钰,等. 3种扁桃属植物营养成分分析[J].广东农业科学,2012,39(7):127-129.
[52] 朱强,李瑞,王钰,等.蒙古扁桃油脂肪酸含量的测定分析[J].北方园艺,2013,37(17):32-34.
[53] 李聪,李国平,陈俏,等.长柄扁桃油脂肪酸成分分析[J].中国油脂,2010,35(4):77-79.
[54] 朱强,李永华,李瑞,等.四川扁桃种仁的含油率及其脂肪酸组成分析[J].西部林业科学,2013,42(4):100-103.
[55] 解成喜,王强,谢效新.巴旦杏中脂肪酸的测定[J].新疆大学学报(自然科学版),2003,20(1):99-100.
[56] 苏琨,石松利,郑东华,等. HPLC测定蒙古扁桃种仁中α- 维生素E的含量[J].中国实验方剂学杂志,2013,19(12):70-72.
[57] 雷根虎,刘丽婷,韩超,等.沙地濒危植物长柄扁桃仁中维生素E含量分析[J].西北大学学报(自然科学版),2009,39(5):777-779.
[58] 刘金荣,但建明,江发寿,等.巴旦杏仁的营养成分与理化常数测定[J].营养学报,2002,24(2):202-203.
[59] 郑东华,石松利,苏琨.蒙古扁桃药材中有机酸含量的测定[J].时珍国医国药,2013,24(3):515-516.
[60] 李聪.沙生植物长柄扁桃新资源食用油研究[D].西安:西北大学,2013.
[61] 谢淑玲.调节血脂代谢的中药及其应用[J].辽宁农业职业技术学院学报,2020,22(3):4-6.
[62] 赵云山,吴培赛,张慧文,等.蒙古扁桃药材正丁醇提取物降血脂作用的量效关系及其化学成分的研究[J].食品工业科技,2017,38(3):348-352.
[63] 郑倩男,苏琨,石松利,等.蒙古扁桃药材石油醚提取物的成分分析及其对降血脂作用的量效关系和抗氧化方面的研究[J].中华中医药杂志,2018,33(1):287-290.
[64] 白迎春,石松利,程向晖,等.长柄扁桃不同提取物降血脂作用有效部位的筛选[J].食品研究与开发,2019,40(11):47-52.
[65] 宋根伟,黄博,何敬胜,等.巴旦杏挥发油化学成分和提取物抗氧化作用研究[J].塔里木大学学报,2009,21(3):10-14.
[66] 吴培赛,刘品月,石松利,等.蒙古扁桃对Ⅱ型糖尿病大鼠的影响[J].中药新药与临床药理,2020,31(4):415-418.
[67] 陆伦根.重视肝纤维化的诊断和评估[J].实用肝脏病杂志,2020,23(3):305-307.
[68] 段伟娜,吴敏超,张海峰.蒙药治疗肝纤维化的研究进展[J].内蒙古医科大学学报,2020,42(2):222-224.
[69] 吴桐,常虹,石松利,等.蒙古扁桃石油醚提取物对肝纤维化大鼠肝脏的作用观察[J].北方药学,2016,13(8):113-114.
[70] 何伟明,刘不悔,高坤,等.中医药防治肾纤维化的研究现状及实践[J].南京中医药大学学报,2018,34(2):112- 117.
[71] 贾小叶,高晨,刘庆,等.蒙古扁桃药材抗大鼠肾纤维化有效提取物部位的筛选[J].食品工业科技,2020,41(9):297-302、308.
[72] CHANDA D,OTOUPALOVA E,SMITH SR,et al. Deve- lopmental pathways in the pathogenesis of lung fibrosis[J]. Mol Aspects Med,2019. DOI:org/10.1016/j.mam.2018. 08.004.
[73] 刘冠汝,李亚,田燕歌.肺纤维化的中医研究进展[J].中国中医药现代远程教育,2019,17(6):116-119.
[74] 权博文,吴桐,刘庆,等.蒙古扁桃种仁不同极性部位对博来霉素致大鼠肺纤维化的保护作用[J/OL].食品工业科技,2020. DOI:10.13386/j.issn1002-0306.2020050143.
[75] 刘灿辉,谢玉琼.四川扁挑的药理研究[J].四川生理科学杂志,1992(Z1):12-13.
[76] 周悅芳,范培红.中药免疫调节作用研究进展[J].时珍国医国药,2017,28(1):204-207.
[77] 邓淑文,肖碧玉,马龙,等.巴旦杏仁浸出液对小鼠免疫功能的影响[J].营养学报,1998,20(2):119-120.
[78] 王宏喜.蒙古扁桃叶水煮膏对小菜蛾幼虫的毒杀作用[J].内蒙古林业调查设计,2017,40(5):74-75.
[79] 李慧,包屹北,李希飞,等.蒙古扁桃叶片乙醇提取物对小菜蛾生长发育的影响[J].内蒙古林业调查设计,2016,39(3):103-105.
[80] 田渭花,王高学,李聪,等.长柄扁桃叶杀灭指环虫活性部位的研究[J].广州化工,2009,37(2):70-73.
[81] 李少妮,孙康,申烨华,等.水蒸气活化法制备长柄扁桃壳基介孔活性炭的研究[J].生物质化学工程,2018,52(3):9-15.
[82] 李聪,白径遥,陈邦,等.长柄扁桃油榨油工艺研究[J].广州化工,2016,44(4):21-23.
[83] 彭子模,吕海英,刘玉祥,等.榆叶梅天然色素及其稳定性研究[J].生物技术,2001,11(3):26-29.
[84] 曹竑,王爱国,马欲倩.巴旦杏乳固体饮料喷雾干燥工艺研究[J].饮料工业,2013,16(4):17-21.
[85] 李芳,葛亮,孔令明,等.巴旦杏红枣汁复合饮料的研制[J].食品研究与开发,2010,31(9):107-109.
(收稿日期:2020-07-27 修回日期:2020-09-03)
(编辑:罗 瑞)
