穿膜肽GGPFV修饰的柔红霉素/薯蓣皂苷脂质体的处方优化及细胞毒性研究
2020-12-14姚雪敏荆鸣蔡馥伊孔亮李学涛
姚雪敏 荆鸣 蔡馥伊 孔亮 李学涛

摘 要 目的:制備穿膜肽GGPFV修饰的柔红霉素/薯蓣皂苷脂质体,对其处方进行优化,并初步评价其对乳腺癌细胞的体外毒性。方法:采用薄膜分散法和硫酸铵水化法,将柔红霉素和薯蓣皂苷包载其中,在表面以聚乙二醇-二硬脂酰基磷脂酰乙醇胺2000(DSPE-PEG2000)-GGPFV修饰,制备GGPFV修饰的柔红霉素/薯蓣皂苷脂质体。以包封率为指标,采用Box-Behnken响应面法优化处方中水化体积、胆固醇用量和柔红霉素用量;测定按最优处方制备的3批脂质体的包封率。比较柔红霉素/薯蓣皂苷脂质体、GGPFV修饰的柔红霉素/薯蓣皂苷脂质体和空白脂质体作用后对人乳腺癌MDA-MB-435S细胞存活率的影响。结果:最优处方为水化体积5 mL、胆固醇4 mg、蛋黄卵磷脂22 mg、柔红霉素0.55 mg、薯蓣皂苷0.85 mg、DSPE- PEG2000 3.5 mg、DSPE-PEG2000-GGPFV 2 mg。所制3批脂质体中,柔红霉素的包封率为(96.21±1.54)%,薯蓣皂苷的包封率为(95.39±2.48)%。体外细胞毒性试验显示,GGPFV修饰的柔红霉素/薯蓣皂苷脂质体对MDA-MB-435S细胞的抑制作用显著强于柔红霉素/薯蓣皂苷脂质体(P<0.05),膜材无细胞毒性。结论:成功制得GGPFV修饰的柔红霉素/薯蓣皂苷脂质体,其对人乳腺癌MDA-MB-435S细胞的体外抑制作用明显增强。
关键词 脂质体;GGPFV;柔红霉素;薯蓣皂苷;处方优化;Box-Behnken响应面法;细胞毒性
ABSTRACT OBJECTIVE: To prepare GGPFV-modified Daunorubicin/dioscin liposomes, and to optimize their formulation and to preliminarily evaluate their cytotoxicity to breast cancer cells in vitro. METHODS: Daunorubicin and diosgenin were wrapped by thin film dispersion method and ammonium sulfate hydration method; the surface was modified with DSPE-PEG2000-GGPFV to prepare GGPFV-modified Daunorubicin/dioscin liposomes. Taking encapsulation rate as index, Box-Behnken response surface methodology was used to optimize the film hydration volume, cholesterol amount and daunorubicin amount in the formulation. The entrapment efficiency of 3 batches of liposomes prepared according to the optimal formulation was determined. The effects of Daunorubicin/dioscin liposomes, GGPFV-modified Daunorubicin/dioscin liposomes and blank liposomes on the survival rate of human breast cancer MDA-MB-435S cells were compared. RESULTS: The optimal formulation was as film hydration volume of 5 mL, cholesterol of 4 mg, yolk lecithin of 22 mg, daunorubicin of 0.55 mg, dioscin of 0.85 mg, DSPE-PEG2000 of 3.5 mg, DSPE-PEG2000-GGPFV of 2 mg. The encapsulation rate of daunorubicin was (96.21±1.54)% and that of dioscin was (95.39±2.48)% in the 3 batches of liposomes prepared. The in vitro cytotoxicity tests showed that the inhibition effect of GGPFV-modified Daunorubicin/dioscin liposome on MDA-MB-435S cells was significantly stronger than that of Daunorubicin/dioscin liposome (P<0.05). There was no cytotoxicity in the membrane. CONCLUSIONS: GGPFV-modified Daunorubicin/dioscin liposomes are successfully prepared, and its inhibitory effect on human breast cancer MDA-MB-435S cells in vitro was significantly enhanced.
KEYWORDS Liposome; GGPFV; Daunorubicin; Dioscin; Formulation optimization; Box-Behnken design response surface methodology; Cytotoxicity
柔红霉素是一种蒽环类抗肿瘤抗生素,易溶于水且水溶液性质稳定,被广泛用于治疗急性白血病、慢性粒细胞性白血病、恶性淋巴瘤、非小细胞肺癌、乳腺癌等[1-2]。柔红霉素的抗癌机制主要是其经肝脏代谢可生成柔红霉素醇,后者可通过嵌入癌细胞DNA碱基对来改变DNA拓扑状态,并可通过抑制DNA聚合酶活性及损伤DNA来影响基因表达,从而达到杀伤肿瘤细胞、治疗癌症的目的[3]。但是,柔红霉素在临床上表现出骨髓抑制、心肌损伤、胃肠道刺激、肝肾损伤及局部组织坏死等明显的毒副作用,故有研究者将其包裹在脂质体内核中,可明显降低其在机体其余部位的分布,从而起到降低药物毒性的作用[4]。薯蓣皂苷是一种天然化合物,广泛存在于薯蓣科、百合科、石竹科等植物中,具有很高的药用价值,常作为抗肿瘤转移佐剂应用于癌症治疗研究中[5]。研究表明,薯蕷皂苷可通过诱导阻滞细胞周期S期、通过Caspase途径诱导癌细胞凋亡、抑制细胞分裂增殖等方式干预癌细胞的生命过程[6-8];同时,其可破坏癌细胞形成的血管生成拟态,抵抗癌细胞侵袭转移,从而起到抗癌效果[9]。但是,薯蓣皂苷的水溶性差,导致其生物利用度较低,而将其包载在脂质体的磷脂双分子层中可有效解决这一问题[9]。Gly-Gly-Pro-Phe-Val-Tyr-Leu- Ile (GGPFVYLI,简称为“GGPFV”)作为一种穿膜肽,具有水溶性好、可裂解性低、转运能力高的优点;并且其穿透作用无饱和性,能有效地协助药物进入细胞,故将其修饰在脂质体表面,可增强脂质体的内化效率,从而更好地发挥药物疗效[10]。
脂质体是以磷脂双分子层为基本骨架的类细胞膜结构,具有较好的生物相容性。本研究通过薄膜分散法联合硫酸铵水化法将柔红霉素包载在脂质体的亲水性内核中,将薯蓣皂苷包载在脂质体的疏水性磷脂双分子层之间,并在脂质体表面修饰GGPFV,制备了GGPFV修饰的柔红霉素/薯蓣皂苷脂质体,以改善柔红霉素对机体的毒副作用,并提高薯蓣皂苷的溶解度;同时,采用Box-Behnken响应面法优选了GGPFV修饰的柔红霉素/薯蓣皂苷脂质体的最佳处方,并通过磺酰罗丹明B(SRB)法考察了所制脂质体制剂对人乳腺癌MDA- MB-435S细胞的毒性作用,旨在初步考察各脂质体对乳腺癌细胞的抑制作用,同时评价GGPFV在脂质体表面修饰的优势。
1 材料
1.1 仪器
FA1004型电子分析天平(上海越平科学仪器有限公司);DZKW-S-4型电热恒温水浴锅(北京市永光明医疗仪器有限公司);SG3300H型超声波清洗器(上海冠特超声仪器有限公司);RE52CS型旋转蒸发器(上海亚荣生化仪器厂);JY92-2D型超声波细胞破碎机(宁波新芝生物科技股份有限公司);20AT型高效液相色谱(HPLC)仪(日本Shimadzu公司);葡聚糖凝胶(Sephadex)G50柱(上海华蓝化学科技有限公司);TS-1000型摇床振荡器(江苏海门市其林贝尔仪器制造有限公司);HBS-1096A型酶标仪(南京德铁实验设备有限公司);YA1072型透析袋MD34(8 000~14 000D)(北京索莱宝科技有限公司);85-1型磁力搅拌器(巩义市予华仪器有限责任公司)。
1.2 药品与试剂
柔红霉素对照品(大连美仑生物技术有限公司,批号:28008-55-1,纯度:>98%);薯蓣皂苷对照品(成都德锐可生物科技有限公司,批号:19057-60-4,纯度:≥98%);蛋黄卵磷脂(EPC,日本NOF公司,纯度:>98%);聚乙二醇-二硬脂酰基磷脂酰乙醇胺2000(DSPE-PEG2000,日本NOF公司);胆固醇(批号:F0119A)、SRB(批号:A0702A)均购自大连美仑生物技术有限公司;pH 7.4磷酸缓冲盐溶液(PBS,北京索莱宝科技有限公司,批号:1022Q021);DSPE-PEG2000-GGPFV由辽宁中医药大学药剂实验室靶向研究室合成;DMEM培养基、胰蛋白酶、青链霉素双抗、胎牛血清均购自美国Gibco公司;水为娃哈哈牌纯净水,其余试剂均为分析纯或色谱纯。
1.3 细胞
人乳腺癌MDA-MB-435S细胞购于中国医学科学院基础医学研究所,在含10%胎牛血清和1%青链霉素双抗的DMEM培养基中,于5%CO2、37 ℃条件下培养,备用。
2 方法与结果
2.1 脂质体的制备
通过薄膜分散法和硫酸铵水化法制备GGPFV修饰的柔红霉素/薯蓣皂苷脂质体。精密称取胆固醇、EPC、DSPE-PEG2000、DSPE-PEG2000-GGPFV、薯蓣皂苷各适量,以甲醇溶解后置于圆底烧瓶中,超声(功率:200 W,频率:40 kHz,下同)混匀,于40 ℃水浴下减压旋蒸,待圆底烧瓶中形成一层薄膜后向其中加入250 mmol/L的硫酸铵水溶液5 mL,待薄膜溶解完全后将混悬液转移至10 mL EP管中。将盛有混悬液的EP管置于冰水浴中超声10 min(超声间隔5 s,单次超声时长10 s),以防止因过热导致脂质体破裂。待超声结束后,将脂质体混悬液连续2次在0.22 μm聚碳酸酯膜上挤出,以使微粒大小均一化。将挤出后的脂质体装入透析袋,于500 mL PBS中在磁力搅拌下避光透析24 h,每隔8 h更换1次透析液。精密称取柔红霉素对照品适量置圆底烧瓶中,以甲醇溶解,于40 ℃水浴下旋转蒸发去除溶剂后加入透析后的脂质体混悬液,40 ℃水浴下振摇20 min以包载柔红霉素,即得GGPFV修饰的柔红霉素/薯蓣皂苷脂质体。
按上述制备方法,除不加入柔红霉素和薯蓣皂苷外,其余步骤相同,制备空白脂质体;除不加入DSPE- PEG2000-GGPFV外,其余步骤相同,制备柔红霉素/薯蓣皂苷脂质体。
2.2 柔红霉素和薯蓣皂苷的含量测定
采用HPLC法[11-12]测定样品含量。
2.2.1 柔红霉素含量测定的色谱条件 色谱柱:Agilent C18(250 mm×4.6 mm,5 ?m);流动相:乙腈-0.02 mol/L磷酸二氢钠溶液(含0.45% 三乙胺,以磷酸调pH至4)(32 ∶ 68,V/V);柱温:30 ℃;检测波长:233 nm;流速:1 mL/min;进样量:20 μL。
2.2.2 薯蓣皂苷测定的色谱条件 色谱柱:Agilent C18(250 mm×4.6 mm,5 ?m);流动相:乙腈-水(70 ∶ 30,V/V);柱温:30 ℃;检测波长:203 nm;流速:1 mL/min;进样量:20 μL。
2.2.3 溶液的制备 (1)空白溶液:取1 mL空白脂质体与3 mL甲醇混合均匀,超声破乳,即得。(2)供试品溶液:取1 mL GGPFV修饰的柔红霉素/薯蓣皂苷脂质体与3 mL甲醇混合均勻,超声破乳,即得。(3)柔红霉素对照品溶液:精密称取10 mg柔红霉素对照品,以甲醇溶解制成1 mg/mL的柔红霉素对照品母液;精密吸取该母液20 μL与980 μL甲醇混合均匀,即得20 μg/mL的柔红霉素对照品溶液。(4)薯蓣皂苷对照品溶液:精密称取10 mg薯蓣皂苷对照品,以甲醇溶解制成1 mg/mL的薯蓣皂苷对照品母液;精密吸取该母液40 μL与960 μL甲醇混合均匀,即得40 μg/mL的薯蓣皂苷对照品溶液。上述所有溶液均以12 000 r/min离心3 min后取上清液,连续2次以0.45 μm微孔滤膜滤过后使用。
2.2.4 柔红霉素标准曲线的绘制 取“2.2.3”项下柔红霉素对照品母液适量,加甲醇稀释制成柔红霉素质量浓度分别为240、120、80、40、20、10 μg/mL的系列对照品溶液,按“2.2.1”项下色谱条件进样测定,记录色谱图。以对照品溶液质量浓度为横坐标(x,μg/mL)、峰面积为纵坐标(y)绘制标准曲线,得回归方程为y=59.335x-19.145(R2=0.999 0),表明柔红霉素在10~240 μg/mL质量浓度范围内与峰面积线性关系良好。
2.2.5 薯蓣皂苷标准曲线的绘制 取“2.2.3”项下薯蓣皂苷对照品母液适量,加甲醇稀释制成薯蓣皂苷质量浓度分别为240、120、80、40、20、10 μg/mL的系列对照品溶液,按“2.2.2”项下色谱条件进样测定,记录色谱图。以对照品溶液质量浓度为横坐标(x,μg/mL)、峰面积为纵坐标(y)绘制标准曲线,得回归方程为y=5.810 9x+14.270(R2=0.999 6),表明薯蓣皂苷在10~240 μg/mL质量浓度范围内与峰面积线性关系良好。
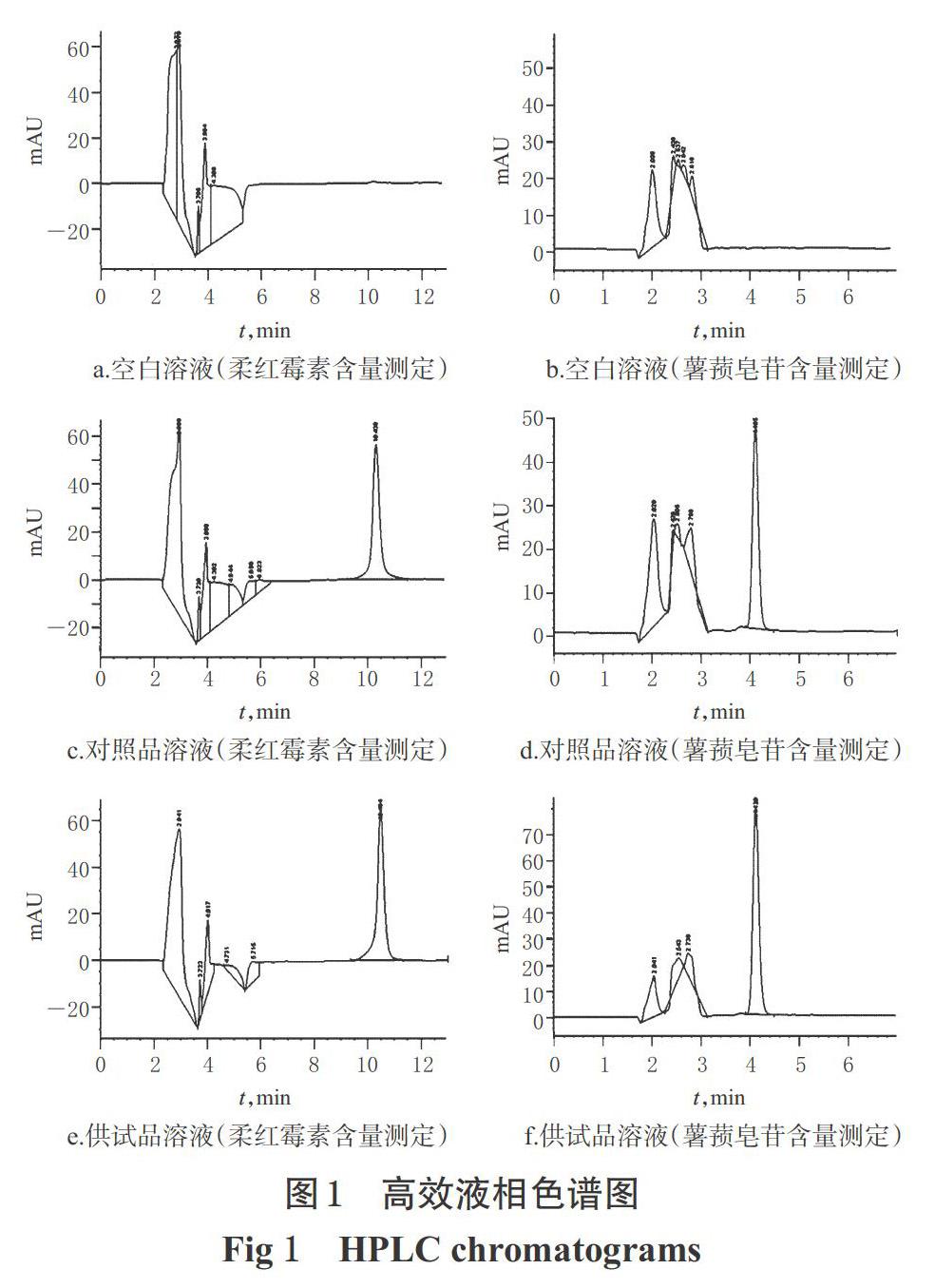
2.2.6 专属性考察 取“2.2.3”项下空白溶液、供试品溶液、柔红霉素对照品溶液、薯蓣皂苷对照品溶液各适量,按“2.2.1”“2.2.2”项下色谱条件分别进样测定,记录色谱图,详见图1。由图1可知,柔红霉素和薯蓣皂苷色谱峰在各自的色谱图中分离度良好,理论板数分别为31 608(柔红霉素)和18 635(薯蓣皂苷);空白溶液均不干扰测定。
2.2.7 精密度试验 取“2.2.3”项下柔红霉素对照品溶液和薯蓣皂苷对照品溶液,分别按“2.2.1”“2.2.2”项下色谱条件连续进样测定6次,记录色谱图。结果,柔红霉素和薯蓣皂苷峰面积的RSD分别为1.75%、1.84%(n=6),表明仪器精密度良好。
2.2.8 重复性试验 取GGPFV修饰的柔红霉素/薯蓣皂苷脂质体,共6份,分别按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”“2.2.2”项下色谱条件进样测定,记录色谱图,并按标准曲线计算柔红霉素和薯蓣皂苷的含量。结果,两者含量的RSD分别为1.55%、0.70%(n=6),表明该方法重复性良好。
2.2.9 稳定性试验 取“2.2.3”项下供试品溶液,分别于室温下放置0、2、4、8、12、24 h时,按“2.2.1”“2.2.2”项下色谱条件进样测定,记录色谱图。结果,柔红霉素和薯蓣皂苷峰面积的RSD分别为1.62%、1.40%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
2.2.10 加样回收率试验 按“2.1”项下方法制备GGPFV修饰的柔红霉素/薯蓣皂苷脂质体,平行制备6份,加入等体积甲醇,称定质量,超声破乳,静置15 min后重新称定并以甲醇补足减失质量,再以12 000 r/min离心3 min,取上清液,即得破乳液。将已知成分含量的破乳液与相应对照品溶液按1 ∶ 1(m/m)混合均匀,连续2次以0.45 μm微孔滤膜滤过,按“2.2.1”“2.2.2”项下色谱条件进样测定并计算加样回收率。结果,柔红霉素和薯蓣皂苷的平均加样回收率分别为103.64%、99.83%,RSD分别为0.98%、0.92%(n=6),表明该方法准确度良好。
2.3 GGPFV修饰的柔红霉素/薯蓣皂苷脂质体包封率的测定
取GGPFV修饰的柔红霉素/薯蓣皂苷脂质体1 mL,以PBS为洗脱剂,按1 mL/min的流速在Sephadex G50凝胶柱上层析分离,收集乳光部分,以PBS定容至1 mL,取0.5 mL,与0.5 mL甲醇混匀后,超声破乳并以0.45 μm微孔滤膜滤过,备用。另取GGPFV修饰的柔红霉素/薯蓣皂苷脂质体0.5 mL,加入0.5 mL甲醇后超声破乳,并以0.45 μm微孔滤膜滤过后备用。将上述溶液分别按“2.2.1”“2.2.2”项下色谱条件进样测定,按标准曲线计算柔红霉素和薯蓣皂苷的含量,并通过以下公式计算包封率:包封率(%)=Wa/Wb[Wa代表柔红霉素(或薯蓣皂苷)过柱后的含量,Wb代表柔红霉素(或薯蓣皂苷)过柱前的含量]。
2.4 处方优化
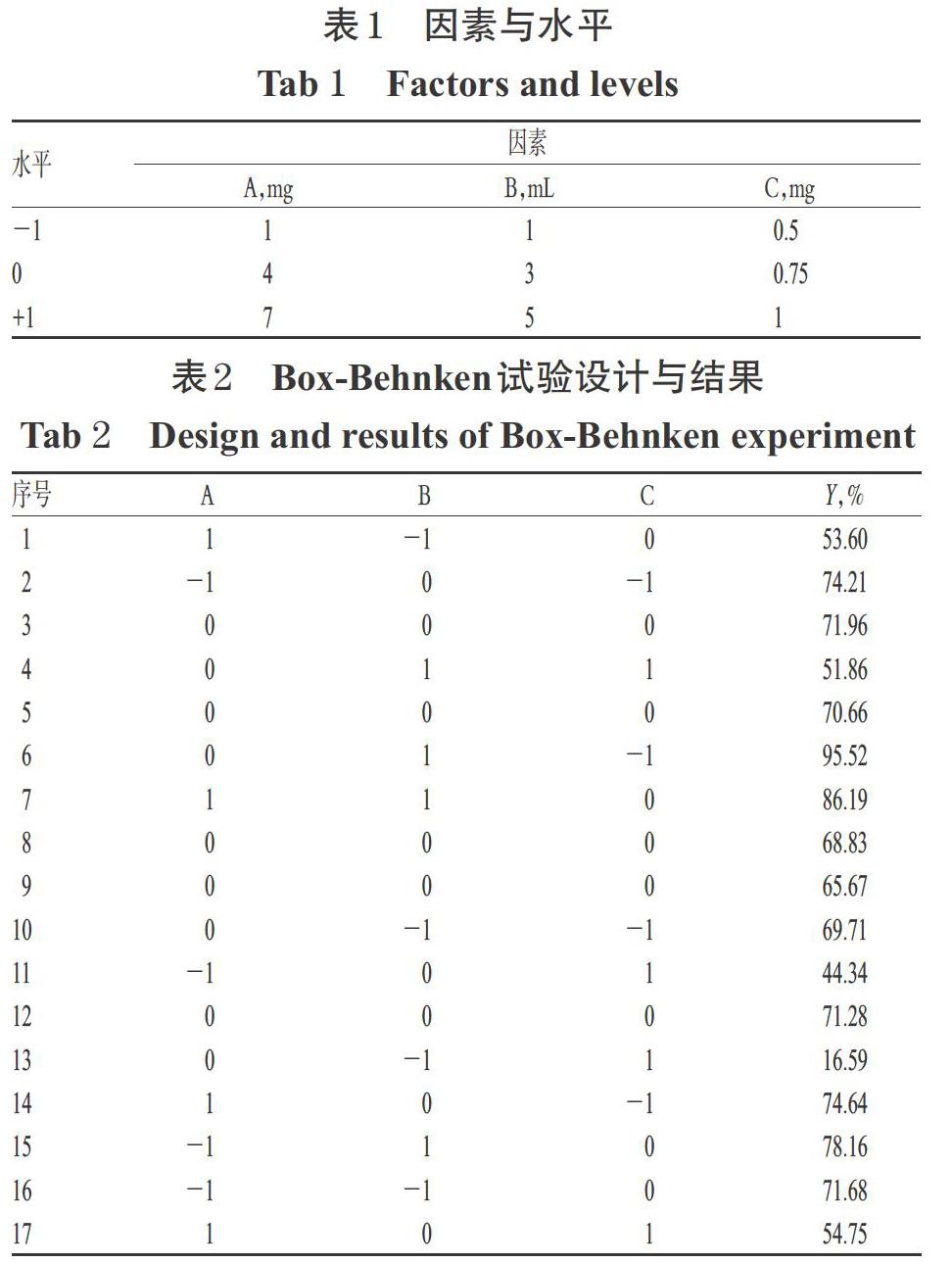
采用Box-Behnken响应面法优化处方。根据本课题组前期研究结果[13]及文献方法[14],本研究考察了胆固醇用量(A)、水化体积(B)、柔红霉素用量(C)3个因素对包封率的影响。以包封率加权值(Y)为考察指标,Y=50%×(Y1+Y2),其中Y1表示柔红霉素的包封率,Y2表示薯蓣皂苷的包封率。固定EPC用量为22 mg、柔红霉素与薯蓣皂苷的摩尔比为1 ∶ 1,确定各因素的范围(A:1~7 mg;B:1~5 mL;C:0.5~1 mg),每因素设计3个水平。因素与水平见表1;Box-Behnken试验设计与结果见表2。
根据表2结果,通过Design Expert 8.0.6软件得到了Y的拟合方程:Y=46.480 1-8.522 5A-1.011 7B+159.423 3C+1.087 9AB+3.326 7AC+4.730 0BC+0.349 6A2- 0.104 7B2-173.460 0C2(R2=0.918 2,P<0.05)。由此表明,该拟合模型可较好地反映响应值Y的变化,可用于筛选GGPFV修饰的柔红霉素/薯蓣皂苷脂质体的最佳处方。对上述拟合模型进行方差分析,结果见表3。由表3可知,B、C、AB、BC、B2、C2项对响应值Y具有显著影响(P<0.05),而A、AC、A2项对其无显著影响(P>0.05)。固定其中任一因素水平为0,即可生成其余2个因素对包封率影响的等高线图(图2)和响应面图(图3)。由图2、图3可见,在固定磷脂用量、柔红霉素与薯蓣皂苷摩尔比的情况下,B和C对响应值Y的影响较大,而A对其无显著影响。
根据本课题组前期研究结果以及上述处方优化结果,将GGPFV修饰的柔红霉素/薯蓣皂苷脂质体最优处方确定为水化体积5 mL、胆固醇4 mg、EPC 22 mg、柔红霉素0.55 mg、薯蓣皂苷0.85 mg,DSPE-PEG2000 3.5 mg、DSPE-PEG2000-GGPFV 2 mg。依照该处方平行制备3批GGPFV修饰的柔红霉素/薯蓣皂苷脂质体,并测定其包封率。结果显示,柔红霉素的包封率为(96.21±1.54)%,预测值为98.05%,相对误差为1.91%;薯蓣皂苷的包封率为(95.39±2.48)%,预测值为82.71%,相对误差为13.29%。另对按上述方法(不加DSPE- PEG2000-GGPFV)制备的柔红霉素/薯蓣皂苷脂质体的包封率进行了测定,结果显示柔红霉素的包封率为(91.38±2.53)%,薯蓣皂苷的包封率为(92.01±1.86)%,表明GGPFV修饰对两药的包封率无明显影响。
2.5 不同脂质体制剂对人乳腺癌MDA-MB-435S细胞的抑制作用
采用SRB法[15]测定空白脂质体、柔红霉素/薯蓣皂苷脂质体、GGPFV修饰的柔红霉素/薯蓣皂苷脂质体的细胞毒性。将对数生长期的人乳腺癌MDA-MB-435S细胞铺在96孔板上,铺板密度为1.7×104个/孔,于37 ℃、5% CO2条件下培养,待其长满单层后,分别向孔中加入以上3种脂质体制剂。将脂质体中柔红霉素的浓度梯度调整为0.5、1、2、4、6、8、10 μmol/L,以DMEM培养基为空白对照,每个浓度设置4个复孔,给药后继续培养48 h。吸弃培养液,将细胞在4 ℃的10%三氯乙酸溶液中固定1 h,弃去固定液并用水洗板5次;晾干,以SRB试剂染色30 min,1%冰醋酸溶液洗板5次以清除多余SRB;晾干,每孔加入200 μL Tris碱溶液,于摇床振荡器振荡30 min后,用酶标仪于540 nm波长下测定光密度(OD)值,计算细胞存活率[细胞存活率(%)=藥物组OD值/空白对照组OD值×100%]并绘制存活率曲线,详见图4。
由图4可知,空白脂质体对人乳腺癌MDA-MB- 435S细胞几乎没有细胞毒性,而柔红霉素/薯蓣皂苷脂质体和GGPFV修饰的柔红霉素/薯蓣皂苷脂质体可使MDA-MB-435S细胞存活率降低,表现出一定细胞毒性。经Graphpad Prism 7.0软件计算可得两种含药脂质体的半数抑制浓度(IC50)分别为(8.87±0.12)、(5.53±0.09) μmol/L。利用SPSS 17.0软件对本实验结果进行单因素方差分析,可得不同脂质体对MDA-MB-435S细胞的抑制作用大小排序:GGPFV修饰的柔红霉素/薯蓣皂苷脂质体>柔红霉素/薯蓣皂苷脂质体>空白脂质体,组间比较差异有统计学意义(P<0.05)。结果表明,该脂质体的膜材对细胞无毒性,且GGPFV的修饰增强了含药脂质体对人乳腺癌MDA- MB-435S细胞的抑制作用。
3 讨论
柔红霉素作为一种临床常用的抗肿瘤药,因其靶向性较低,导致对机体会产生毒副作用[16-17];薯蓣皂苷可通过多通路、多靶点、多途径诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖及侵袭转移,然而其疏水性限制了其临床应用[18]。将柔红霉素和薯蓣皂苷同时包载到脂质体中的制剂策略可显著弥补两药在应用中的不足(柔红霉素被包载于脂质体的亲水性内核,薯蓣皂苷被包载于疏水性的磷脂双分子层之间)。脂质体具有可穿过肿瘤区域微血管内皮间隙的理想粒径(20~200 nm),可通过高渗透长滞留(EPR)效应进入肿瘤组织,使药物尽可能多地分布在肿瘤区域[19];GGPFV作为一种高效新型穿膜肽,可携带药物或药物载体通过胞吞作用进入癌细胞[14]。本研究通过薄膜分散法和硫酸铵水合法制备GGPFV修饰的柔红霉素/薯蓣皂苷脂质体,将GGPFV修饰在脂质体表面,可增加癌细胞对药物的摄入量,增强抗癌效果。同时,通过人乳腺癌MDA-MB-435S细胞体外抑制试验证实,GGPFV修饰的柔红霉素/薯蓣皂苷脂质体的细胞抑制作用强于未加GGPFV修饰的柔红霉素/薯蓣皂苷脂质体。
近年来,研究者多以正交设计方法优化药物脂质体制剂处方及制备工艺,方法虽简单,但是优选结果不会超越所取水平的范围,不能给深入优化研究提供明确的指向性。而Box-Behnken响应面法具有试验设计水平数偏少、预测准确、更具经济性的优势[20-21],因而本研究采用该方法优化GGPFV修饰的柔红霉素/薯蓣皂苷脂质体处方。结果表明,GGPFV修饰的柔红霉素/薯蓣皂苷脂质体的最优处方为:水化体积5 mL、胆固醇 4 mg、EPC 22 mg、柔红霉素0.55 mg、薯蓣皂苷0.85 mg、DSPE- PEG2000 3.5 mg、DSPE-PEG2000-GGPFV 2 mg。按照最优处方平行制备了3批样品并测定其包封率,结果均符合2015年版《中国药典》(四部)要求[22]。
综上所述,本研究筛选了GGPFV修饰的柔红霉素/薯蓣皂苷脂质体的最优处方,测定了所得脂质体中柔红霉素和薯蓣皂苷的药物含量,并比较了空白脂质体、柔红霉素/薯蓣皂苷脂质体、GGPFV修饰的柔红霉素/薯蓣皂苷脂质体对人乳腺癌MDA-MB-435S细胞的毒性,确定了GGPFV修饰的柔红霉素/薯蓣皂苷脂质体可应用于进一步的抗乳腺癌研究。
参考文献
[ 1 ] 林鹏.不同蒽环类药物为基础的诱导方案治疗成人初治急性髓系白血病的疗效观察[D].石家庄:河北医科大学,2016.
[ 2 ] JU RJ,CHENG L,PENG XM,et al. Octreotide-modified liposomes containing daunorubicin and dihydroartemi- sinin for treatment of invasive breast cancer[J]. Artificial Cells,2018,46(Suppl 1):1-13.
[ 3 ] 李丁. NF-κB/LncRNA-uc002jit.1/PARP1形成环路调节柔红霉素诱导的急性髓系白血病细胞DNA损伤修复[D].福州:福建医科大学,2019.
[ 4 ] LIU XL,HAN MT,XU JW,et al. Asialoglycoprotein receptor-targeted liposomes loaded with a norcantharimide derivative for hepatocyte-selective targeting[J]. Int J Pharm,2017,520(1/2):98-110.
[ 5 ] 宋正伟,张奇能.薯蓣皂苷下调ABCC1表达对人肝癌细胞HepG2/ADM耐药的影响[J].中国药师,2020,23(1):34-39.
[ 6 ] ZHAO XW,TAOXF,XU LN,et al. Dioscin induces apoptosis in human cervical carcinoma HeLa and SiHa cells through ROS-mediated DNA damage and the mitochon- drial signaling pathway[J]. Molecules,2016. DOI:10. 3390/molecules21060730.
[ 7 ] DING QY,ZHANG WD,CHENG C,et al. Dioscin inhi- bits the growth of human osteosarcoma by inducing G2/M-phase arrest,apoptosis,and GSDME-dependent cell death in vitro and in vivo[J]. J Cell Physiol,2020,235(3):2911-2924.
[ 8 ] ZHANG YS,MA YL,THAKUR K,et al. Molecular me- chanism and inhibitory targets of dioscin in HepG2 cells[J]. Food ChemToxicol,2018. DOI:10.1016/j.fct. 2018.07.016.
[ 9 ] KONG L,CAI FY,YAO XM,et al. RPV-modified epirubicin and dioscin co-delivery liposomes suppress non- small cell lung cancer growth by limiting nutrition supply[J]. Cancer Sci,2020,111(2):621-636.
[10] R?DIS-BAPTISTA G,CAMPELO IS,MORLIGHEM JRL,et al. Cell-penetrating peptides (CPPs):from delivery of nucleic acids and antigens to transduction of engineered nucleases for application in transgenesis[J]. J Biotechnol,2017. DOI:10.1016/j.jbiotec.2017.05. 002.
[11] 黄周锋,胡筱希,黄建猷,等. Box-Behnken设计-响应面法优化小槐花中柠檬酚的超声辅助乙醇-硫酸铵双水相提取工艺[J].中国药房,2020,31(9):1085-1090.
[12] WANG YY,FU M,LIU JJ,et al. Inhibition of tumor metastasis by targeted daunorubicin and dioscincodelivery liposomes modified with PFV for the treatment of non-small-cell lung cancer[J]. Int J Nanomedicine,2019,DOI:10.2147/IJN.S194304.
[13] YAO XM,NIU FJ,KONG L,et al. GGP modified daunorubicin plus dioscin liposomes inhibit breast cancer by suppressing epithelial-mesenchymal transition[J]. Drug Dev Ind Pharm,2020,46(6):916-930.
[14] 高菲,劉莉.酒石酸长春瑞滨壳聚糖纳米粒的制备及质量评价[J].西北药学杂志,2019,34(2):217-222.
[15] LIU JJ,TANG W,FU M,et al. Development of R8 modified epirubicin-dihydroartemisinin liposomes for treatment of non-small-cell lung cancer[J]. Artif Cells Nanomed Biotechnol,2019,47(1):1947-1960.
[16] 康瑜,谢红军. OCT修饰柔红霉素与双氢青蒿素脂质体的处方优选及主药含量测定[J].西藏医药,2019,40(4):19-22.
[17] 张红. pH敏感羧甲基壳聚糖-柔红霉素纳米载药系统的构建与评价[D].武汉:武汉理工大学,2016.
[18] GUO XQ,DING X. Dioscin suppresses the viability of ovarian cancer cells by regulating the VEGFR2 and PI3K/AKT/MAPK signaling pathways[J]. Oncol Lett,2018,15(6) :9537-9542.
[19] 王海军.仿生响应性纳米载药体系用于肿瘤精准诊疗研究[D].上海:东华大学,2020.
[20] 许天阳,董坤园,宋凤媛,等. Box-Behnken响应面法优化炒赤芍炮制工艺[J].中国药房,2019,30(20):2845-2850.
[21] 刘聪,梁广裕,周韵秋,等.白藜芦醇聚合物胶束制备工艺的Box-Behnken设计-响应面法优化[J].时珍国医国药,2020,31(4):856-859.
[22] 国家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:371-374.
(收稿日期:2020-02-17 修回日期:2020-09-21)
(编辑:胡晓霖)
