参附注射液对LPS诱导的RAW264.7细胞HMGB1核转位的干预作用
2020-12-14艾飞刘霞黎晖褚春薇陈向云郭俊峰杨毅梅丽艳苗纪飞温泉叶森
艾飞 刘霞 黎晖 褚春薇 陈向云 郭俊峰 杨毅 梅丽艳 苗纪飞 温泉 叶森
摘 要 目的:探讨参附注射液(SFI)对脂多糖(LPS)诱导的巨噬细胞中高迁移率族蛋白B1(HMGB1)核转位的干预作用。方法:以经LPS诱导的小鼠单核巨嗜细胞RAW264.7为对象,以组蛋白去乙酰化酶抑制剂RGFP966为阳性对照,在CCK-8法筛选给药剂量的基础上,采用免疫荧光法观察低、中、高剂量(3、6、12 μL/mL)SFI对细胞中HMGB1核轉位的影响,采用实时荧光聚合酶链式反应法检测细胞中HMGB1 mRNA的表达情况;采用Western blotting法检测细胞中HMGB1、Toll样受体4(TLR4)的表达情况,并比较细胞胞核、胞浆中HMGB1的表达情况;采用酶联免疫吸附测定法检测细胞上清液中HMGB1、白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)水平。结果:在空白对照组中,HMGB1主要定位于细胞核;经LPS诱导后,HMGB1由细胞核向胞浆迁移。与空白对照组比较,LPS组细胞中HMGB1 mRNA及其蛋白、TLR4的蛋白表达量以及上清液中HMGB1、IL-1β、TNF-α水平均显著升高(P<0.01);细胞胞核中HMGB1的蛋白表达量显著降低,而胞浆中HMGB1的蛋白表达量显著升高(P<0.01)。经SFI作用后,各给药组细胞HMGB1的核移位及分泌均受到不同程度的抑制;与LPS组比较,各给药组细胞中HMGB1 mRNA及其蛋白的表达量,阳性对照组和SFI中、高剂量组细胞中TLR4的蛋白表达量以及各给药组细胞上清液中HMGB1、IL-1β、TNF-α水平均显著降低(P<0.01);阳性对照组和SFI中、高剂量组细胞胞核中HMGB1的蛋白表达量均显著升高,而各给药组细胞胞浆中HMGB1的蛋白表达量均显著降低(P<0.01)。结论:SFI可能通过抑制RAW264.7细胞中HMGB1的核移位及分泌出胞,避免炎症通路的激活和炎症因子的产生,从而发挥减轻LPS致炎症反应的作用。
关键词 参附注射液;RAW264.7细胞;高迁移率族蛋白B1;炎症因子;核转位
ABSTRACT OBJECTIVE: To investigate the intervention effect of Shenfu injection (SFI) on the nuclear translocation of high mobility group box 1(HMGB1) in lipopolysaccharide (LPS)-induced RAW264.7 cells. METHODS: Using LPS-induced RAW264.7 cells as objects, the histone deacetylase inhibitor RGFP966 as positive control, CCK-8 assay was used to screen drug dosage, and the effects of low, medium and high doses (3, 6, 12 μL/mL) of SFI on HMGB1 nuclear translocation in RAW264.7 cells were observed by immunofluorescence method; mRNA expression of HMGB1 in RAW264.7 cells were detected by real time fluorescent PCR. Western blotting assay was used to determine protein expression of HMGB1 and Toll-like receptor 4(TLR4); the expression of HMGB1 were compared between nucleus and cytoplasm. The levels of HMGB1, IL-1β and TNF-α in supernatant of cells were detected by ELISA. RESULTS: In blank control group, HMGB1 was mainly located in the nucleus; after LPS induction, HMGB1 migrated from nucleus to cytoplasm. Compared with blank control group, mRNA and protein expression of HMGB1, protein expression of TLR4 in RAW264.7 cells as well as the levels of HMGB1, IL-1β and TNF-α in supernatant of cells were increased significantly in LPS group (P<0.01). The protein expression of HMGB1 was decreased significantly in nucleus while was increased significantly in cytoplasm (P<0.01). After SFI treatment, the nuclear translocation and secretion of HMGB1 were inhibited in different degrees; compared with LPS group, mRNA and protein expression of HMGB1 in administration groups, protein expression of TLR4 in RAW264.7 cells of positive control group, SFI medium- and high-dose groups as well as the levels of HMGB1, IL-1β and TNF-α in supernatant of cells in administration groups were decreased significantly (P<0.01). In positive control group, SFI medium- and high-dose groups, the protein expressions of HMGB1 in nucleus were increased significantly, while protein expressions of HMGB1 in cytoplasm were decreased significantly (P<0.01). CONCLUSIONS: SFI may inhibit the nuclear translocation and secretion of HMGB1 in RAW264.7 cells, thus avoiding the activation of inflammatory pathways and the production of inflammatory factors, so as to reduce the inflammatory response induced by LPS.
KEYWORDS Shenfu injection; RAW264.7 cells; HMGB1; Inflammatory factors; Nuclear translocation
感染性休克的病程发展与免疫细胞过度激活有关,大量炎症因子的产生使得炎症反应从可控进展为不可控,最終导致患者多器官功能衰竭,甚至死亡[1]。高迁移率族蛋白B1(High mobility group box 1,HMGB1)为感染性休克晚期的致死性炎症因子,在细菌脂多糖(LPS)等致炎因子的作用下,定位于细胞核内的HMGB1将向胞浆迁移,最后分泌出胞,在胞外的HMGB1通过结合细胞膜上的晚期糖基化终产物受体(RAGE)和Toll样受体4(TLR4)来启动炎症反应,共同激活核因子κB(NF-κB)及下游炎症因子级联反应,这可能是感染性休克高死亡率的原因之一[2-4]。
中医认为,感染性休克属“厥脱”范畴,运用源自《伤寒论》四逆加人参汤的参附注射液(SFI)治疗具有较好的效果[5-6]。本课题组前期通过动物实验研究发现,SFI可抑制内毒素休克模型大鼠肺组织中HMGB1的转录、表达和血浆中HMGB1的分泌水平,但其机制还有待深入研究[7-8]。在此基础上,本研究拟考察SFI对LPS诱导的RAW264.7细胞中HMGB1蛋白核转位的影响及可能机制,以期为SFI的临床应用提供实验依据。
1 材料
1.1 仪器
Form 321型CO2培养箱(美国Thermo Fisher Scientific公司);EnSpire型多功能酶标仪(美国PerkinElmer公司);DHP-9012型恒温培养箱(上海一恒科技有限公司);PowerPac300型电泳仪、170-3930型转膜仪、CFX96型荧光定量聚合酶链反应(PCR)仪(美国Bio-Rad公司);GN98-ⅢD超声波细胞裂解仪(上海谷宁仪器有限公司);Tanon 5200型全自动化学发光图像分析仪(上海天能科技有限公司);Ama240型高压灭菌锅(英国Astell公司);LSM800型激光共聚焦扫描显微镜(德国Leica公司);SW-CJ-2D型超净工作台(苏州净化设备有限公司);CKX41型普通光学倒置显微镜(日本Olympus公司)。
1.2 药品与试剂
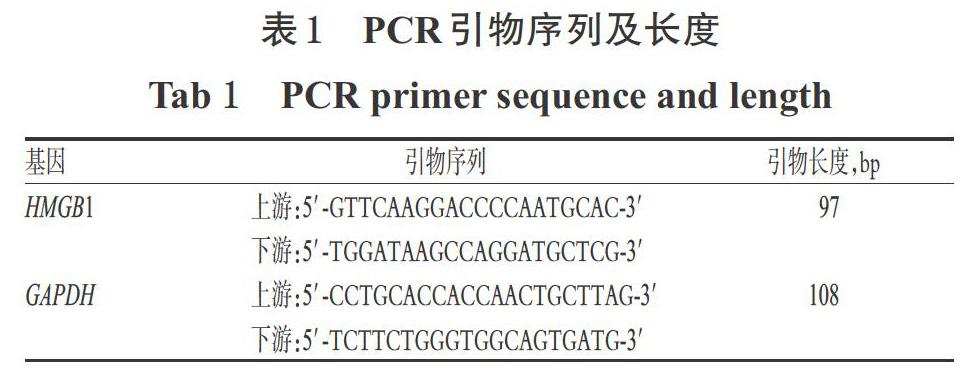
参附注射液(雅安三九药业有限公司,批号:20170324,规格:10 mL);RGFP966原料药[美国Selleck公司,批号:S7229,纯度:≥98%,用二甲基亚砜(DMSO)溶解至10 mmol/L,于4 ℃保存,备用];LPS(美国Sigma公司,批号:20170920,纯度:≥99%;来源于大肠杆菌055:B5,用水配制成质量浓度为10 mg/mL的工作溶液,于4 ℃保存,备用);DMEM高糖培养基(美国HyClone公司,批号:AD16191267);0.25%胰酶(批号:0035017)、胎牛血清(FBS,批号:1741844)均购自以色列Biological Industries公司;青霉素/链霉素双抗(北京索莱宝科技有限公司,批号:AD20170804);BCA蛋白定量试剂盒(美国Thermo Fisher Scientific公司,批号:SL260210);核/浆蛋白分离试剂盒(江苏凯基生物技术股份有限公司,批号:20170605);兔HMGB1单克隆抗体(美国Epitomics公司,批号:YH081809);兔TLR4单克隆抗体(批号:ab13556)、辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(批号:GR313248-1)、CCK-8试剂盒(批号:ab228554)均购自英国Abcam公司;兔β-肌动蛋白(β-actin)单克隆抗体(批号:AA128-1)、兔H3单克隆抗体(批号:AF0009)、Cy3标记的山羊抗兔IgG二抗(批号:A0516)、4′,6-二脒基-2-苯基吲哚(DAPI)染料(批号:C1002)、Trizol试剂(批号:101006)、苯甲磺酰氟(PMSF)蛋白酶抑制剂(批号:410051)、磷酸盐缓冲液(PBS,pH 7.4,批号:ST476)、Triton X-100试剂(批号:SY1020)、吐温20(批号:ST825)、山羊血清(批号:C0265)、RIPA裂解液(批号:P0013B)均购自碧云天生物技术研究所;逆转录试剂盒(批号:M20100)、定量聚合酶链反应(qPCR)试剂盒(批号:M30510)均购自北京全式金生物科技有限公司;ECL化学发光试剂盒(美国Millipore公司,批号:1801501);小鼠HMGB1(批号:M173318-215a)、肿瘤坏死因子α(TNF-α,批号:M170318- 102a)、白细胞介素1β(IL-1β,批号:M190325-318a)酶联免疫吸附测定(ELISA)检测试剂盒均购自欣博盛生物科技有限公司;PCR引物由生工生物工程(上海)股份有限公司设计、合成(见表1);其余试剂均为实验室常用规格,水为超纯灭菌水。
1.3 细胞
小鼠单核巨噬细胞RAW264.7细胞株购自中国科学院上海细胞库。
2 方法
2.1 细胞培养
将RAW264.7细胞置于含10%FBS、青霉素/链霉素双抗(青霉素、链霉素浓度分别为100 U/mL、100 μg/mL)的DMEM高糖培养基中(以下简称“培养基”),于37 ℃、5%CO2培养箱中培养(培养条件下同)。使用倒置显微镜观察示细胞呈圆形且折光性好,部分细胞突起。取对数生长期(融合度达70%~80%)的细胞进行后续试验。
2.2 给药剂量筛选
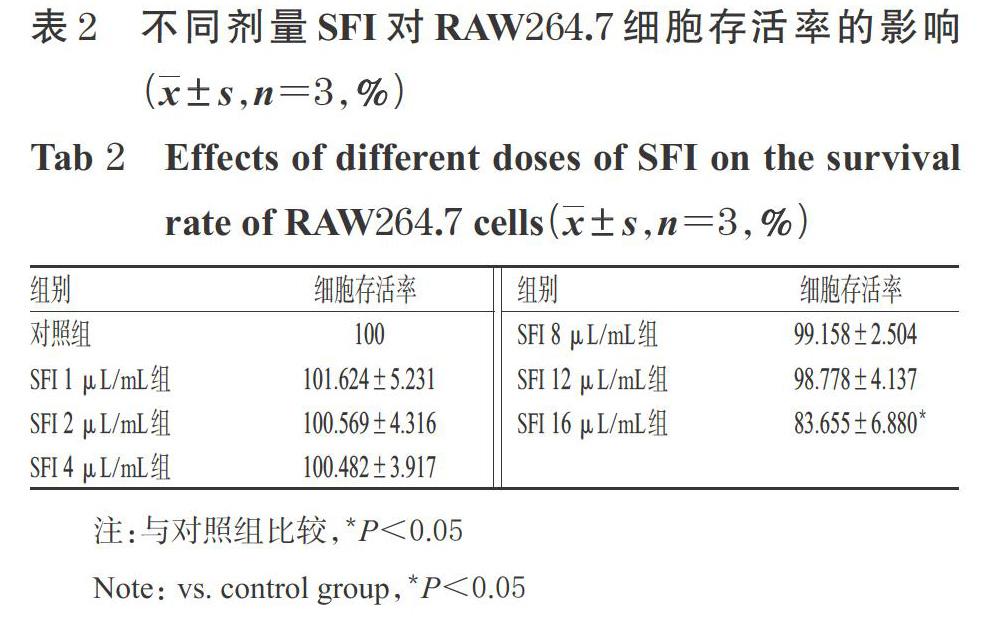
取RAW264.7细胞适量,经胰酶消化、计数后,按5×103个/孔接种于96孔板中,培养至对数生长期。将细胞随机分为对照组和药物组(SFI最终剂量分别为1、2、4、8、12、16、20 μL/mL,剂量设置参考前期研究方法[9]和预试验结果)。对照组加入培养基100 μL,各药物组加入含相应量SFI的培养基100 μL,每组设5个复孔;同时,设置5个不含细胞、只含培养基100 μL的空白孔。细胞培养24 h后,加入CCK-8溶液10 μL,继续培养2 h后,使用酶标仪于450 nm波长处测量各孔光密度(OD)值,并计算细胞存活率:细胞存活率(%)=(检测孔OD值-空白孔OD值)/(对照组孔OD值-空白孔OD值)×100%。选择不影响细胞存活率的最高剂量作为后续试验的高剂量,并以其1/2、1/4分别作为中、低剂量。
2.3 SFI对LPS诱导RAW264.7细胞炎症反应的干预作用考察
2.3.1 细胞中HMGB1定位观察 采用免疫荧光法检测。参照文献方法[10]制作细胞炎症模型,将灭菌盖玻片置于24孔板(每孔含培养基0.5 mL)中,取对数生长期细胞,按2×104个/孔滴加至各孔盖玻片上,培养24 h后,将细胞随机分为空白对照组、LPS组、阳性对照组(RGFP966,最终浓度为10 μmol/L[11])和SFI低、中、高剂量组(剂量设置参考“2.2”项下结果),空白对照组加入含双抗、不含血清的DMEM高糖培养基(以下简称“完全培养基”)0.5 mL,LPS组加入含0.2 μg/mL LPS的完全培养基0.5 mL,各给药组先加入等量LPS培养30 min后再加入含相应药物的完全培养基0.5 mL,每组设3个复孔。细胞培养24 h后,用4 ℃预冷的PBS清洗,置于4%多聚甲醛溶液中室温固定20 min;用PBS清洗3次,加入0.5% TritonX-100试剂适量,室温反应20 min;用PBS清洗5 min×3次,以10%山羊血清封闭1 h;加入HMGB1一抗(稀释度为1 ∶ 200),于4 ℃孵育过夜;用磷酸盐吐温缓冲溶液(PBST)清洗5 min×3次,加入Cy3标记的二抗(稀释度为1 ∶ 500),室温避光孵育1 h;用PBST清洗5 min×4次(此步骤及后续所有步骤均需避光操作),以DPAI染料(1 mL反应液中加入DPAI染液1 μL)染核5 min;用PBST清洗5 min×4次,用含荧光淬灭剂的甘油封片后,置于激光共聚焦扫描显微镜下观察HMGB1的染色情况及其在细胞内的定位并拍照。
2.3.2 细胞中HMGB1 mRNA表达情况检测 采用实时荧光PCR法检测。取对数生长期细胞,按1×105个/孔接种于6孔板中,按“2.3.1”项下方法分组、给药(每孔总体积为2 mL)。细胞培养24 h后,用Trizol试剂提取细胞总RNA,采用逆转录试剂盒将其逆转录为cDNA。以cDNA为模板,进行PCR扩增。PCR反应体系(共20 μL):cDNA模板1 μL、dNTP 0.2 μL、上/下游引物各0.15 μL、Taq酶0.2 μL、PCR Buffer 2 μL、ddH2O 16.3 μL。反应条件:95 ℃预变性3 min;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸15 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法[12]计算HMGB1 mRNA的表达量。
2.3.3 细胞中HMGB1、TLR4蛋白表达情况检测 采用Western blotting法检测。取对数生长期细胞,按“2.3.2”项下方法分组、给药,培养24 h后,各组取部分细胞用4 ℃预冷的PBS清洗2次,加入RIPA裂解液(含PMSF蛋白酶抑制剂)200 μL,于冰上裂解30 min,以12 000 r/min离心15 min,取上清液,即得总蛋白。按核/浆蛋白试剂盒说明书方法提取蛋白:各组取另一部分细胞加预冷的Buffer A 200 μL,涡旋剧烈振摇15 s,冰上放置15 min;加预冷的Buffer B 11 μL,涡旋剧烈振摇5 s,冰上放置1 min;于4 ℃下以12 500 r/min离心5 min后,收集上清液,即得浆蛋白。在离心沉淀物(即细胞核)中加入预冷的Buffer C 100 μL,超声(功率:150 W,频率:25 kHz)裂解2 min,冰上放置40 min,其间每隔10 min涡旋15 s;于4 ℃下以12 500 r/min离心10 min,收集上清液,即得核蛋白。采用BCA法检测总蛋白浓度后,沸水煮5 min使蛋白变性。取变性蛋白适量,经SDS-PAGE分离后,转移至PVDF膜上,以脱脂牛奶室温封闭2 h,再分别加入HMGB1、TLR4、β-actin、H3一抗(稀释度均为1 ∶ 1 000),于4 ℃孵育过夜;用三羟甲基氨基甲烷盐酸盐(TBST)溶液清洗3次,加入HRP标记的二抗(稀释度为1 ∶ 5 000),室温孵育1 h;用TBST溶液清洗3次,以ECL法显色后,于全自动化学发光图像分析仪上成像。采用Image J 1.8.0软件分析图像,以目标蛋白与内参(总蛋白、浆蛋白内参:β-actin;核蛋白内参:H3)条带灰度值的比值作为目标蛋白的表达量,分别记为细胞中HMGB1、TLR4蛋白以及细胞胞核、胞浆中HMGB1蛋白的表达量。
2.3.4 细胞上清液中炎症因子水平检测 采用ELISA法检测。取对数生长期细胞,按“2.3.2”项下方法分组、给药,培养24 h后,收集细胞上清液,以酶标仪检测各细胞上清液中HMGB1、IL-1β、TNF-α的水平。严格按照相应试剂盒说明书操作,孵育过程在37 ℃恒温培养箱中进行。
2.4 统计学方法
上述各项试验均平行操作3次。采用SPSS 23.0软件对数据进行统计分析。计量资料均以x±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
3 结果
3.1 给药剂量筛选结果
与对照组比较,SFI 16 μL/mL组细胞的存活率显著降低(P<0.05);而其余各剂量组细胞存活率与对照组比较,差异均无统计学意义(P>0.05),详见表2。基于此,本研究选择12 μL/mL作为SFI高剂量,6、3 μL/mL分别作为中、低剂量进行后续试验。
3.2 SFI对LPS诱导的RAW264.7細胞中HMGB1核转位的影响
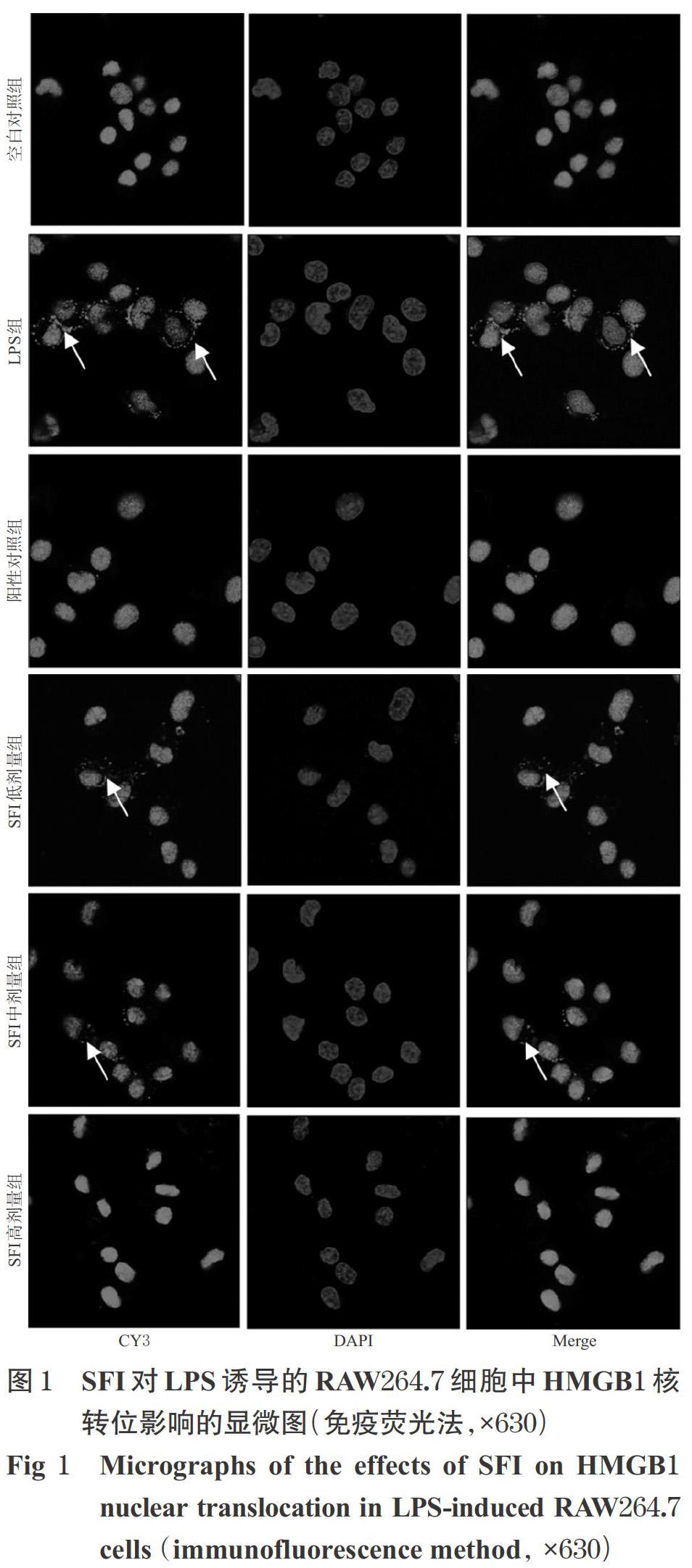
SFI对LPS诱导的RAW264.7细胞中HMGB1核转位影响的显微图见图1(图中,“Cy3”“DAPI”分别标记胞内、胞核HMGB1蛋白,“Merge”为前两者重叠)。由图1可见,空白对照组中,Cy3标记的HMGB1主要定位于胞核,与DAPI标记的胞核重叠;LPS组中,可见HMGB1同时定位于胞核和胞浆中(图中白色箭头所示为迁移至胞浆的HMGB1,下同),提示LPS可促进HMGB1从胞核向胞浆迁移;各给药组中,HMGB1主要定位于胞核中,其迁移较LPS组减少,提示SFI可抑制LPS诱导的HMGB1核转位。
3.3 SFI对LPS诱导的RAW264.7细胞中HMGB1 mRNA表达的影响
与空白对照组比较,LPS组细胞中HMGB1 mRNA的表达量显著升高(P<0.01);与LPS组比较,各给药组细胞中HMGB1 mRNA的表达量均显著降低(P<0.01),详见表3。
3.4 SFI对LPS诱导的RAW264.7细胞中HMGB1、TLR4蛋白表达的影响
与空白对照组比较,LPS组细胞中HMGB1、TLR4蛋白的表达量均显著升高(P<0.01);与LPS组比较,各给药组细胞中HMGB1蛋白的表达量以及阳性对照组和SFI中、高剂量组细胞中TLR4蛋白的表达量均显著降低(P<0.01),详见图2、表4。
3.5 SFI对LPS诱导的RAW264.7细胞胞核、胞浆中HMGB1蛋白表达的影响
与空白对照组比较,LPS组细胞胞核中HMGB1蛋白表达量显著降低,而胞浆中HMGB1蛋白表达量显著升高(P<0.01);与LPS组比较,阳性对照组和LPS中、高剂量组细胞胞核中HMGB1蛋白表达量均显著升高,各给药组细胞胞浆中HMGB1蛋白表达量均显著降低(P<0.01),详见图3、表5。
3.6 SFI对LPS诱导的RAW264.7细胞上清液中HMGB1、IL-1β、TNF-α水平的影响
与空白对照组比较,LPS组细胞上清液中HMGB1、IL-1β、TNF-α水平均显著升高(P<0.01);与LPS组比较,各给药组细胞上清液中HMGB1、IL-1β、TNF-α水平均显著降低(P<0.01),详见表6。
4 讨论
内毒素休克属于感染性休克,多因感染革兰氏阴性菌后机体多种免疫细胞释放促炎因子,进一步诱发全身性炎症反应综合征及器官功能障碍等病理反应[1]。根据祖国医学的辨证思维,内毒素休克是因邪盛正衰、正气欲脱而邪毒欲闭,属于中医外感病“厥脱”范畴[5-6]。SFI组方源自《伤寒论》四逆加人参汤,由红参、附子组成。方中,红参为君药,具益气固脱,回阳救逆之效;附子为臣药,可补火助阳,尚能温经止痛、通痹散结;两药配伍,共奏回阳救逆、益气固脱之效,故临床上将其用于治疗外感阳气脱失的外感厥脱证,即感染性休克、失血性休克等[13-16],但其具体作用机制还有待深入研究和完善。
HMGB1是由215个氨基酸构成的高度保守的核内结构蛋白,具有稳定核小体结构、修复及重组DNA、调控基因转录、调节细胞增殖和分化等多种生理功能[2-4]。1999年,Wang H[17]首次通过脓毒症小鼠模型证实,胞外HMGB1是一种重要的炎症介质,且具有较强的致死性,这一发现使得学者们开始认识到HMGB1作为晚期炎症因子的重要意义。后续研究发现,胞外HMGB1与特异性受体RAGE和TLRs家族结合,可激活NF-κB信号通路,导致促炎因子如TNF-α、IL-1β等大量产生,而这些促炎因子又可激活单核/巨噬细胞主动分泌HMGB1[2-4]。可见,HMGB1的分泌是一个正反馈过程,其可作为促炎因子在细胞因子级联放大效应中不断触发并维持下游炎症反应,加速脓毒血癥的进程[18]。由此可见,HMGB1是重症炎症相关性疾病发病机制中的关键调控因子。
有研究表明,核内HMGB1在炎症反应过程中可能扮演着与胞内HMGB1完全不同的角色,如髓源性HMGB1编码基因敲除小鼠对LPS的敏感性增加,其肺内巨噬细胞分泌的炎症因子水平显著高于野生型小鼠,肺组织损伤也更为严重[19]。类似的情况在胰腺HMGB1编码基因敲除小鼠和肝脏HMGB1编码基因敲除小鼠体内得以证实[20-21]。上述研究结果提示,一方面,HMGB1迁移到细胞外,可作为致死性炎症因子促发炎症“瀑布效应”;另一方面,核内HMGB1丢失,又可导致细胞对损伤因素的刺激反应更为剧烈,这可能是组织器官受损和功能障碍的重要原因。因此,抑制HMGB1的核移位显得尤为重要。基于上述原因,本研究以HMGB1为对象,并将可反映炎症严重程度的HMGB1/TLR4信号通路下游炎症因子(TNF-α、IL-1β)作为考察指标。
本课题组前期研究表明,SFI对内毒素休克模型大鼠肺组织有较好的保护作用,且能抑制大鼠肺组织中NF-κB、HMGB1的表达,推测SFI可能通过抑制免疫细胞HMGB1的表达、迁移和分泌来抑制NF-κB信号通路的活化和炎症介质的产生,从而发挥对器官起到保护的作用[7-8]。基于此,本研究通过建立细胞炎症模型,以具有确切炎症反应抑制作用的组蛋白去乙酰化酶抑制剂RGFP966[22]为阳性对照,对SFI治疗内毒素休克的机制进行进一步研究。结果显示,在LPS的诱导下,RAW264.7细胞内HMGB1 mRNA及蛋白的表达均显著上调,且上调的HMGB1主要分布于胞浆,而核内的HMGB1则显著减少,提示核内HMGB1大量向核外迁移,甚至大量分泌到细胞上清液中;与此同时,HMGB1的特异性受体TLR4的蛋白表达量亦显著增加,提示胞外HMGB1可能与受体结合激活炎症通路;随着HMGB1分泌增加,细胞上清液中炎症因子IL-1β、TNF-α也显著上调,提示炎症通路被激活,大量致炎因子产生。经SFI作用后,各给药组细胞中HMGB1 mRNA及其蛋白的表达量,阳性对照组和SFI中、高剂量组细胞中TLR4的蛋白表达量以及各给药组细胞上清液中HMGB1、IL-1β、TNF-α水平均较LPS组显著降低;同时,阳性对照组和LPS中、高剂量组细胞核中HMGB1蛋白表达量均显著升高,各给药组细胞胞浆中HMGB1蛋白表达量均显著降低。由此可见,SFI不仅抑制了HMGB1的转录、翻译、核转位及分泌,同时还增加了细胞核内HMGB1的蛋白表达,从源头上降低了HMGB1出胞作为致死性炎症因子及诱导后续炎症反应的可能性,这可能是SFI发挥“扶阳固脱”功效的具体体现。此外,本研究还观察到SFI抑制了HMGB1特异性受体TLR4蛋白的表达,并同时抑制了HMGB1/TLR4信号通路下游的炎症因子的分泌,提示SFI可通过抑制HMGB1/TLR4信号通路的活化从而减少炎症因子的产生。
综上所述,SFI可通过抑制巨噬细胞中HMGB1核移位,从而减少HMGB1分泌出胞,避免炎症通路的进一步激活和炎症因子的产生,这可能是其治疗危急重症的关键机制。但SFI为什么可抑制HMGB1出核、这种作用是否跟抑制HMGB1的乙酰化水平有关等问题均有待后续深入研究。
参考文献
[ 1 ] MARSHALL JC. Sepsis definitions:a work in progress[J]. Crit Care Clin,2018,34(1):1-14.
[ 2 ] INGELS C,DERESE I,WOUTERS PJ,et al. Soluble RAGE and the RAGE ligands HMGB1 and S100A12 in critical illness:impact of glycemic control with insulin and relation with clinical outcome[J]. Shock,2015,43(2):109-116.
[ 3 ] SU Z,WANG T,ZHU H,et al. HMGB1 modulates Lewis cell autophagy and promotes cell survival via RAGE- HMGB1-Erk1/2 positive feedback during nutrient depletion[J]. Immunobiology,2015,220(5):539-544.
[ 4 ] LI Y,CHEN Q,JI W,et al. HMGB1 binding to the RAGE receptor contributes to the pathogenesis of asthma[J]. Pediat Allergy Immunol Pulm,2018,31(3):174-179.
[ 5 ] 胡晶,符子艺,谢雁鸣,等.参附注射液治疗感染性休克的系统评价[J].中国中药杂志,2013,38(18):3209-3214.
[ 6 ] 陳鹏,郭瑞敏,孙燕妮.参附注射液对感染性休克患者的血流动力学影响的研究进展[J].中国中医急症,2018,27(5):911-914.
[ 7 ] 刘霞,艾飞,褚春薇,等.参附注射液抑制HMGB1核转位保护内毒素休克大鼠肺损伤[J].中药药理与临床,2019,35(1):2-6.
[ 8 ] 刘霞,艾飞,褚春薇,等.参附注射液对内毒素休克模型大鼠肺组织炎症的改善作用及抗炎机制研究[J].中国药房,2019,30(11):1492-1497.
[ 9 ] 曾振国,龚洪翰,李勇,等.参附注射液对脂多糖诱导的肺泡巨噬细胞微小RNA-146a表达的影响[J].中国危重病急救医学,2012,24(3):166-169.
[10] 明浩,邱珍,夏中元.组蛋白去乙酰化酶3在HK-2细胞高糖缺氧复氧损伤中的作用及机制[J].武汉大学学报(医学版),2020,41(2):178-182.
[11] XU Q,LIU X,MEI LY,et al. Paeonol reduces the nucleocytoplasmic transportation of HMGB1 by upregulating HDAC3 in LPS-induced RAW264.7 cells[J]. Inflammation,2018,41(4):1536-1545.
[12] HEJAZIZADEH M,MOTALLEB GR,YEGANEH MOG- HADAM A,et al. The study of CYP1A1 gene expression in patients with esophageal cancer by real time PCR[J]. J Shahrekord Univ Med Sci,2017,18(6):35-43.
[13] WU W,JIANG RL,WANG LC,et al. Effect of Shenfu injection on intestinal mucosal barrier in a rat model of sepsis[J]. Am J Emerg Med,2015,33(9):1237-1243.
[14] LIU X,LIU R,DAI Z,et al. Effect of Shenfu injection on lipopolysaccharide (LPS)-induced septic shock in rabbits[J]. J Ethnopharmacol,2019. DOI:10.1016/j.jep.2019. 01.008.
[15] 廖文生,李卫青,陈世伟,等.参附注射液对慢性阻塞性肺疾病急性加重期患者炎症细胞因子和肺功能的影响[J].中国中西医结合急救杂志,2008,15(3):149-151.
[16] 罗福全,李大珍,叶茂,等.参附注射液预先给药对内毒素血症大鼠肠黏膜上皮的影响[J].重庆医科大学学报,2013,38(7):746-750.
[17] WANG H. HMG-1 as a late mediator of endotoxin lethality in mice[J]. Science,1999,285(5425):248-251.
[18] HUEBENER P,PRADERE JP,HERNANDEZ C,et al. The HMGB1/RAGE axis triggers neutrophil-mediated injury amplification following necrosis[J]. J Clin Invest,2015,125(2):539-550.
[19] YANAI H,MATSUDA A,AN J,et al. Conditional ablation of HMGB1 in mice reveals its protective function against endotoxemia and bacterial infection[J]. Proc Natl Acad Sci U S A,2013,110(51):20699-20704.
[20] KANG R,ZHANG Q,HOU W,et al. Intracellular HMGB1 inhibits inflammatory nucleosome release and limits acute pancreatitis in mice[J]. Gastroenterology,2014,146(4):1097-1107.
[21] HUANG H,NACE GW,MCDONALD KA,et al. Hepatocyte-specific high-mobility group box 1 deletion worsens the injury in liver ischemia/reperfusion:a role for intracellular high-mobility group box 1 in cellular protection[J]. Hepatology,2014,59(5):1984-1997.
[22] LEUS NG,VAN DER WOUDEN PE,VAN DEN BOSCH T,et al. HDAC 3-selective inhibitor RGFP966 demonstrates anti-inflammatory properties in RAW 264.7 macrophages and mouse precision-cut lung slices by attenuating NF-κB p65 transcriptional activity[J]. Biochem Pharmacol,2016. DOI:10.1016/j.bcp.2016.03.010.
(收稿日期:2020-04-03 修回日期:2020-08-05)
(編辑:张元媛)
