白藜芦醇对COPD 合并肺源性心脏病SD大鼠肺功能及心脏功能结构的影响
2020-12-14李珠张彬
李珠 张彬
1河北医科大学第一医院呼吸内科,石家庄050000;2河北医科大学第一医院急诊科,石家庄050000
COPD 是一种病因不明的呼吸系统常见病多发病,多认为与肺部对香烟等有害气体的异常炎性反应有关;临床上以不完全可逆并进行性发展的气流受限为主要表现,以慢性支气管炎及肺气肿为主要病理变化[1]。长时间病变可引起肺血管床减少及肺动脉痉挛,血管重塑,最终导致肺动脉高压,右心室肥大,最终发生右心功能不全[2]。目前临床上对COPD 的治疗以戒烟、支气管扩张、吸入糖皮质激素、长期家庭氧疗为主,急性加重期可针对环境最常见病原菌给予抗生素治疗,使气道平滑肌松弛,炎症反应减少,黏液减少,从而改善患者呼吸困难症状[3],但临床疗效仍不理想。研究报道白藜芦醇可通过各种途径抑制机体炎性反应[4-8],也有学者初步探讨了白藜芦醇对COPD 大鼠炎性反应的抑制作用[9-10]。在前期研究基础上,从肺功能和心脏功能结构方面观察白藜芦醇对COPD 大鼠并发慢性肺源性心脏病的病情控制情况,现报道如下。
1 材料与方法
1.1 实验动物 健康成年雄性SD 大鼠45只,购自河北省实验动物中心,即河北医科大学实验动物中心,实验动物许可证编号1505126。SD 大鼠45只均为49 d生,体质量163.7~196.4 g;实验室设置温度为(25.1±0.7)℃,相对湿度为(52.6±3.4)%;标准饲料喂养,换水2 d/次,垫料3 d/次,维持鼠笼清洁。本研究符合 《赫尔辛基宣言》的原则。
1.2 药物与试剂 钻石牌香烟 (河北中烟草公司);白藜芦醇(陕西天一生物有限公司);布地奈德雾化混悬液 (英国阿斯利康制药有限公司);碱性磷酸酶染液 (南京建成生物工程研究所,ALKALINE PHOSPHATASE,ALP);水合氯醛、甲醛、乙醇、二甲苯等 (日本sigma公司)。大鼠吸烟装置 (JY-01型) (石家庄锦阳科技开发公司);AniRes2005肺功能系统(北京生物学实验室科技公司),Vevo2100®VisualSonics超声检测影像系统 (Canada),均属于北京朝阳医院;S-888E型超声雾化仪 (中外合资南京道芬电子有限公司产品);饲养大鼠的饮用水、食物、垫料均购买于河北医科大学实验动物中心。光学显微镜,倒置式生物显微镜(Olympus公司);-80 ℃超低温冰箱(美国Nuair公司,NU-6382E);石蜡切片机和包埋机 (德国LEICA 公司);BALP 检测ELISA 试剂盒 (美国RD 公司);Hitach 17060自动生化分析仪检测大鼠空腹血糖。
1.3 方法
1.3.1 建模及验证
1.3.1.1 建模 建模用烟箱大小为50 cm×40 cm×30 cm 的烟箱,分为上下2层,下层为10 cm 高,四壁及底层均密闭,底层为可抽出的抽拉式封底;上层为20 cm 高,四侧壁各有3个直径为3 cm 的正圆形通气孔,顶部无通气孔;将20只香烟平铺于下层烟箱;将45只SD 大鼠置于上层烟箱内被动吸烟。烟箱下层每次点燃20只香烟,被动吸烟1 h后,间隔5 h,再重复1次,每天2次,持续进行16周。被动吸烟过程中,为预防动物扎堆,间隔3 min敲打烟箱壁1次[11-12]。
1.3.1.2 验证 建模完成后,随机取1只SD 大鼠,送河北医科大学实验动物中心进行病理验证。水合氯醛0.3 ml/100 g腹腔注射麻醉,放血处死。取肺组织加入甲醛病理瓶,经10%甲醛固定,乙醇脱水,二甲苯透明,石蜡包埋,切片,光镜下病理观察显示肺组织局灶性坏死炎症,肺淤血、间质增生、慢性炎细胞浸润,即肺源性心脏病[13]。
1.3.2 实验分组 将建模成功后的45只成年健康雄性SD 大鼠随机分为白藜芦醇组、糖皮质激素组和对照组,各15 只。白藜芦醇组体质量173.8~189.4 g;糖皮质激素组体质量176.4~196.4 g;对照组体质量175.6~185.3 g。3组基线资料比较差异无统计学意义(P >0.05),具有可比性。
1.3.3 灌胃 白藜芦醇组给予白藜芦醇治疗30 mg·kg-1·d-1,灌胃,每天1 次,连续28 d。糖皮质激素组给予布地奈德4 ml(2 mg)与生理盐水2 ml混合雾化吸入,每天1 次,连续28 d。对照组给予生理盐水灌胃,28 d。
1.3.4 检测指标
1.3.4.1 肺功能 使用水合氯醛0.3 ml/100 g腹腔注射将大鼠麻醉,并将其固定于操作台上。暴露大鼠颈部及舌骨下肌群,分离气管和食管并固定。于环状软骨下第二个气管环处切口气管插管并丝线固定。同时,切开食管,灌注少量生理盐水以控制气流流入食管,丝线打结固定。将肺功能检测仪和食道压力传感器探头固定于气管内,基于肺顺应性测定软件分析静脉换能器转换来的气道和食管内的信号[14]。包括肺顺应性 (compliance of lung,CL)、最大呼气流量 (peak expiratory flow,PEF)、最大呼气中段流量 (maximum midexpiratory flow,MMF)、0.3秒用力呼气容积(forced expiratory volume FEV,FEV0.3)与用力肺活量 (forced expiratory volume,FVC)的比值,单次监测30 min,连续监测后计算各参数均值。
1.3.4.2 心脏 采用Vevo2100®VisualSonics超声检测影像系统对大鼠进行心脏超声检查。采用标准的左室长轴切面、五腔心切面进行超声测量,同时记录心电图,以R 波顶峰作为舒张末期,以T波末作为收缩期,观察心脏形态,室壁运动幅度及收缩期增厚率, 测定左室射血分数 (left ventricular ejective fraction,LVEF)、左室舒张末期内径 (left ventricular end-diastolic diameter,LVEDD)、室间隔厚度 (interventricular septum thickness,IVST)和左室后壁厚度 (posterior wall thickness,PWT)[15]。实验最后,大鼠放血处死,将大鼠心脏完整取出来,去除左右心房组织和血管组织,由室间隔边缘完整剪下右室,用滤纸吸干水分及血液,称重右室 (residual volume,RV)游离壁及左室和室间隔 (left ventricle plus atrial ventricular sept,LV+S)的质量,计算RV/ (LV+S)比值[16]。
1.3.4.3 不良反应 观察3组不良反应发生情况,如骨质疏松[17]、血糖升高[18]等。于干预前和干预后第7、14、21、28天分别取大鼠内眦静脉血,分离血清后化验空腹血糖和血清骨特异性碱性磷酸酶水平。
1.4 统计学分析 采用R 语言进行数据处理,计量资料采用±s 表示,多组间比较采用单因素方差分析,治疗前后比较采用t 检验。P <0.05为差异有统计学意义。
2 结果
2.1 肺功能 干预前,3组CL、FEV0.3/FVC 水平比较差异均无统计学意义 (F =1.026、0.008,P 值均>0.05)。治疗后,CL 值均降低,FEV0.3/FVC值均升高;CL 变化中以对照组降低最为显著,糖皮质激素组次之,白藜芦醇组降低幅度最小(F =19.048,P <0.05),FEV0.3/FVC水平变化以白藜芦醇组升高最多,糖皮质激素组次之(F =0.076,P <0.05),对照组无明显变化 (t =0.153,P >0.05)。见表1。
3组治疗前PEF、MMF 值比较差异均无统计学意义(F =2.468、1.868,P 值均>0.05)。治疗后,3组PEF水平、MMF水平均降低,以对照组降低最为明显,糖皮质激素组次之,白藜芦醇组降低幅度最小,组间差异有统计学意义 (F =17.210、34.836,P 值均<0.05)。见表2。
2.2 心脏 治疗前,3组LVEF、LVEDD 水平比较差异无统计学意义 (F =1.301、0.538,P 值均>0.05),治疗后3组LVEF 升高,LVEDD 增厚,但LVEF 升高以白藜芦醇组升高最明显,糖皮质激素组次之,对照组升高最少 (F =56.986,P >0.05);LVEDD 增厚中以对照组增厚最显著,糖皮质激素组次之,白藜芦醇组最少,差异有统计学意义(F =142.442,P <0.05)。见表3。
治疗前3 组IVST、PWT 水平比较差异无统计学意义(F =43.080、3.044,P 值均>0.05)。治疗后,3 组IVST 值、PWT 值均升高,其中以对照组升高最为明显,糖皮质激素组次之,白藜芦醇组增厚幅度最小,差异均有统计学意义 (F =287.401、18.726,P 值均<0.05)。见表4。
表1 3组干预前后CL、FEV0.3/FVC水平比较 (±s)
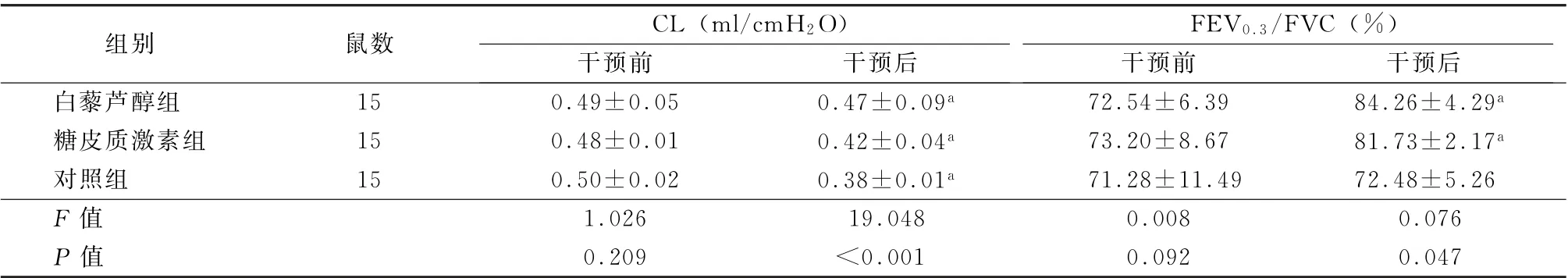
表1 3组干预前后CL、FEV0.3/FVC水平比较 (±s)
注:CL为肺顺应性;FEV0.3/FVC为0.3秒用力呼气容积/用力肺活量;1 cm H 2 O=0.098 kPa;与干预前比较,a P <0.05
组别鼠数CL (ml/cm H 2 O)FEV 0.3/FVC (%)干预前干预后干预前干预后白藜芦醇组15 0.49±0.05 0.47±0.09a 72.54±6.39 84.26±4.29a糖皮质激素组15 0.48±0.01 0.42±0.04a 73.20±8.67 81.73±2.17a对照组15 0.50±0.02 0.38±0.01a 71.28±11.49 72.48±5.26 F 值1.026 19.048 0.008 0.076 P 值0.209<0.001 0.092 0.047
表2 3组干预前后PEF、MMF水平比较 (±s)
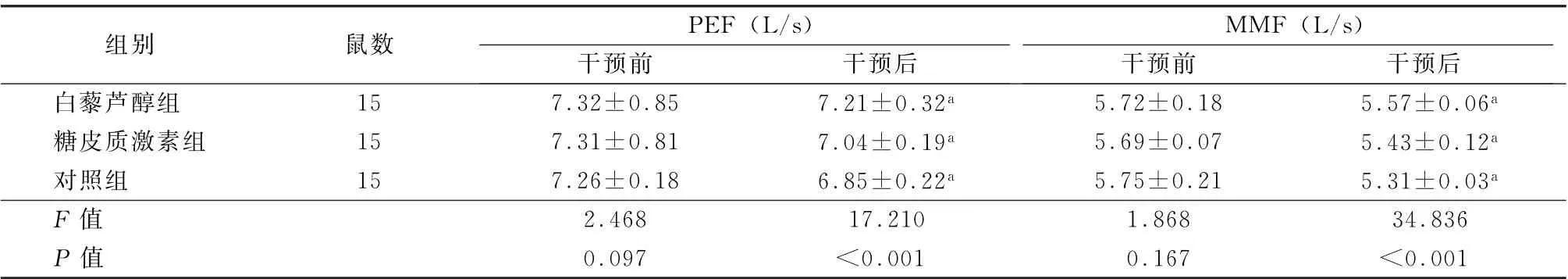
表2 3组干预前后PEF、MMF水平比较 (±s)
注:PEF为最大呼气流量;MMF为最大呼气中段流量;与干预前比较,a P <0.05
组别鼠数PEF (L/s)MMF (L/s)干预前干预后干预前干预后白藜芦醇组15 7.32±0.85 7.21±0.32a 5.72±0.18 5.57±0.06a糖皮质激素组15 7.31±0.81 7.04±0.19a 5.69±0.07 5.43±0.12a对照组15 7.26±0.18 6.85±0.22a 5.75±0.21 5.31±0.03a F 值2.468 17.210 1.868 34.836 P 值0.097<0.001 0.167<0.001
表3 3组干预前后LVEF、LVEDD 水平比较 (±s)
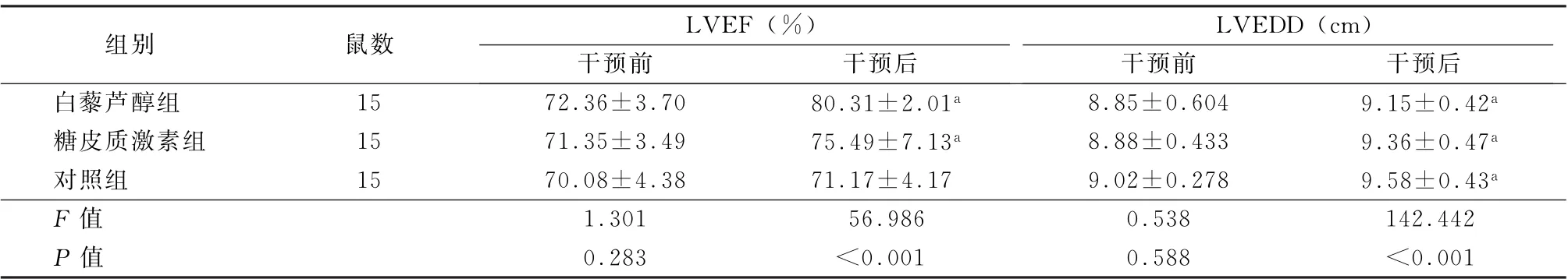
表3 3组干预前后LVEF、LVEDD 水平比较 (±s)
注:LVEF为左室射血分数;LVEDD为左室舒张末期内径;与干预前比较,a P <0.05
组别鼠数LVEF (%)LVEDD (cm)干预前干预后干预前干预后白藜芦醇组15 72.36±3.70 80.31±2.01a 8.85±0.604 9.15±0.42a糖皮质激素组15 71.35±3.49 75.49±7.13a 8.88±0.433 9.36±0.47a对照组15 70.08±4.38 71.17±4.17 9.02±0.278 9.58±0.43a F 值1.301 56.986 0.538 142.442 P 值0.283<0.001 0.588<0.001
表4 3组干预前后IVST 和PWT 水平比较 (±s)
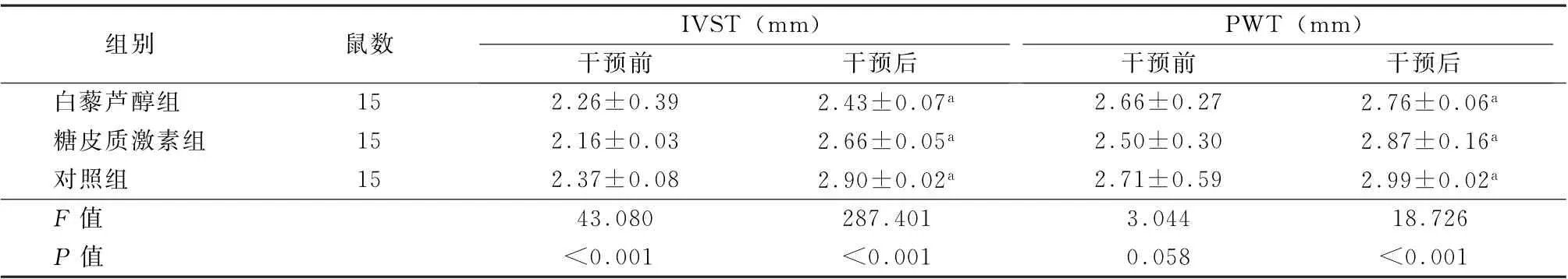
表4 3组干预前后IVST 和PWT 水平比较 (±s)
注:IVST 为室间隔厚度;PWT 为左室后壁厚度;与干预前比较,a P <0.05
组别鼠数IVST (mm)PWT (mm)干预前干预后干预前干预后白藜芦醇组15 2.26±0.39 2.43±0.07a 2.66±0.27 2.76±0.06a糖皮质激素组15 2.16±0.03 2.66±0.05a 2.50±0.30 2.87±0.16a对照组15 2.37±0.08 2.90±0.02a 2.71±0.59 2.99±0.02a F 值43.080 287.401 3.044 18.726 P 值<0.001<0.001 0.058<0.001
治疗前,3组RV 游离壁、LV+S值比较差异均无统计学意义 (F =1.827、0.674,P 值均>0.05)。治疗后,3组RV 游离壁、LV+S值均增加,且以对照组增加最为显著,糖皮质激素组次之,白藜芦醇组增加最小,差异均有统计学意义(F =3.725、8.355,P 值均<0.05)。见表5。
治疗前,3组RV/LV+S 值比较差异无统计学意义 (F =1.827,P >0.05)。治疗后3 组RV/LV+S值均升高,且以对照组升高最为明显,糖皮质激素组次之,白藜芦醇组升高最小,差异有统计学意义(F =3.725,P <0.05)。见表6。
表6 3组干预前后RV/LV+S水平变化比较 (%,±s)
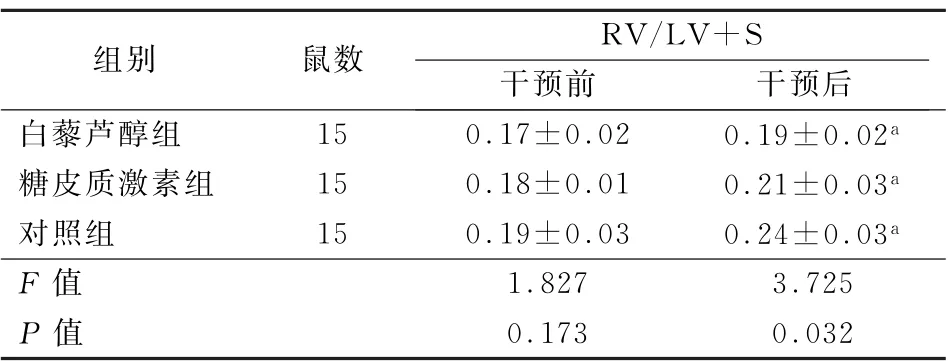
表6 3组干预前后RV/LV+S水平变化比较 (%,±s)
注:RV 为右室;LV+S为左室和室间隔;与干预前比较,a P <0.05
组别鼠数RV/LV+S干预前干预后白藜芦醇组15 0.17±0.02 0.19±0.02a糖皮质激素组15 0.18±0.01 0.21±0.03a对照组15 0.19±0.03 0.24±0.03a F 值1.827 3.725 P 值0.173 0.032
2.3 不良反应 干预前,3组大鼠空腹血糖和血清骨特异性碱性磷酸酶水平比较差异均无统计学意义 (F=0.089、0.042,P 值均>0.05)。治疗后,糖皮质激素组空腹血糖水平升高,血清骨特异性碱性磷酸酶水平降低,差异均有统计学意义 (F =119.687、1 391.253,P 值均<0.05);而治疗后对照组和白藜芦醇组空腹血糖和血清骨特异性碱性磷酸酶水平有所波动,但差异均无统计学意义(P 值均>0.05)。见表7、8。
3 讨论
近年,有研究结果显示40 岁以上成年人的COPD 患病率为8.2%[19]。随着我国老龄化进程的加速,老年人口比例的急剧增加,老年COPD 患者的基数较大,而随着病情进展出现的肺源性心脏病更加严重地影响患者生活质量和社会生产力,从而给社会带来较大的负担,COPD 并发肺源性心脏病已经不仅是个人疾病,已上升为目前较为重要的公共卫生问题,临床急需寻找能有效控制病情进展的治疗方案[20]。
白藜芦醇是存在于植物中的阳光紫外线照射下产生的多酚类化合物,植物主要有葡萄、花生、松树、藜芦、桑葚、虎杖等[21];白藜芦醇有广泛的抗炎、抗氧化、清除自由基、抗肿瘤、抗血小板、抗动脉硬化及免疫调节作用,临床药用价值较大,是临床药物研发的新的研究领地[22]。白藜芦醇可抑制机体各种炎性反应,如周敏等[7]报道,白藜芦醇含有一种羧甲基葡聚糖可以用于控制HIHela单层细胞和离体鼻黏膜上皮细胞感染;刘世昌等[8]报道白藜芦醇降低小鼠一氧化氮含量,可以与钙结合,刺激前列腺素E2合成和激活ATP 敏感性钾通道,从而改善支气管哮喘的炎性反应;白藜芦醇可逆转肺纤维化,如李利华等[9]报道白藜芦醇可能通过调节转化生长因子β1(transforming growth factor-β1,TGF-β1),从而阻断TGF-β1/ADAMTS-1信号转导通路,减少成纤维细胞增殖、分化,抑制Ⅰ型胶原蛋白合成,继而减少细胞外基质在肺间质及肺泡间过度沉积,逆转肺纤维化的发展;白藜芦醇可降低肺动脉高压,如栗青等[21]研究报道白藜芦醇可以通过升高一氧化氮合成酶、一氧化氮的生物利用度,降低诱导型一氧化氮合酶、NADPH 氧化酶NOX1等提升内皮细胞功能;减少血小板衍生生长因子α/β、核因子κB、转录因子活化蛋白1及细胞外信号调控激酶ERK 等的表达,从而减少血管重塑和增殖;还可以通过离子通道如钙通道、钾通道等的调节,从而改善血管的舒缩功能;抑制炎症细胞因子反应等综合因素达到降低肺动脉高压的目的。白藜芦醇可提高呼吸肌力量,增加呼吸效率,如李玉屏等[6]研究报道COPD 患者经常发生肌肉萎缩的情况,导致呼吸肌的力量逐渐减弱,体质量下降,抵抗力低下。有报道显示线粒体功能障碍与肌肉萎缩相关,线粒体的靶向营养素可以有效的防止各种肌肉萎缩。白藜芦醇作为一种线粒体的营养素可以有效的逆转地塞米松诱导的线粒体功能障碍及肌肉萎缩,增加肌肉活动强度,提升呼吸效率。基于以上关于白藜芦醇在支气管哮喘、COPD、肺纤维化方面抗氧化、抗炎的研究报道,本课题组讨论分析认为白藜芦醇可能是控制COPD病情进展的新型有效药物,特开展本研究观察白藜芦醇对COPD 并发肺源性心脏病对肺功能和心脏功能结构的控制作用。
表5 3组干预前后RV 游离壁和LV+S质量比较 (±s)
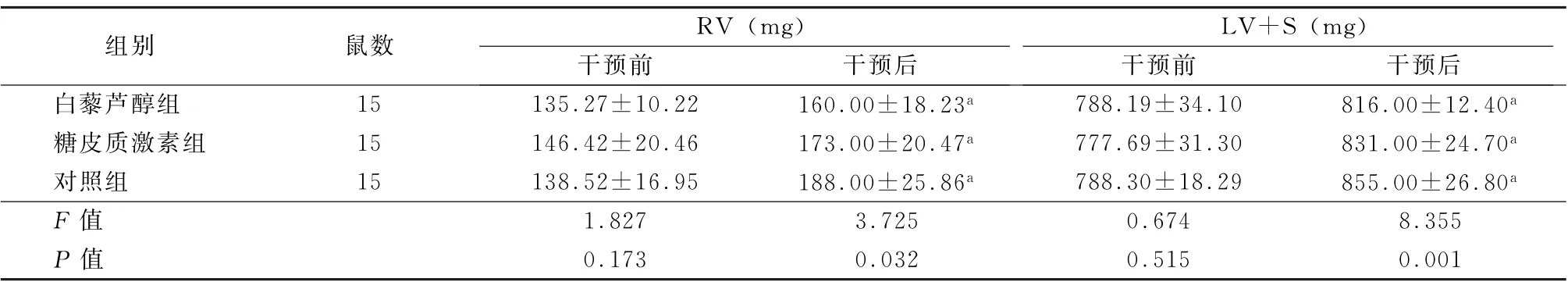
表5 3组干预前后RV 游离壁和LV+S质量比较 (±s)
注:RV 为右室;LV+S为左室和室间隔;与干预前比较,a P <0.05
组别鼠数RV (mg)LV+S (mg)干预前干预后干预前干预后白藜芦醇组15 135.27±10.22 160.00±18.23a 788.19±34.10 816.00±12.40a糖皮质激素组15 146.42±20.46 173.00±20.47a 777.69±31.30 831.00±24.70a对照组15 138.52±16.95 188.00±25.86a 788.30±18.29 855.00±26.80a F 值1.827 3.725 0.674 8.355 P 值0.173 0.032 0.515 0.001
表7 3组干预前后空腹血糖值变化比较 (mmol/L,±s)
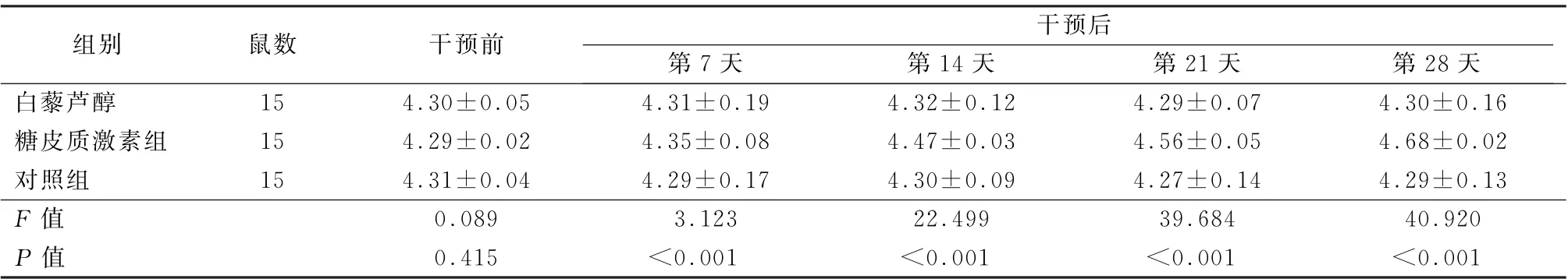
表7 3组干预前后空腹血糖值变化比较 (mmol/L,±s)
组别鼠数干预前干预后第7天第14天第21天第28天白藜芦醇15 4.30±0.05 4.31±0.19 4.32±0.12 4.29±0.07 4.30±0.16糖皮质激素组15 4.29±0.02 4.35±0.08 4.47±0.03 4.56±0.05 4.68±0.02对照组15 4.31±0.04 4.29±0.17 4.30±0.09 4.27±0.14 4.29±0.13 F 值0.089 3.123 22.499 39.684 40.920 P 值0.415<0.001<0.001<0.001<0.001
表8 3组干预前后血清骨特异性碱性磷酸酶水平 (U/L,±s)
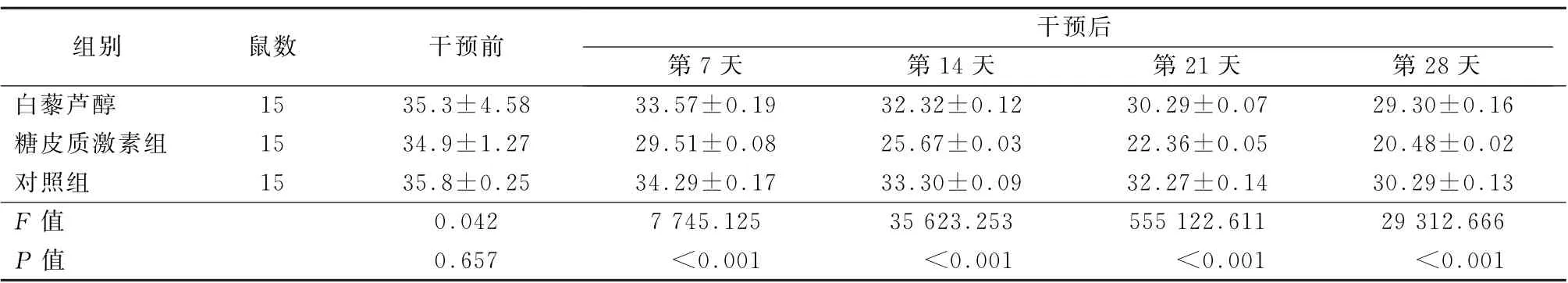
表8 3组干预前后血清骨特异性碱性磷酸酶水平 (U/L,±s)
组别鼠数干预前干预后第7天第14天第21天第28天白藜芦醇15 35.3±4.58 33.57±0.19 32.32±0.12 30.29±0.07 29.30±0.16糖皮质激素组15 34.9±1.27 29.51±0.08 25.67±0.03 22.36±0.05 20.48±0.02对照组15 35.8±0.25 34.29±0.17 33.30±0.09 32.27±0.14 30.29±0.13 F 值0.042 7 745.125 35 623.253 555 122.611 29 312.666 P 值0.657<0.001<0.001<0.001<0.001
本研究以成年雄性SD 大鼠为研究对象,首先构建SD 大鼠COPD 并发肺源性心脏病的病理模型。在模型构建方面,已经研究证实吸烟为COPD的主要危险因素,烟草中含有焦油、尼古丁、氢氰酸等化学物质,可损伤气道上皮和纤毛运动,促使支气管黏液腺和杯状细胞增生肥大,黏液分泌增多,使得气道净化能力下降,氧自由基生成增多,诱导中性粒细胞释放蛋白酶,破坏弹力纤维,诱发肺气肿形成[22]。吸烟量越大、吸烟时间越长,开始吸烟时间越早患COPD 的危险越大。
因此,本研究以香烟为暴露因素,制作SD 大鼠COPD 并发肺源性心脏病的病理模型。建模成功后,随机将大鼠分为3组,分别为白藜芦醇组、糖皮质激素组及对照组。对比3 组干预措施对COPD 并发肺源性心脏病的病情控制效果。肺功能评价选择CL、PEF、MMF、FEV0.3/FVC 为评价指标;心脏功能和结构方面以超声测定LVEF、LVEDD、IVST 和PWT、RV 游离壁及LV+S的质量及RV/ (LV+S)比值为评价指标。肺功能研究结果显示,干预前,3组肺功能指标差异无统计学意义,治疗后,3 组CL 值、PEF 水平、MMF 水平均降低,FEV0.3/FVC 值均升高,CL值、PEF、MMF 值变化中以对照组降低最为显著,糖皮质激素组次之,白藜芦醇组降低幅度最小(P <0.05),FEV0.3/FVC 水平变化以白藜芦醇组升高最多,糖皮质激素组次之 (P <0.05),对照组无明显变化(P >0.05);证实了相较于对照组和糖皮质激素组,白藜芦醇可较好地改善COPD并发肺源性心脏病的肺功能。心脏功能和结构研究结果显示,治疗前,3组心脏功能结构指标比较差异无统计学意义,治疗后3 组LVEF 升高,LVEDD、IVST、PWT 增厚,RV、LV+S 质量增加、RV/LV+S值增高,但LVEF 升高以白藜芦醇组升高最明显,糖皮质激素组次之 (P <0.05),对照组升高最少 (P >0.05)。LVEDD、IVST、PWT 增厚中以及RV、LV+S质量增加、RV/LV+S值增高中均以对照组变化最显著,糖皮质激素组次之,白藜芦醇组最少,差异均有统计学意义(P <0.05)。即相对于对照组和糖皮质激素组,白藜芦醇可更多的延缓COPD 并发肺源性心脏病的心功能和心脏结构破坏恶化进展速度。在不良反应方面,治疗后,糖皮质激素组空腹血糖水平升高,血清骨特异性碱性磷酸酶水平降低(P <0.05),而对照组和白藜芦醇组上述指标变化程度远小于糖皮质激素组,证实白藜芦醇组可避免糖皮质激素组用药的严重不良反应,且无其他不良反应发生,具有较好的安全性。
综上所述,白藜芦醇可明显有效地改善COPD并发肺源性心脏病SD 大鼠的肺功能、延缓心脏功能及结构恶化速度,改善SD 大鼠预后,且可避免糖皮质激素引起的高血糖、骨质疏松等严重不良反应,兼具有效性和安全性;白藜芦醇的上述作用机制尚待进一步研究证实,以期为COPD 并发肺源性心脏病的治疗提供更为有效的临床依据,实现改善患者生活质量和预后。
利益冲突所有作者均声明不存在利益冲突
