大黄酸纳米混悬剂的制备及其体内药动学研究
2020-12-13张亚林喻海洋
张亚林,喻海洋,黄 涛*
(1.黄河科技学院,河南郑州 450005;2.河南省人民医院,河南郑州 450011)
近年来,大黄临床应用范围正在逐渐扩大[1-2],其主要活性成分为大黄酸,具有抗炎、降血脂、降血压、保肝、抗肿瘤等药理活性[3-4],研发价值较大,但该成分在37 ℃时的溶解度仅为3.89 μg/mL[5],生物利用度也仅为16.4%[6]。
纳米混悬剂是将难溶性药物与稳定剂通过不同制剂技术制得的一种 “纯” 药物胶态分散体系[7-9],其载药量大,制备工艺简单,可促进药物快速溶出,提高其口服吸收生物利用度,丹曲林(商品名Ryanodex,英国Norgine公司)、茶碱(商品名Theodir,日本Mitsubishi Tanabe Pharma公司)等上市产品均采用了该技术。本实验制备了大黄酸纳米混悬剂,并考察其体内药动学,以期为其他相关制剂的开发提供参考。
1 材料
AR2140型电子天平(瑞士梅特勒-托利多公司);Agilent 1260型高效液相色谱仪 (美国Agilent公司);ATS型均质机(加拿大Seeker公司);DF-101S型集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);Master-sizer型粒度分析仪(英国马尔文仪器有限公司);VORTEX-5型涡旋混合器(海门市其林贝尔仪器制造有限公司);AP-40-110LA型超低温冰箱(浙江爱普生仪器有限公司);TYH-2型氮气吹扫仪(广西大学附属科学仪器有限公司)。
大黄酸原料药(批号H160515,纯度98.0%,陕西森弗生物技术有限公司);大黄酸对照品(批号110757-201504,纯度98.6%,中国食品药品检定研究院);大豆卵磷脂(批号AL-PC-98T,辅必成上海医药科技有限公司);羧甲基纤维素钠(CMC-Na,批号A1706-32,上海长光企业发展有限公司);聚乙烯吡咯烷酮K30 (PVP K30,批号25000240379,亚什兰集团公司);肝素钠(批号20160511S,新泰市朝阳生化研究所)。
清洁级SD大鼠,体质量(300±20)g,购自河南省动物实验中心,动物生产许可证号SCXK(豫)2016-0001。
2 方法与结果
2.1 大黄酸含有量测定(HPLC法)
2.1.1 色谱条件 Agilent Plus C18色谱柱(4.6 mm×150 mm,5 μm);流动相0.2% 磷酸-甲醇(35 ∶65);体积流量1.0 mL/min;柱温25 ℃;检测波长254 nm。
2.1.2 线性关系考察 精密称取10.14 mg大黄酸对照品,溶于10 mL甲醇中,得到1.014 mg/mL贮备液,流动相依次稀释至507、253.5、101.4、50.7、5.07 μg/mL,作为对照品溶液,在“2.1.1” 项色谱条件下进样测定。以溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=0.501 1X-5.322 1 (r=1.000 0),在5.07~507 μg/mL范围内线性关系良好。
2.1.3 方法学考察 取1.0 mL大黄酸纳米混悬液至10 mL量瓶中,甲醇超声溶解后定容,作为供试品溶液,于4、8、12、24、48 h在“2.1.1” 项色谱条件下进样测定,测得大黄酸峰面积RSD为0.57%,表明溶液在48 h内稳定性良好。取“2.1.2” 项下5.07、253.5、507 μg/mL对照品溶液,在“2.1.1” 项色谱条件下进样测定,测得大黄酸日内精密度RSD小于0.63%,日间精密度RSD小于1.03%,表明该方法精密度良好。取不含大黄酸的空白纳米混悬剂适量,甲醇依次稀释至50、100、150 μg/mL,测得大黄酸加样回收率为99.36%~100.07%,RSD小于1.54%。
2.2 大黄酸纳米混悬剂制备 取大黄酸50 mg、大豆卵磷脂25 mg,加入30 mL丙酮,45 ℃下磁力搅拌3 h至溶液澄清,减压浓缩至约5 mL,作为有机相,冷却至室温;取适量PVP K30,加到50 mL蒸馏水中溶解,作为水相,在转速1 000 r/min、一定制备温度下将有机相缓慢滴加到水相中,45 ℃下减压浓缩20 min以除去丙酮,在一定均质压力下循环均质一定次数,补加蒸馏水至50 mL,即得。
2.3 单因素试验
2.3.1 PVP K30用量 固定制备温度15 ℃,均质压力80 MPa,均质次数10次,考察PVP K30用量25、50、75、100 mg对粒径的影响,结果见图1。由此可知,PVP K30用量为75 mg时粒径最小。
2.3.2 制备温度 固定PVP K30用量75 mg,均质压力80 MPa,均质次数10次,考察制备温度0、15、30、45 ℃对粒径的影响,结果见图2。由此可知,制备温度为0 ℃时粒径最小。
2.3.3 均质压力 固定PVP K30用量75 mg,制备温度0 ℃,均质次数10次,考察均质压力60、80、100、120 MPa对粒径的影响,结果见图3。由此可知,均质压力为100 MPa时粒径最小。

图1 PVP K30用量对粒径的影响Fig.1 Effect of PVP K30 consumption on particle size

图2 制备温度对粒径的影响Fig.2 Effect of preparation temperature on particle size

图3 均质压力对粒径的影响Fig.3 Effect of homogenization pressure on particle size
2.3.4 均质次数 固定PVP K30用量75 mg,制备温度0 ℃,均质压力100 MPa,考察均质次数8、10、12、15、20次对粒径的影响,结果见图4。由此可知,均质次数15次时粒径最小。
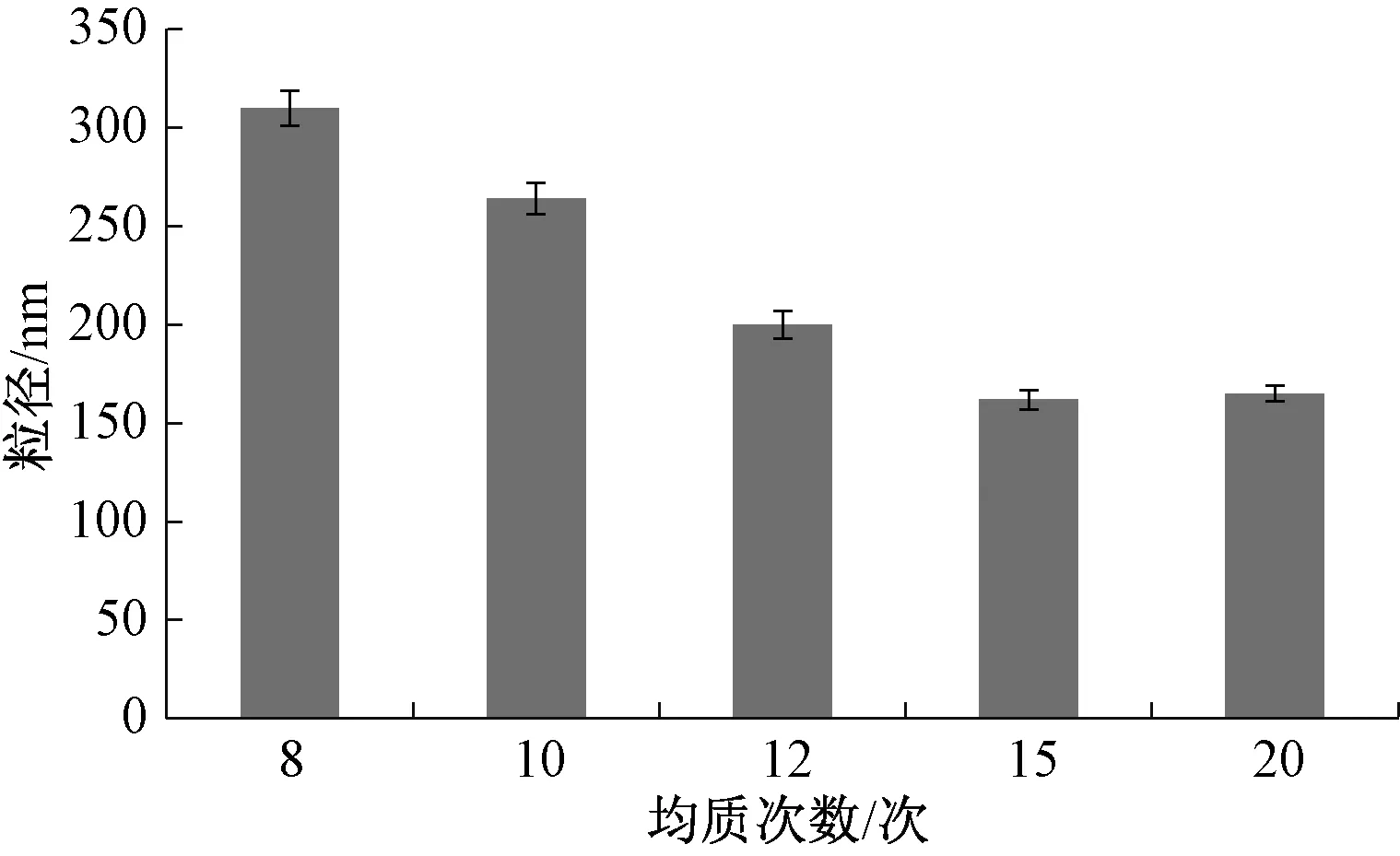
图4 均质次数对粒径的影响Fig.4 Effect of homogenization frequency on particle size
2.4 正交试验 在单因素试验基础上,以PVP K30用量(A)、均质压力(B)、均质次数(C)为影响因素,粒径(Y)为评价指标,正交试验优化制备工艺,因素水平见表1,结果见表2,方差分析见表3。

表1 因素水平Tab.1 Factors and levels
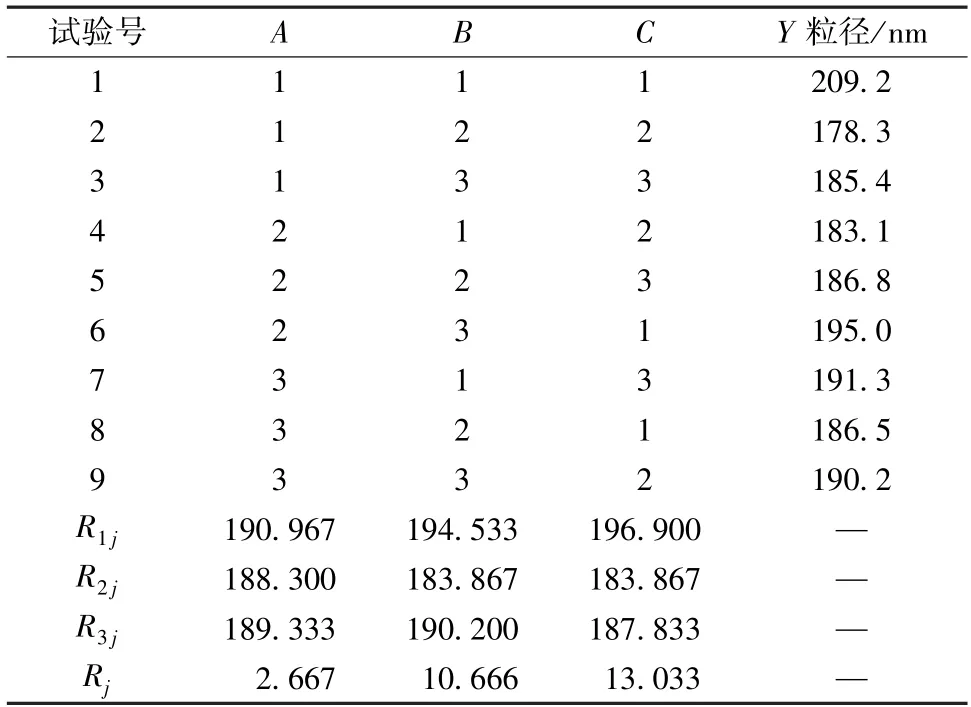
表2 试验设计与结果Tab.2 Design and results of tests

表3 方差分析Tab.3 Analysis of variance
由表2可知,粒径最小的最优工艺为A2B2C2;由表3可知,因素C具有显著影响(P<0.05),而B无显著影响(P>0.05)。最终确定,大黄酸纳米混悬剂制备方法为取大黄酸50 mg、大豆卵磷脂25 mg,加入30 mL丙酮,45 ℃下磁力搅拌3 h至溶液澄清,减压浓缩至约5 mL,作为有机相,冷却至室温;取75 mg PVP K30,加入50 mL蒸馏水中溶解,作为水相,在转速1 000 r/min、制备温度0 ℃下将有机相缓慢滴加到水相中,45 ℃下减压浓缩20 min以除去丙酮,在均质压力100 MPa下循环均质15次,补加蒸馏水至50 mL,即得。按上述优化工艺进行3批验证试验,测得平均粒径为(170.86±3.07)nm,表明该方法稳定可靠。
2.5 大黄酸纳米混悬剂表征
2.5.1 载药量 精密量取5 mL纳米混悬剂,不加冻干保护剂进行冷冻干燥,称定质量M1,加入100 mL甲醇溶解,10 000 r/min离心15 min,0.45 μm微孔滤膜过滤,取续滤液,在“2.1.1”项色谱条件下进样测定,计算质量M2,平行3次,计算载药量,公式为载药量= M2/M1×100%。结果,载药量为(32.14±0.92)%。
2.5.2 粒径、Zeta电位 按优化工艺平行制备3批大黄酸纳米混悬剂,各取0.1 mL,蒸馏水稀释50倍后测定粒径、Zeta电位,结果见图5~6。由此可知,纳米混悬剂平均粒径为(170.86±3.07)nm,Zeta电位为 (-31.90±1.34)mV,PDI为0.124±0.016。

图5 纳米粒粒径分布Fig.5 Particle size distribution of nanoparticles
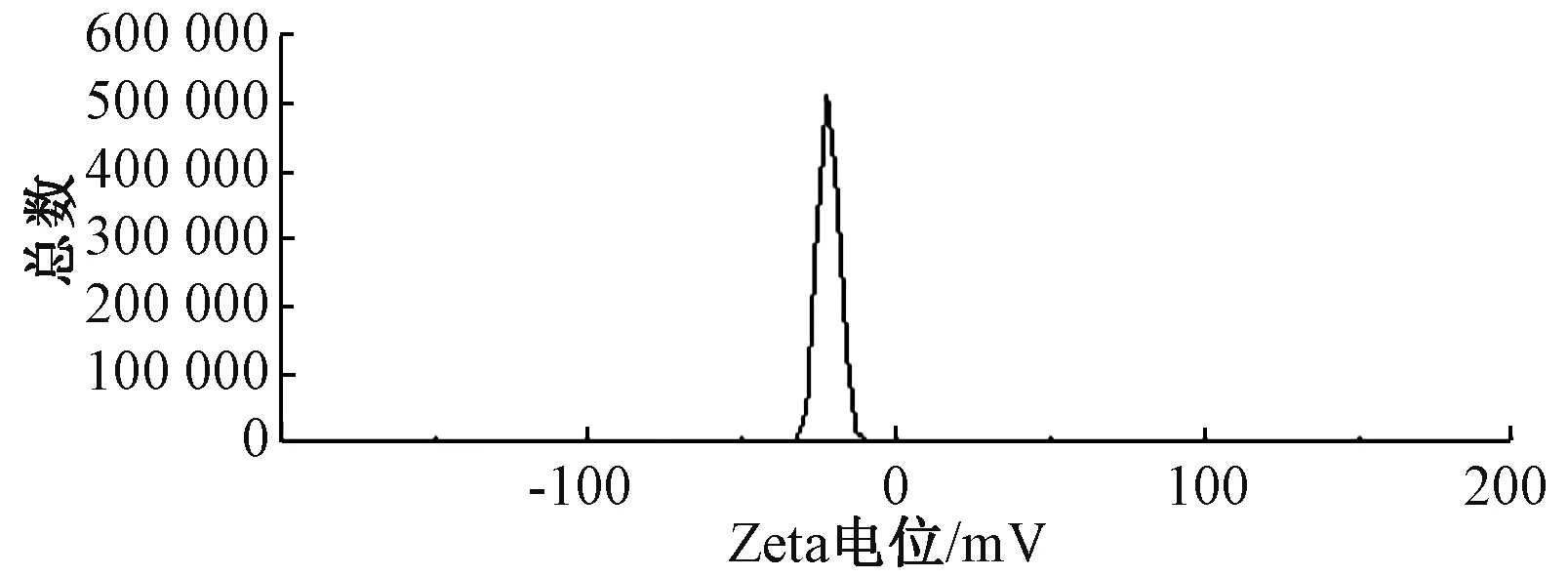
图6 纳米粒Zeta电位Fig.6 Zeta potential of nanoparticles
2.5.3 形态 取大黄酸纳米混悬剂适量,稀释50倍后滴于铜网上,滤纸吸去水分后自然晾干,置于透射电镜(TEM)选定区域中拍照,结果见图7。由此可知,纳米混悬剂中纳米粒呈球形,分布均匀,粒子之间无粘连。

图7 纳米混悬剂TEM图Fig.7 TEM image for nanosuspensions
2.5.4 体外释药 取大黄酸纳米混悬液4 mL,加入5%甘露醇,在-60 ℃超低温冰箱中预冻48 h后取出,迅速置于-25 ℃冷冻干燥机中处理12 h,再于6 h内缓慢升温至25 ℃,保持3 h后取出,即得冻干粉。取大黄酸及其纳米混悬液冻干粉(以大黄酸计10 mg)适量,加入2 mL超声脱气水制备混悬液,转移至活化透析袋中,两端扎紧,设定溶出仪温度为(37±1)℃,转速为100 r/min,溶出介质为900 mL超声脱气水,于不同时间点各取样3.0 mL,并保持溶出介质体积不变,0.45 μm微孔滤膜过滤,在“2.1.1” 项色谱条件下进样测定,绘制体外释药曲线,见图8。由此可知,纳米混悬剂40 min内累积溶出度为95.73%,但原料药90 min内仅为16.13%。

图8 大黄酸体外释药曲线Fig.8 In vitrodrug release curves for rhein
2.6 药动学研究
2.6.1 分组、给药及采血 12只大鼠随机分为2组,每组6只,给药前空腹12 h,灌胃给予大黄酸及其纳米混悬剂冻干粉的0.5% CMC-Na混悬液(25.0 mg/mL),给药剂量均为50 mg/kg (以大黄酸计),于0.083、0.167、0.25、0.5、1.0、2.0、4.0、6.0、8.0、10.0、12.0 h眼眶静脉丛取血各约0.3 mL,置于肝素化离心管中(在6 h内补充适量生理盐水以防止生理性缺血),2 500 r/min离心2 min,置于-20 ℃冰箱中。
2.6.2 血浆样品处理 参考文献[4]报道的方法。血浆样品在室温下解冻后精密吸取100 μL至离心管中,加入1.5 mL甲醇涡旋5 min后12 000 r/min离心5 min,取上清液,40 ℃下缓慢吹干,100 μL甲醇复溶。
2.6.3 线性关系、专属性考察 取“2.1.2” 项下贮备液适量,甲醇依次稀释至12.68、6.34、3.17、1.585、0.317 μg/mL,各精密量取0.4 mL,45 ℃氮气缓慢吹去有机溶剂后加入0.4 mL空白血浆,作为血浆对照品溶液,各精密吸取100 μL,按“2.6.2” 项下方法处理后在“2.1.1” 项色谱条件下进样测定。以溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=2.523 7X-2.208 4 (r=0.991 3),在0.317~12.68 μg/mL范围内线性关系良好。另外,大黄酸在7.68 min时出峰,血浆内源性物质不干扰测定,表明该方法专属性良好。
2.6.4 方法学考察 取给药后1.0 h血浆样品,室温下解冻后于0、2、6、12、24、48 h在“2.1.1” 项色谱条件下进样测定,测得大黄酸峰面积RSD为2.14%,表明溶液在48 h内稳定性良好。取“2.6.3” 项下12.68、6.34、0.317 μg/mL血浆对照品溶液,同一天在“2.1.1” 项色谱条件下进样测定6次,测得大黄酸日内精密度RSD分别为11.38%、7.62%、8.27%;每天测定1次,连续5 d,测得大黄酸日间精密度RSD分别为10.93%、8.44%、9.63%,表明该方法精密度良好。取100 μL空白血浆,甲醇依次稀释至12.68、6.34、1.585 μg/mL,在“2.1.1” 项色谱条件下进样测定6次,测得大黄酸方法回收率(测得质量浓度、初始质量浓度的比值)为92.87%~97.14%,RSD均小于5.96%。取 “2.6.3” 项下12.68、6.34、1.585 μg/mL血浆对照品溶液,按“2.6.2” 项下方法处理后在“2.1.1” 项色谱条件下进样测定6次;另取“2.6.3” 项下不加空白血浆的上述3种质量浓度对照品溶液,在“2.1.1”项色谱条件下进样测定6次,测得大黄酸萃取回收率(加血浆、不加血浆对照品溶液峰面积的比值)为85.37%~91.61% 之间,RSD分别为9.91%、10.48%、8.43%。
2.6.5 分析结果 采用3P97程序统计矩模型计算主要药动学参数,结果见表4,绘制血药浓度-时间曲线,见图9。由此可知,纳米混悬剂t1/2、Cmax、AUC0~t、AUC0~∞高于原料药 (P<0.01),tmax虽有所提前但差异无统计学意义(P>0.05),相对生物利用度提高至2.02倍。
表4 大黄酸主要药动学参数(, n=6)Tab.4 Main pharmacokinetic parameters for rhein (,n=6)
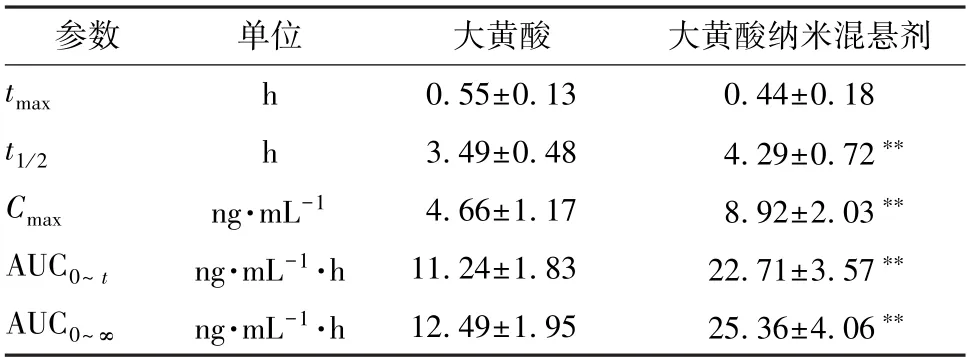
表4 大黄酸主要药动学参数(, n=6)Tab.4 Main pharmacokinetic parameters for rhein (,n=6)
注:与大黄酸比较,**P<0.01。
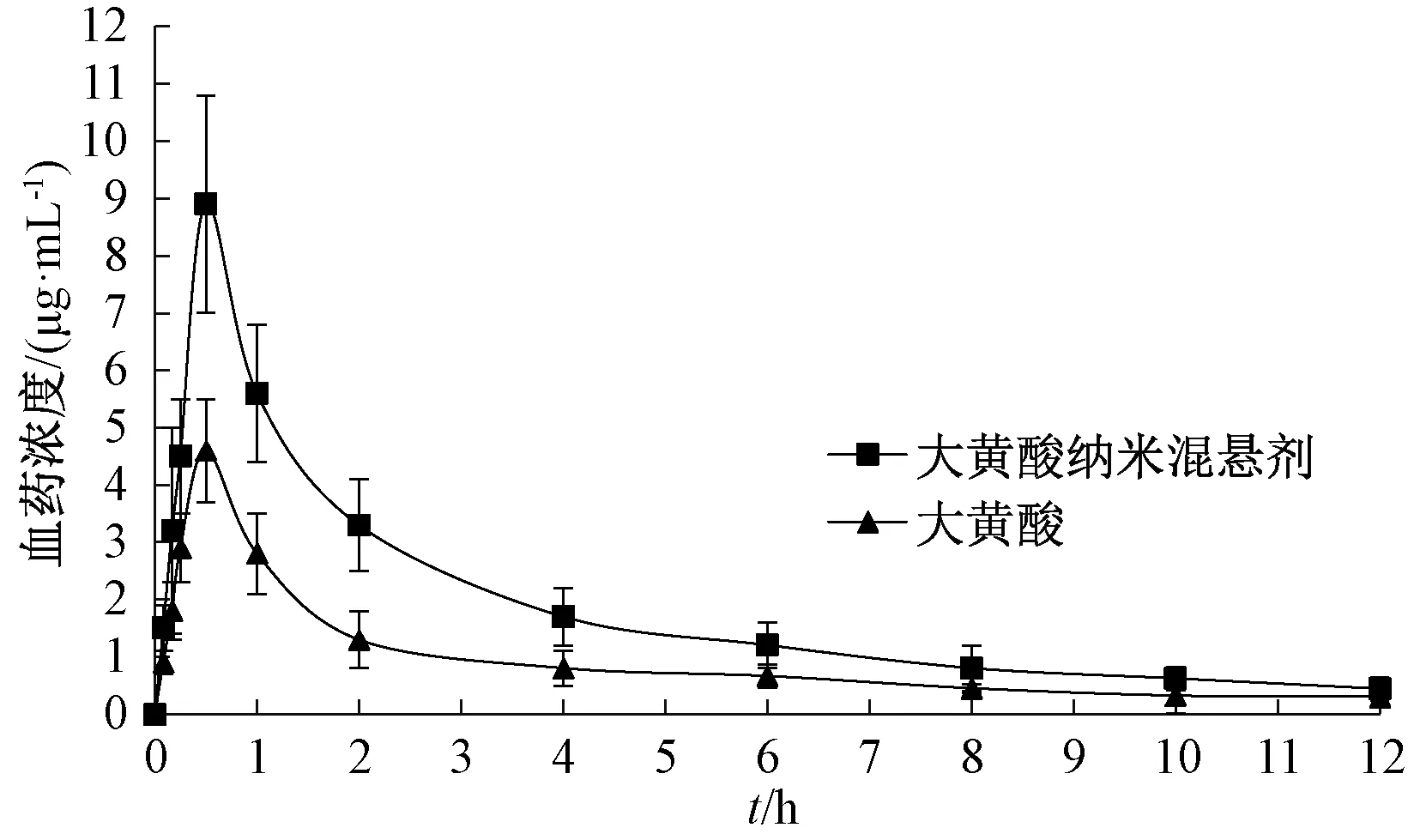
图9 样品血药浓度-时间曲线Fig.9 Plasma concentration-time curves for samples
3 讨论
前期预实验对聚山梨酯80、聚乙烯醇、磷脂、泊洛沙姆188等稳定剂进行了考察,发现所制得纳米混悬剂均存在粒径稍大、PDI>0.3、稳定性差等问题[10-11]。本实验将PVP K30与磷脂联合应用后,有效改善了上述问题,其原因可能为PVP K30分子链具有一定延展性,可形成空间阻力而防止纳米粒之间聚集[12-13];磷脂吸附于纳米粒表面时提供了电荷,可利用电荷排斥力来提高其稳定性[14-15]。据报道,大黄酸在70 ℃下可在3 h内保持稳定[16],故本实验的制备条件(45 ℃下磁力搅拌3 h)不会对大黄酸稳定性产生明显影响。另外,在制备体系中加入大豆磷脂也有助于提高大黄酸的稳定性[17]。
体内药动学研究结果显示,大黄酸纳米混悬剂冻干粉tmax较大黄酸略有提前,但无显著差异,由于两者该参数均较快,故在0.5 h内设置4个采血点;冻干粉t1/2、 Cmax、AUC0~t、AUC0~∞显著高于原料药,相对生物利用度提高至2.02倍,其原因可能是纳米混悬剂口服进入机体后可增强药物对肠道黏膜的黏附性,延长滞留时间,间接促进药物吸收,同时也对其药动学参数产生影响[18],而且纳米级药物可在伊派尔结中大量聚集,通过淋巴结中的M细胞进入血液循环,从而改变了药物吸收途径及药动学[19-22]。另外,大黄酸水溶性、脂溶性均不理想[5],而纳米混悬剂可不改变该成分脂溶性(透膜性)的同时影响其生物利用度,能为该剂型后续研究(如药效学等)奠定基础[23-24]。
