泰山黄精内生细菌的抗菌活性研究
2020-12-04郭晓平刘兴飞李晓楠吕雪茹郤少梅田园
郭晓平 刘兴飞 李晓楠 吕雪茹 郤少梅 田园
(山东第一医科大学(山东省医学科学院)生命科学学院,泰安 271016)
近年来,化学农药的滥用对人类生态环境产生了恶劣的影响,还导致了病虫害抗性等问题[1]。生物农药具有选择性强、药效高、对环境较友好、不易产生抗药性等优点,这些特性不仅满足当代人的需求,更满足可持续发展的战略目标,所以,发展生物农药具有十分广阔的前景,生物农药必将成为最具发展潜力的农药品种[2-3]。研发生物农药有多种途径,其中,分离筛选具有防病、杀虫等生防作用的微生物成为一个新兴的研究热点[4-5]。植物内生菌广泛存在于健康植物体内,在与植物长期进化过程中,形成了独特的生理和代谢机制,可以提高植物抗逆能力;同时还能够产生多种活性物质,具有促生、固氮、防治病虫害等多种特性;是尚未被完全开发的微生物资源[6-7]。因此,从植物内生菌中挖掘生防菌具有广阔前景,且对保护和开发稀有植物资源有着重要的现实意义。
泰山黄精(Polygonatum sibiricum Delar.ex Redoute)是泰山四大名药之一,属百合科多年生草本植物[8]。黄精是中国传统的药食同源的植物资源,现代化学成分研究证明,黄精中含有多糖、皂苷、黄酮、挥发油等多种化学成分,其中黄精多糖是黄精化学组成的一个重要部分,是黄精的主要生物活性成分之一[9];此外还含有多种人体所需的氨基酸和维生素等。药理学研究证明,黄精多糖具有抗衰老、抗肿瘤、降血糖、降血脂、防动脉硬化、抗病毒、抗菌、抗炎、提高机体免疫力、提高和改善记忆等多种药理作用[10],具有良好的开发利用价值。近年来关于泰山黄精内生菌的报道,仅见于对其内生真菌的研究[11-12],而未见对其内生细菌的研究。因此,本研究将对泰山黄精内生细菌进行分离,以期筛选出对植物病原菌有较强拮抗活性的生防菌,为泰山黄精内生细菌的开发利用提供理论基础,同时也为拓展泰山野生黄精资源的保护和利用途径提供科学依据。
1 材料与方法
1.1 材料
供试植物:泰山黄精(Polygonatum sibiricum Delar.ex Redoute)健康植株采自山东省泰山自然保护区海拔800 m处。
供试病原菌:尖孢镰刀菌(Fusarium oxysporum)、串珠镰刀菌(Fusarium moniliforme)、层生镰刀菌(Fusarium solani)、白绢病菌(Sclerotium rolfsii),禾谷镰刀菌(Fusarium graminearum),立枯丝核菌(Rhizoctonia solani),由山东农业大学农业微生物重点实验室惠赠。
供试培养基:LB培养基[13](内生细菌用培养基):胰蛋白胨10 g,酵母浸膏5 g,氯化钠10 g,蒸馏水1 000 mL,pH 7.0-7.2。PDA培养基(植物病原真菌用培养基):琼脂条20 g,葡萄糖20 g,土豆200 g,水1 000 mL,自然pH。绿豆汤培养基(制备真菌孢子用培养基):将20 g绿豆清洗干净,置于1 000 mL蒸馏水中加热煮沸,至绿豆裂开,三层纱布过滤去除豆粒即得。
1.2 方法
1.2.1 内生菌的分离纯化 采用组织块培养法对黄精内生细菌进行分离与纯化[13]:新鲜的黄精根茎,先用自来水将表面的泥沙杂质冲洗干净,然后用5%(V/V)次氯酸钠溶液处理5 min,无菌水漂洗4次后用无菌滤纸吸去残留无菌水;再用75%乙醇溶液处理5 min,用无菌水漂洗4次后吸去残留无菌水并干燥;最后将根茎切成直径3 mm小块,接种到固体LB培养基上。于30℃培养箱中培养2-3 d,将组织块周围生长的细菌菌斑用接种环挑取到LB培养基上,采用四区划线法反复纯化直至获得纯净菌株。
1.2.2 内生菌的筛选 参照穆静娟等[14]的方法对内生菌进行筛选。
初筛:采用平板对峙法,将PDA培养基上培养好的真菌病原菌,用打孔器打孔获得直径5 mm的病原菌饼,用无菌镊子将菌饼接种于PDA培养基正中央,同时用接种环挑取分离得到的内生细菌单菌落均匀接种于真菌菌饼四周,距离菌饼外缘2 cm处,以只接种病原菌菌饼,不接种内生细菌的平板作为空白对照(CK),置于28℃真菌培养箱中培养4 d,观察抑菌情况。
复筛:将初筛中抑菌效果最好的内生菌,均匀地分4点接种在病原真菌菌病四周,每个处理重复3次,以不接拮抗菌为空白对照,置于28℃真菌培养箱中培养4 d,计算抑菌率。抑菌率=(对照组菌落直径平均值-处理组抑菌菌落直径平均值)/对照组菌落直径平均值×100%。
1.2.3 菌株鉴定 形态学鉴定:将筛选出的抑菌活性最强的菌株于LB平板上四区划线接种,置于37℃培养1 d后,观察菌落形态;并进行革兰氏染色,在显微镜下观察其菌体形态。
生理生化鉴定:参照文献[15-16]对菌株进行生理生化鉴定。
分子生物学鉴定:利用16S rDNA测序对菌株进行分子学鉴定。将LB液体培养基中培养过夜的细菌菌液直接交给睿博兴科(青岛)测序部进行PCR及测序。将测定的16S rDNA序列与GenBank中已知核酸序列进行BLSAT分析,从中获得与菌株同源的序列,利用MEGA7.0软件构建系统发育树。
1.2.4 挥发性物质对病原菌的抑制作用 参照穆静娟等[14]的方法,将活性菌株按1%接种量接种到装有100 mL LB液体培养基的250 mL三角瓶中,37℃200 r/min培养24 h,然后12 000 r/min离心去掉上清液,吸取50 μL浓缩菌液用涂布棒涂布于LB固体平板上,晾干菌液。打孔获得5 mm植物病原真菌菌饼,并分别接种到PDA培养基中央,然后将上述涂过浓缩菌液的LB平板与接有病原真菌的PDA平板倒扣起来,接有内生细菌的一面朝上,两个平板用封口膜密封,此为处理组;同时,以只接病原真菌,不接拮抗菌为对照组。每组重复3次,置于28℃培养箱,培养4 d观察结果,测量真菌生长直径,计算抑菌率(计算方法见1.2.2)。
1.2.5 发酵液对病原菌的抑制作用 取植物病原菌菌饼接种于100 mL绿豆培养基中,28℃ 150 r/min培养5 d。双层无菌纱布过滤除去菌丝,用血球计数板进行孢子计数,并用无菌水调整孢子浓度为105个/mL。将调整好浓度的孢子液放置于4℃保存备用。
将活性菌株接种到LB液体培养基中,37℃ 200 r/min发酵培养,每隔24 h取1 mL菌液暂存于4℃冰箱,连续取样4 d。然后将4次收集的菌液12 000 r/min离心5 min,上清以无菌滤膜过滤彻底除菌。取1 mL真菌孢子悬液与融化的PDA混合倒平板,并用打孔器在平板上打5个孔,分别加入4次的无菌上清液,并以LB培养基作空白对照。培养4 d观察抑菌情况,确定抑菌物质产生时间。每组实验重复3次。
2 结果
2.1 黄精内生细菌的分离纯化
利用组织块分离法对黄精内生细菌分离,并通过多次纯化,共获得12株黄精内生细菌命名为HJ-1-HJ-12,其中HJ-12的抑菌活性最好,用于后续研究。
2.2 内生拮抗菌HJ-12的抑菌率
如图1所示,菌株HJ-12对白绢病菌、串珠镰刀菌、禾谷镰刀菌、尖孢镰刀菌、立枯丝核菌、层生镰刀菌6种植物病原菌均有不同程度的抑制作用。
从表1可见,株HJ-12对不同病原菌抑制程度不同,抑菌率为(18.57±0.25)%-(48.33±0.15)%。对立枯病菌抑制活性最强,抑菌率为(48.33±0.15)%,对白绢病菌抑制活性最弱,为(18.57±0.25)%。
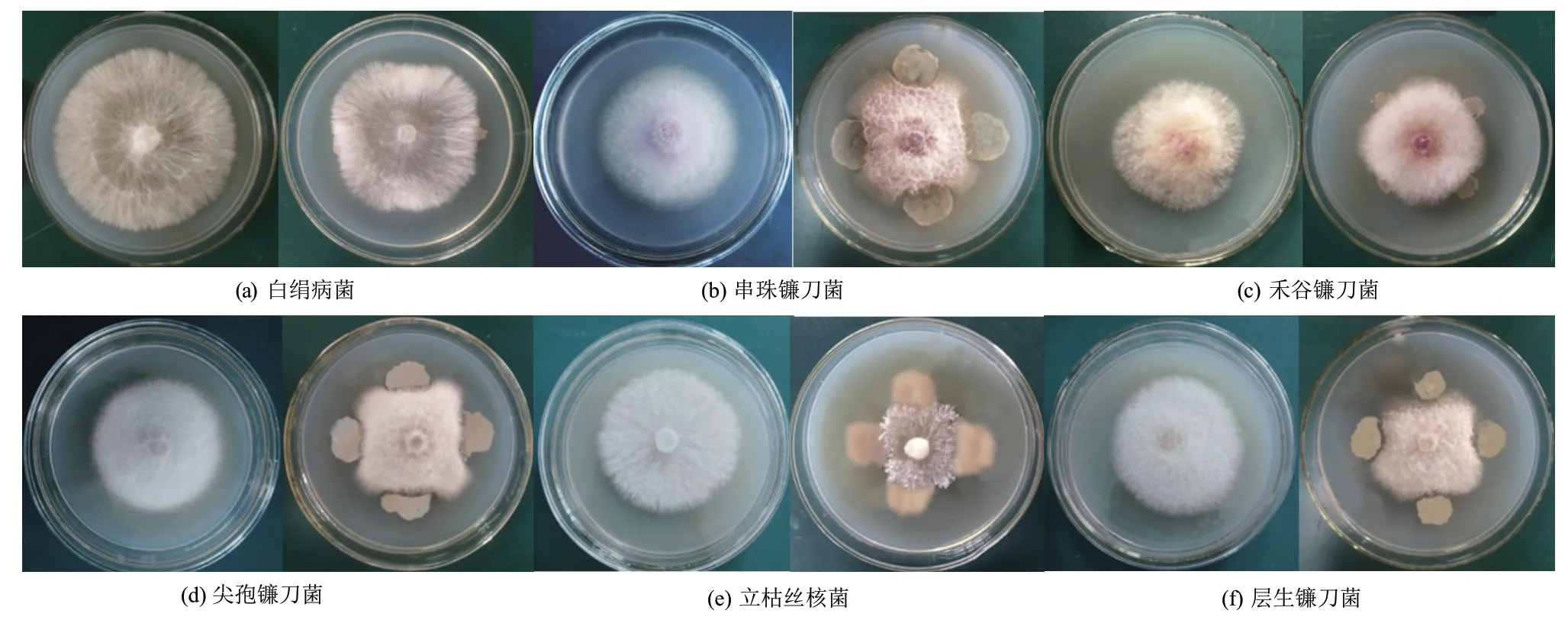
图1 菌株HJ-12对不同病原真菌抑菌谱

表1 菌株HJ-12对6种植物病原真菌的抑菌率
2.3 内生菌的鉴定
2.3.1 形态学鉴定 菌株HJ-12在LB 平板上培养,培养初期可观察到菌落光滑、饱满、乳白色;培养后期表面粗糙,有曲折的沟槽样外观。显微镜下观察到该菌株为革兰氏阳性菌,细胞呈杆状、单生、有芽孢、无荚膜(图2)。

图2 HJ-12菌株油镜下的形态(100×10)
2.3.2 生理生化鉴定 HJ-12菌株为严格好氧菌株,VP实验阴性,接触酶阳性,可发酵葡萄糖、甘露醇,不能利用木糖、阿拉伯糖,能水解酪素、明胶、不能水解淀粉,能利用柠檬酸盐,不能利用丙酸盐,不产生吲哚和硫化氢,硝酸盐还原实验阳性。其生理生化特性与短短芽孢杆菌(Brevibacillus brevis)的特征吻合[15]。
2.3.3 分子生物学鉴定 为进一步确定菌株的分类学地位,测定其16S rDNA 基因序列,扩增目的基因序列长度为1 415 bp,GenBank号为MN883861。将该序列进行BLAST比对分析,结果发现其与Brevibacillus brevis同源性最高,相似度为99.72%。选出相关性较高的属内相关菌株的序列,用MEGA7.0构建系统发育树(图3),HJ-12与Brevibacillus brevis DYJL44和Brevibacillus brevis GZDF3处于同一分支,结合菌落菌体形态及生理生化特征,将该菌株鉴定为Brevibacillus brevis HJ-12。
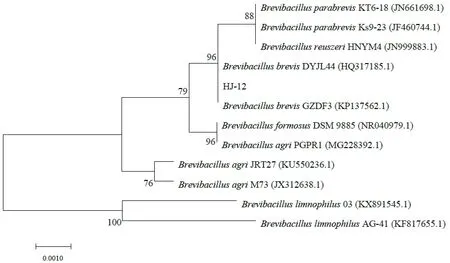
图3 根据HJ-12菌株16s rDNA同源序列构建的系统发育树
2.4 挥发性物质抑菌效果
由图4可以看出HJ-12产生的挥发性物质同样具有广谱抑菌活性,且比细菌菌体对于病原真菌具有更加明显的抑菌效果。
由表2可知,HJ-12产挥发性物质的抑菌率为(21.05±0.17)%-(83.53±0.19)%,对白绢病菌抑制效果最好为(83.53±0.19)%,对尖孢镰刀菌抑制效果最低为(21.05±0.17)%。
2.5 发酵液抑菌活性及抑菌物质产生时间
由图5可以看出HJ-12产生的发酵液上清同样具有抑菌活性。在培养时间上,培养1 d的发酵液上清尚未产生抑菌效果,2 d以后,发酵液无细胞上清具有明显抑菌圈,说明抑菌物质需要在培养2 d后才开始产生。

图4 HJ-12产挥发性物质抑菌谱
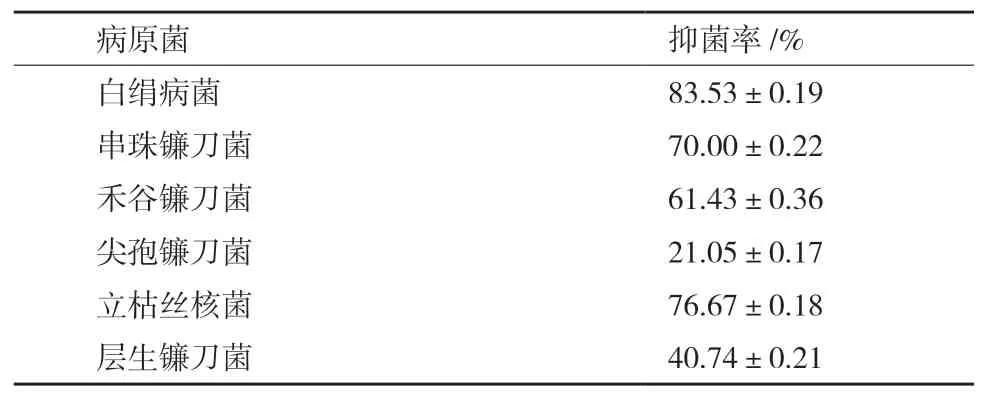
表2 HJ-12产挥发性物质对6种植物病原菌的抑菌率
3 讨论
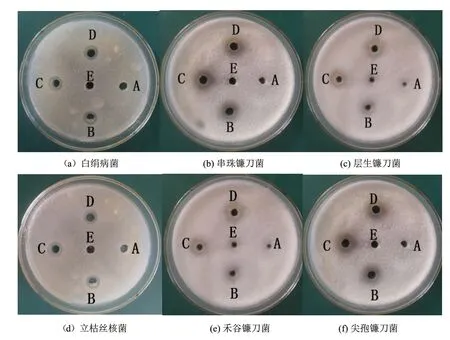
图5 HJ-12发酵液活性
随着植物病害对已有农药的耐药性加剧及新的病害的不断出现,对新型生物源农药的开发也越来越迫切。其中,利用生防菌防治植物病害在国内外已有较多的研究[17];在众多生防菌来源中,植物内生菌对各种作物病害具有很好的防治效果[18]。本研究从泰山黄精中分离得到一株内生细菌HJ-12,对尖孢镰刀菌、串珠镰刀菌、层生镰刀菌、白绢病菌、禾谷镰刀菌、立枯丝核菌均具有不同程度的拮抗作用,这是首次关于泰山黄精内生细菌拮抗植物病原真菌的报道。其他地区黄精内生细菌也有类似的研究,迟惠荣等[19]获得一株多花黄精内生贝莱斯芽胞杆菌,该菌株对尖孢镰刀菌拮抗作用明显,但并未研究该菌株对其他植物病原真菌的抑制活性。柏晓辉等[13]获得一株黄山黄精内生细菌,对绿脓杆菌、鼠伤寒沙门氏菌和苏云金芽孢杆菌3种细菌有良好的抑菌活性。以上结果表明,黄精中普遍存在芽孢杆菌属内生菌,且该属菌株产生的代谢物具有抑菌作用。
本研究获得的菌株HJ-12,经形态学、生理生化反应及系统发育树构建,鉴定为短短芽孢杆菌(Brevibacillus brevis)。短短芽孢杆菌广泛分布于根际土壤及植物微生态系统中,王玉婷等[20]报道过一株对番茄早疫病菌菌丝和孢子均有致畸作用的内生短短芽孢杆菌011;祝学海等[21]从根际土壤中获得了3株对半夏块茎腐烂病致病菌有拮抗活性的细菌,经鉴定全部为短短芽孢杆菌;杨从军[22]获得的内生短短芽孢杆菌W4对番茄灰霉病菌具有良好的抑制活性,其优化后的发酵液稀释25倍后对病原菌的抑制率可达92.8%。以上结果说明短短芽孢杆菌是一类理想的生防菌。
菌株Brevibacillus brevis HJ-12产生的挥发性物质与菌体相比具有更好的广谱抑菌效果。利用挥发性物质对抗植物病原菌是芽孢杆菌发挥拮抗作用的重要机制[23],与非挥发性抗菌物质相比,挥发性抗菌物质更易于在土壤或空气中渗透和扩散,能更有效地杀灭病原菌。另外,研究发现HJ-12的无细胞发酵液上清液具有抑菌活性,说明该菌的抑菌机制可能是几种作用的结合。本研究所分离筛选的内生细菌是在体外条件下对病原菌进行的拮抗实验,其在活体上生防效果还需进一步研究验证。
4 结论
本研究从健康黄精根茎中分离得到1株对尖孢镰刀菌、串珠镰刀菌、层生镰刀菌、禾谷镰刀菌、白绢病菌、立枯丝核菌均具有不同程度拮抗作用的内生菌株HJ-12,根据菌体特征、生理生化特征及16SrDNA序列分析将其命名为Brevibacillus brevis HJ-12。HJ-12菌株所产生的挥发性物质以及无菌上清液对于各种病原菌也存在广谱的抑制作用,且发酵液中抑菌物质的产生时间为液体培养2 d后。
