玉米 ZmENA1 基因的克隆及其对金属离子的应答分析
2020-12-04张鑫周晓今逄森李素贞黄家兴陈茹梅
张鑫 周晓今 逄森 李素贞 黄家兴 陈茹梅
(1.中国农业大学理学院应用化学系,北京 100193;2.中国农业科学院生物技术研究所,北京 100081)
除吸收铁(Fe)和锌(Zn)等元素以满足自身生长需求外,植物还会从土壤中获取诸如铜(Cu)、锰(Mn)、镍(Ni)、钴(Co)和镁(Mg)等金属元素。它们是植物行使各种生理生化功能所必须的元素,其摄入不足会造成营养缺乏性疾病[1]。其中Zn是许多蛋白质的关键辅助因子,在细胞生长、发育和分化等过程中均发挥重要作用[2-3],充足的Zn有利于提高作物产量[4];Cu是植物必需的微量元素,参与光合作用、呼吸作用、解毒和氧化还原等生理过程[5];Mn参与组成植物光合蛋白和酶的主要结构,缺乏会导致光合系统II的损伤并阻断电子传递[6-7]。由此可见,适量的金属有益于植物体的生长发育,但其过量积累可对植物产生毒害作用。重金属含量的增加可以通过多种机制对细胞造成损害[8],而且并未发现镉(Cd)、镓(Ga)、金(Au)、铅(Pb)、锂(Li)、汞(Hg)、银(Ag)、锡(Sn)和铀(U)等重金属在植物体中参与特定的生物功能,因此它们被认为是植物生存的非必需金属元素[9]。近年来,由于重金属向环境的排放日渐严重,在水稻等作物中检出了过量的Cd和砷(As)。其中,以Cd在植物中的富集尤为常见[10],因为其通常会被Fe、Zn等金属的转运体转运并储藏在植物体内。因此,开展植物对重金属元素的吸收和运输机理研究,对于提高作物品质和减少可食用部位的重金属元素含量具有重要的理论和实际意义。
烟酰胺(Nicotianamine,NA)最初在烟草中发现的一种非蛋白氨基酸[11],由三分子蛋氨酸经烟酰胺合成酶合成而来[12]。NA可作为金属螯合剂辅助亚铁离子(Fe2+),锰离子(Mn2+),锌离子(Zn2+)和铜离子(Cu2+)等金属离子在植物体内长距离运输[13-16]。此外,NA也是植物铁载体(Phytosiderophores,PS)合成的前体[17-18]。通过转基因技术提高水稻中NA和植物铁载体的浓度可增加胚乳中Zn和Fe含量,同时发现这些转基因株系中Cd的浓度降低,表明NA及PS的合成与分泌也可调节Cd在植物体内的储存[19]。NA外排转运体(EFFLUX TRANSPORTER of NA 1,ENA1)首次在卵母细胞中被发现具有转运NA的能力[20]。缺Fe会诱导ENA1基因在根中上调表达;在正常营养液培养下,OsENA1过表达转基因幼苗的根毛多于野生型,而在高浓度Zn营养液中根毛数目并无差异[21]。以上研究表明,ENA1可能对植物体内金属元素的稳态方面有一定的调节作用。在拟南芥(Arabidopsis)中发现了植物铁载体转运体(TRANSPORTER of MUGINEIC ACIDS 1,TOM1)的同源蛋白ZINCINDUCED FACILITATOR 1(ZIF1),其编码基因表达受Zn和Mn的诱导,并且ZIF1的突变体对Cd敏感[22]。此外,在过表达ZIF1的拟南芥植株中出现脉间黄化的表型,且转基因幼苗地上部分Zn的含量比野生型植株显著降低[22-23]。综上可见,影响NA的转运可能对各类金属元素的分布和储存产生不同影响。
ENA1作为NA的转运体在植物体内的金属元素的平衡方面有重要作用,但玉米的ENA1未见相关报道。我们前期研究发现,玉米(Zea mays.L)中的ZmENA1(Zm00001d052532)与水稻(Oryza sativa.L)中的ENA1同源性最高,并且发现ZmENA1表达量对Fe的响应非常明显。因此,本研究克隆了玉米 ZmENA1的开放阅读框(ORF),分析了其蛋白序列特征,并通过荧光定量技术分析了ZmENA1在籽粒发育过程中的时空表达,以及在不同金属离子浓度下的表达模式,为深入研究ZmENA1通过应答植物自身发育与环境金属元素信号以调节NA分泌和金属离子转运和储藏的分子机理提供一定依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 本试验所用种子由中国农业科学院生物技术研究所保存。玉米B73自交系材料种植于中国农业科学院生物技术研究所试验田(河北省廊坊万庄)。玉米B73自交系幼苗材料置于28℃和光暗比16 h /8 h的培养箱中进行培养。
1.1.2 试验试剂 RNA 提取试剂盒、cDNA第一链的合成试剂盒以及 B 载体试剂盒均购自北京全式金生物公司;KOD高保真酶购自东洋纺公司;实时荧光定量 TB GreenTMPremix EX TaqTM购自 TaKaRa 公司;引物合成和测序工作由北京奥科鼎盛生物科技有限公司完成;大肠杆菌感受态细胞 DH5α 购自北京擎科生物科技有限公司;Hoagland 营养液购自北京酷来搏科技有限公司;琼脂糖胶 DNA 回收试剂盒购自上海博彩生物科技有限公司;大提质粒试剂盒购自 Promega 公司;其它试剂均为国产分析纯。
1.2 方法
1.2.1 材料处理 取授粉后4 DAP和10 DAP 的玉米籽粒,此外分别取12 DAP、16 DAP、20 DAP、24 DAP、26 DAP和28 DAP玉米胚乳和种皮的混合部分以及胚。对于不同金属浓度下幼苗的处理,首先将玉米种子利用卷纸法在清水中进行萌发,待长到三叶期放入标准 Hoagland 营养液中培养至三叶一心期,随后进行金属处理:标准 Hoagland 营养液(对照),在标准Hoaglang营养液基础上将个别金属离子浓度分别配制为 c(Zn2+):200 μmol/L、c(Mn2+):500 μmol/L、c(Cu2+):500 μmol/L、c(Cd2+):500 μmol/L以及分别缺 Zn、Mn 和 Cu 的营养液,并取不同处理时间幼苗的地下部和地上部,液氮速冻存于-80℃。
1.2.2 ZmENA1的克隆将材料进行液氮速冻研磨,并按照RNA提取试剂盒说明书进行总RNA提取,利用琼脂糖凝胶电泳检测RNA的完整性。然后以 RNA 为模板参照逆转录试剂盒说明书反转录成cDNA第一链。以逆转录获得cDNA为模板,应用上游引物:5'-ATGGGCGGGGATGCGGCG-3'和下游引物5'- ATGGTCTGGTCCATTTTGCCAGT -3',KOD 高保真酶扩增获得ZmENA1基因的ORF,扩增程序为:94℃预变性1 min;98℃变性10 s,68℃退火及延伸45 s,35个循环;68℃延伸10 min。
用1.2%琼脂糖凝胶电泳检测PCR扩增产物,回收目的条带,与B载体连接,采用热激法与大肠杆菌感受态细胞 DH5α 进行转化,在含有 IPTG和 X-gaL 的LB平板中进行涂布培养并挑取白色单克隆,随后将单克隆在液体培养基中培养,经菌液PCR 验证成功后送奥科鼎盛生物有限公司测序。
1.2.3 ZmENA1 的生物信息学分析 利用蛋白质 数 据 库(https://www.expasy.org/resources)分析ZmENA1的氨基酸序列特性;利用 ExPASy 的SOPMA 工具(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对蛋白质的二级结构进行预测;通过ExPASy 的 SWISS-MODEL 构建蛋白质三级结构;通过 NetPhos 在线工具(http://www.cbs.dtu.dk/services/NetPhos/)对 ZmENA1 的磷酸化位点进行预测;通过 SignaIP 预测工具(http://www.bioxyz.net/signal-peptide/index.html)对 ZmENA1 的信号肽进行预测;通过TMHMM Server 2.0跨膜分析 网 站(www.cbs.dtu.dk/services/TMHMM-2.0/)对ZmENA1的跨膜区进行预测。
1.2.4 ZmENA1的实时荧光定量表达分析参照TaKaRa公司SYBR®Fast qPCR Mix试剂盒说明书进行实时荧光定量检测ZmENA1 的表达模式。利用Primer 3.0(http://bioinfo.ut.ee/primer3-0.4.0/)网站设计基因特异引物(F:5'-GGACCAGACCATGACTCCAG-3',R:5'-GGCAAGCCCTATGTTGTTGG-3')进行实时荧光定量试验。以玉米Actin1基因为内参(F:5'-ATGTTTCCTGGGATTGCCGAT-3',R:5'-CCAGTTTCGTCATACTCTCCCTTG-3')。实时荧光定量扩增程序为:94℃预变性30 s;94℃变性5 s,68℃退火及延伸34 s,40个循环;溶解曲线程序根据QuantStudio 1仪器设定。实时荧光定量数据通过2-ΔΔCt法计算相对表达量。
2 结果
2.1 玉米中ZmENA1的克隆
本实验室前期研究发现,ZmENA1是水稻中OsENA1的同源蛋白,并且该基因的表达量对环境中 Fe 浓度有一定的响应。我们依据B73数据库中预测的 ZmENA1 基因的ORF区域进行引物设计,随后PCR扩增,并对PCR扩增产物进行琼脂糖凝胶电泳检测,图1 所示在1 300 bp 左右出现特异条带,且大小与预测的 ORF 序列长度1 356 bp 相近。将目的条带回收并连接载体测序,结果表明获得了正确的ZmENA1 克隆且其核苷酸序列与玉米 B73 序列一致。
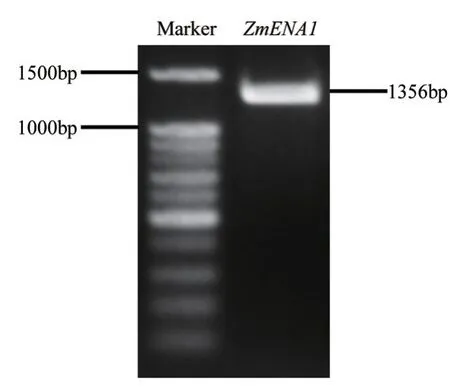
图1 ZmENA1基因的克隆
2.2 ZmENA1蛋白生物信息学分析
2.2.1 理化性质的分析 网站预测 ZmENA1 蛋白长度为 452 个氨基酸,含有 14 个外显子和 13 个内含子,蛋白质分子大小为 48.998 kD,理论等电点为8.06。亮氨酸(Leu)、丙氨酸(Ala)、丝氨酸(Ser)、缬氨酸(Val)、异亮氨酸(IIe)和甘氨酸(Gly)在所有氨基酸组成中出现频率较高,分别为 12.2%,11.7%,9.5%,8.2%,8.0%,6.6%,但组氨酸(His)、天冬酰胺(Asn)、半胱氨酸(Cys)和色氨酸(Trp),出现频率较低,分别为 0.7%,0.9%,1.5%,1.5%。
2.2.2 二级结构和三级结构预测 通过 ExPASy 的SOPMA 在线工具进行蛋白质二级结构的预测,从图2-A 可以看到ZmENA1 蛋白质中二级结构比较丰富,其中 α 螺旋所占比例最高,达到 53.98%,延伸链和不规则卷曲分别占 11.95% 和 28.98%。通过 ExPASy的 SWISS-MODEL 在线工具预测蛋白质三级结构,从图2-B 中也可观察到α 螺旋所占比例较大,与二级结构预测结果吻合,推测该蛋白可能含有 DNA 结合基序。
2.2.3 磷酸化位点分析 通过 ExPASy 的 NetPhos在线工具对蛋白质磷酸化位点进行预测,图3 中可以观察到该蛋白具有 2 个酪氨酸位点,苏氨酸和丝氨酸位点各一个。推测这些位点的磷酸化可能影响ZmENA1 蛋白质的活性。
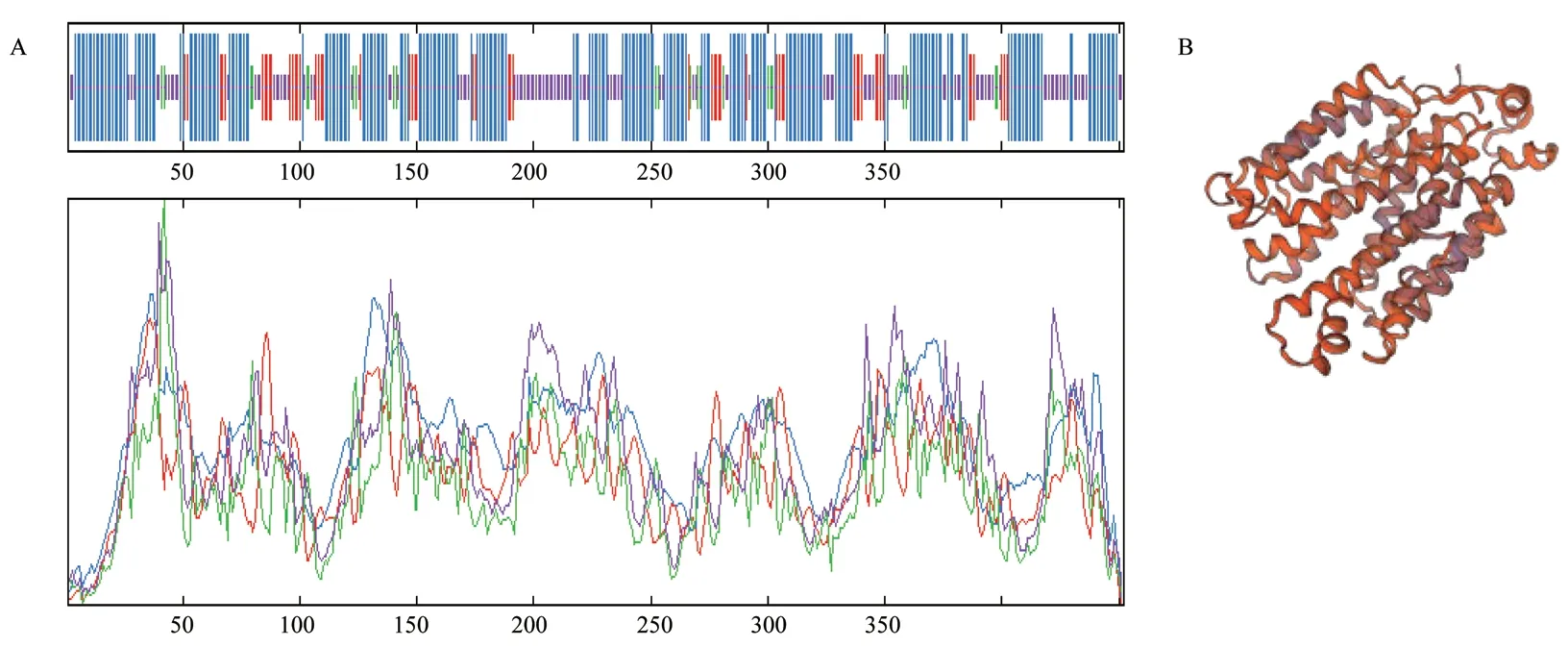
图2 ZmENA1 蛋白的二级和三级结构预测
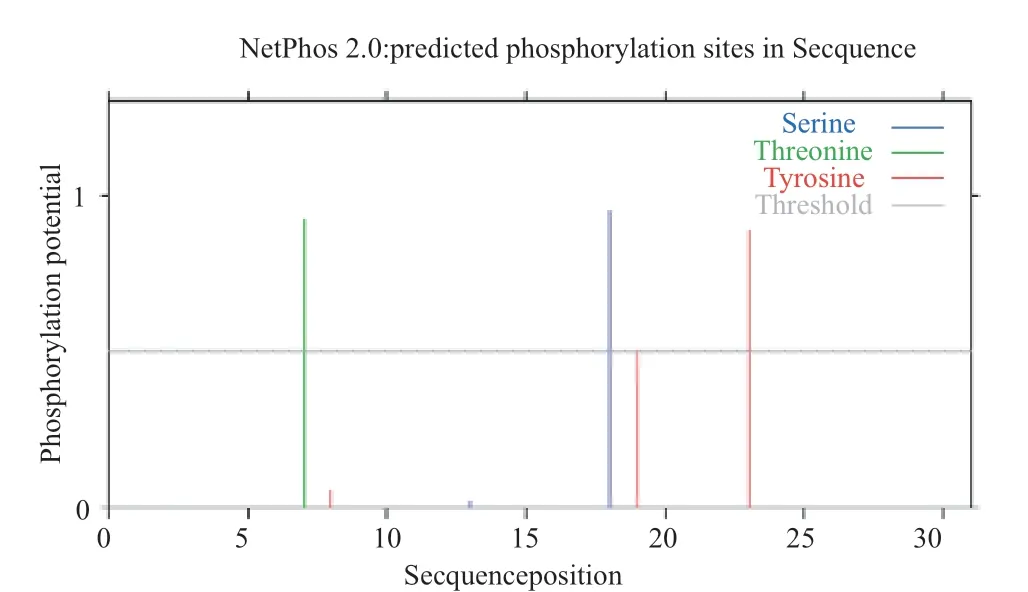
图3 ZmENA1 蛋白磷酸化位点预测
2.2.4 跨膜结构域和信号肽分析 通过 TMHMM Server 2.0 在线分析工具对 ZmENA1 蛋白的跨膜区进行预测,如图4-A 所示,该蛋白存在 10 个跨膜区,并且有一个典型的 MFS(Major facilitator superfamily)家族结构域,属于跨膜蛋白。此外,通过在线工具预测了 ZmENA1 蛋白的信号肽,如图4-B 所示,该蛋白的 N 端具有一个信号肽,推测该蛋白可能定位在细胞膜和某种亚细胞结构上。
2.3 ZmENA1在籽粒发育过程中的表达分析
从图5 可以看出,ZmENA1 在玉米籽粒的发育过程中均有一定的表达,在玉米籽粒的发育前期表达较弱,但在中期有所升高并在 16 DAP 到达峰值,随后其表达量有所降低。此外,ZmENA1 在籽粒发育中后期胚乳和种皮中的表达量高于胚(16 DAP-28 DAP),推测该基因可能参与了金属离子在种皮至胚乳中的运输与储藏。
2.4 ZmENA1在不同金属胁迫下的表达分析
通过培养液中不同金属离子浓度的处理,研究了 ZmENA1 对环境中各个金属元素的应答模式。如图6 所示,高浓度的 Zn、Mn 和 Cd 均会在一定程度上诱导玉米幼苗根中 ZmENA1 的表达,同时也发现缺 Zn 也可诱导根中 ZmENA1 的表达。与此不同的是,缺 Zn 和缺 Mn 均可在一定程度上抑制 ZmENA1在玉米幼苗地上部的表达。此外,缺 Cu 处理早期(24 h和48 h)ZmENA1 的表达在地上和地下部分均下调,但在处理后期(96 h)的地下部其表达再次升高。高浓度的金属离子诱导ZmENA1 在根中表达和低浓度金属离子的地上部抑制表明 ZmENA1 可能对 NA 的转运以及金属的储藏有一定的作用。

图4 ZmENA1 蛋白跨膜区和信号肽预测
3 讨论
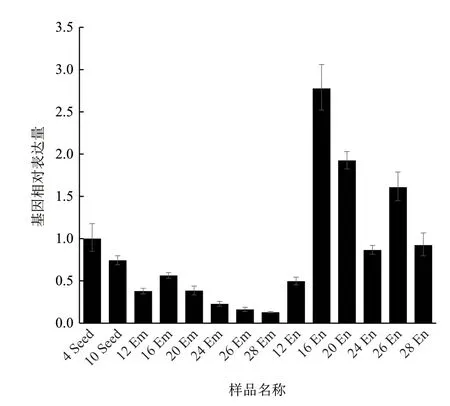
图5 ZmENA1 在籽粒发育过程中的表达
NA 在调节植物体内金属离子的转运方面起着重要作用。前期研究发现,在烟草中持续表达 NAAT造成 NA 含量减少,并导致叶脉间 Fe、Zn、Cu 和Mn 等金属元素的变化[16]。在拟南芥中过量积累 NA会增加植株对 Ni 的耐受性[24]。ENA 是 NA 的转运体,并且在 2019 年发现 OsENA1 主要定位在水稻根系细胞的质膜,同时它也在细胞质的囊泡中存在,推测其对于不同细胞间以及细胞内不同区室间 NA的转运具有重要意义[21]。然而,目前对于 ENA 的研究较少。本研究中克隆了玉米 ZmENA1 基因,其具有一个典型的 MFS 家族结构域,同时含有信号肽以及跨膜区,因此推测 ZmENA1 可能具有在细胞间及细胞内膜系统间转运 NA 的功能。此外,我们发现 ZmENA1 含有潜在的磷酸化位点。已有研究报道蛋白磷酸化可调控蛋白的稳定性或者活性,因而推测 ZmENA1 的稳定性或功能可能受到蛋白磷酸化的翻译后调控[25]。
研究表明 NA 的积累受到环境中各金属元素含量的调控,同时植物体内 NA 含量的变化也影响植物对金属元素的吸收和运输。首先,NAS 的表达以及 NA 的合成可应答于环境中金属元素浓度的变化。小麦中存在的两类 TmNAS 基因在高锌和缺锌条件下表现出不同的表达模式[26];甘蓝在外界缺 Cu 的环境下会导致韧皮部中 NA 含量的增加[27]。其次,调节 NA 的合成也可影响植物对多种金属元素的运输和积累。在水稻、大豆和甘薯中过表达 NAS 以增加 NA 的含量可影响 Zn 含量[28],在烟草或拟南芥中过表达 NAS 均可增加转基因植株对 Ni 的耐受性[24,29]。水 稻 的 黄 色 条 纹 样 蛋 白(YELLOW STRIPE LIKE,OsYSL2)定位于质膜上并可以运输Fe2+-NA 和 Mn2+-NA 复合物,在 OsYSL2-RNAi 转基因植株的胚乳中发现 Fe 和 Mn 含量降低[30]。相似的是,敲除 OsYSL6 导致水稻共质体中 Mn 含量减少以及质外体中 Mn 含量增加,表明 NA 也参与植物体内 Mn的转运[31]。此外,最新的研究发现调节 NA 的分泌也可影响植物器官的发育,且这一影响受到环境 Zn含量的调节。相较于野生型,过表达 OsENA1 的转基因水稻幼苗根长更短且根毛更多,而在高 Zn 环境下则观察不到这一表型[21]。以上研究均表明 NA合成和转运基因的表达会影响植物体内的金属元素含量。
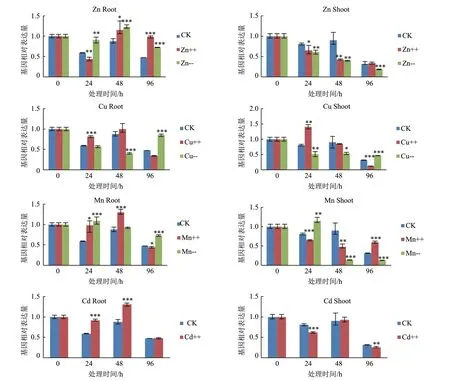
图6 ZmENA1对不同浓度金属元素的响应表达
综上可知 NA 在植物金属元素吸收及转运过程中具有重要作用。因此,本研究针对玉米中介导 NA运输的 ZmENA1 开展研究,在克隆获得该基因的基础上分析在不同环境金属元素条件下 ZmENA1 的表达应答模式,以此推测其调控的 NA 分泌对各种金属元素运输和储存的影响。结果发现高浓度的 Zn、Mn 和 Cd 均可在不同程度上诱导根中 ZmENA1 的表达,推测在金属胁迫下,ZmENA1 通过转运 NA 进入囊泡以促进金属元素在囊泡中的积累,以此缓解细胞毒性。缺 Zn 和缺 Mn 处理可在一定程度上抑制玉米幼苗地上部分 ZmENA1 的表达,由此推测当环境中这些必需金属元素缺乏时,植物可能通过降低 ZmENA1 表达以减少 NA 外排,从而抑制金属元素在各组织中的转运,以此满足在生长发育关键组织中的优先积累。此外,我们还发现缺 Cu 早期整株 ZmENA1 的表达被抑制,而延长处理时间后根中ZmENA1 的表达再次升高,暗示 ZmENA1 对于 Cu的响应机制是复杂的。此外,ZmENA1 在玉米胚以及胚乳和种皮混合物中有一定表达,推测其在籽粒发育过程中金属元素的储藏方面起到一定作用。综上,本研究发现 ZmENA1 的表达可应答于环境中的多种金属元素浓度改变,表明植物体内 ZmENA1 介导的 NA 运输对于调节多种金属元素的平衡十分关键,并且 ZmENA1 作为 NA 的转运体可能参与了胚与糊粉层中的金属元素的运输和储存,但其机制有待深入研究。
4 结论
玉米的 ZmENA1 具有典型的 MFS 保守结构域,属于 MFS 家族蛋白。ZmENA1 在玉米胚乳和种皮混合部分以及在胚中均有一定的表达,推测其可能参与了籽粒发育过程中的金属离子转运。此外,ZmENA1 的表达对环境中 Zn2+、Mn2+、Cu2+以及 Cd2+的不同浓度有一定的响应,推测 ZmENA1在金属离子转运和储存方面发挥了一定的作用。
