多聚甲醛固定对流式细胞术检测人外周血淋巴细胞亚群的影响
2020-11-30杨锐创胡燕屈蒙蒙毕京峰高鸿雁柴燕涛孙慧伟冯帆王志杰邢小燕侯俊解放军总医院第五医学中心临床研究管理中心北京0009锦州医科大学药学院辽宁锦州2000中国医学科学院药用植物研究所北京009
杨锐创,胡燕,屈蒙蒙,毕京峰,高鸿雁,柴燕涛,孙慧伟,冯帆,王志杰,邢小燕,侯俊(.解放军总医院第五医学中心临床研究管理中心,北京0009;2.锦州医科大学药学院,辽宁锦州2000;.中国医学科学院药用植物研究所,北京009)
用流式细胞术(flow cytometry,FCM)检测外周血淋巴细胞亚群已成为临床常见的检查项目。淋巴细胞亚群是监测人体免疫功能的重要指标,对于评价机体的免疫状态、诊断与监测器官移植及免疫病具有重要意义[1-2]。在实验过程中,流式细胞术检测结果可能受多种因素影响。因此,制定规范和标准化的操作流程对提高检测结果的准确性很重要。以往对流式细胞仪检测外周血淋巴细胞亚群影响因素的研究,多在于外周血标本前处理过程中的保存时间、温度、溶血素、刺激剂等[3-8],而对染色后固定剂及固定时间对检测结果的影响研究较少。样本数量过多时,第一管和最后一管标本检测时间间隔过长,可能影响检测结果,因此需要将染色后的细胞进行固定,以确保检测指标的稳定性。此外,标本数量过少时,频繁开关机会造成浪费,通常选择对标本固定后放置一段时间后统一检测[9-10]。因此,本研究针对健康人群外周血标本,选用临床常用的细胞固定剂多聚甲醛(paraformaldehyde,PFA)[11],分析细胞染色后不同浓度PFA及固定不同时间对流式细胞仪检测淋巴细胞亚群结果的影响。
1 资料与方法
1.1一般资料 14份外周血标本均来自健康捐献者,其中男、女各7例,年龄26~38岁,平均32岁。采集健康捐献者外周静脉血5 mL,置于乙二胺四乙酸二钾(EDTA-K2)抗凝管中,颠倒混匀后立即置于样本运送箱中送至实验室,1 h内染色。
1.2仪器与试剂 所有单克隆抗体及鞘液均购自美国BD公司,抗体包括抗CD45-FITC、CD3-APC、CD4-BV421、CD8-PE、CD56-PE-Cy7和CD19-PerCP-Cy5.5抗体。红细胞裂解液为自制NH4Cl裂解液,配制方法为8.3 g NH4Cl、1.0 g KHCO3、0.37 g Na4EDTA溶于800 mL蒸馏水中,以0.2 μm滤膜过滤,调整pH至7.3,用蒸馏水定容到1 000 mL,4 ℃保存待用。FACS Canto Ⅱ流式细胞仪、EDTA-K2抗凝管购自美国BD公司。PFA购自Sigma公司,1% PFA(10 g/L)和4% PFA(40 g/L)用0.1 mol/L磷酸钠缓冲液(PBS,pH7.4)配制,4 ℃保存。
1.3方法 实验分为1% PFA组、4% PFA组、PBS对照组。取EDTA-K2抗凝血100 μL加入Falcon管中,加入5 μL抗CD45-FITC、CD3-APC、CD4-BV421、CD8-PE、CD56-PE-Cy7和CD19-PerCP-Cy5.5抗体,同时设置阴性对照,室温避光20 min。加入2 mL红细胞裂解液,振荡混匀,室温避光5 min,待红细胞完全溶解后,1 500 r/min离心5 min,弃上清液,再加2 mL PBS洗涤2次,弃上清液,最后加入500 μL 1% PFA或4% PFA固定细胞,对照组加入PBS,于4 ℃避光保存于0、4、8、12、24、48和72 h后上机检测。利用前向角散射光(FSC)与侧向角散射光(SSC)设门圈出淋巴细胞,再以CD45+设门圈出CD45+淋巴细胞,再以CD3、CD19设门圈出CD19-CD3+(T细胞)、CD3-CD19+(B细胞),以CD3、CD4设门圈出CD3+CD4+(辅助/诱导细胞),以CD3、CD8设门圈出CD3+CD8+(抑制/细胞毒细胞),以CD3、CD56设门圈出CD3-CD56+(NK细胞)。BD FACSDiva软件获取数据,收集10 000~20 000个细胞,Flowjo10.0软件分析数据,计算不同固定时间(0、4、8、12、24、48和72 h)后CD19-CD3+T、CD3+CD4+T、CD3+CD8+T、CD3-CD19+B、CD3-CD56+NK细胞占淋巴细胞百分比,及CD45、CD3、CD4、CD8、CD19、CD56的平均荧光强度(mean fluorescence intensity,MFI)。

2 结果
2.1PFA浓度对淋巴细胞亚群百分比的影响 流式数据的圈门策略和典型图见图1,细胞分群清晰,数据可用于后续分析。PFA浓度对淋巴细胞亚群百分比的影响见图2。固定8 h后,PBS组出现细胞大量死亡,所以固定8 h后各时间点无PBS对照组结果。与PBS对照组相比,PFA固定0、4、8 h后CD19-CD3+T、CD3+CD4+T、CD3+CD8+T、CD3-CD19+B、CD3-CD56+NK细胞占淋巴细胞百分比差异均无统计学意义(P均>0.05);与1% PFA组相比,4% PFA组固定不同时间后淋巴细胞亚群百分比差异均无统计学意义(P均>0.05)。
2.2PFA固定时间对淋巴细胞亚群百分比的影响 见图3。无论1% PFA或4% PFA,在0~72 h内,固定不同时间CD19-CD3+T、CD3+CD4+T、CD3+CD8+T、CD3-CD19+B、CD3-CD56+NK细胞占淋巴细胞百分比与PBS组比较差异均无统计学意义(P均>0.05)。
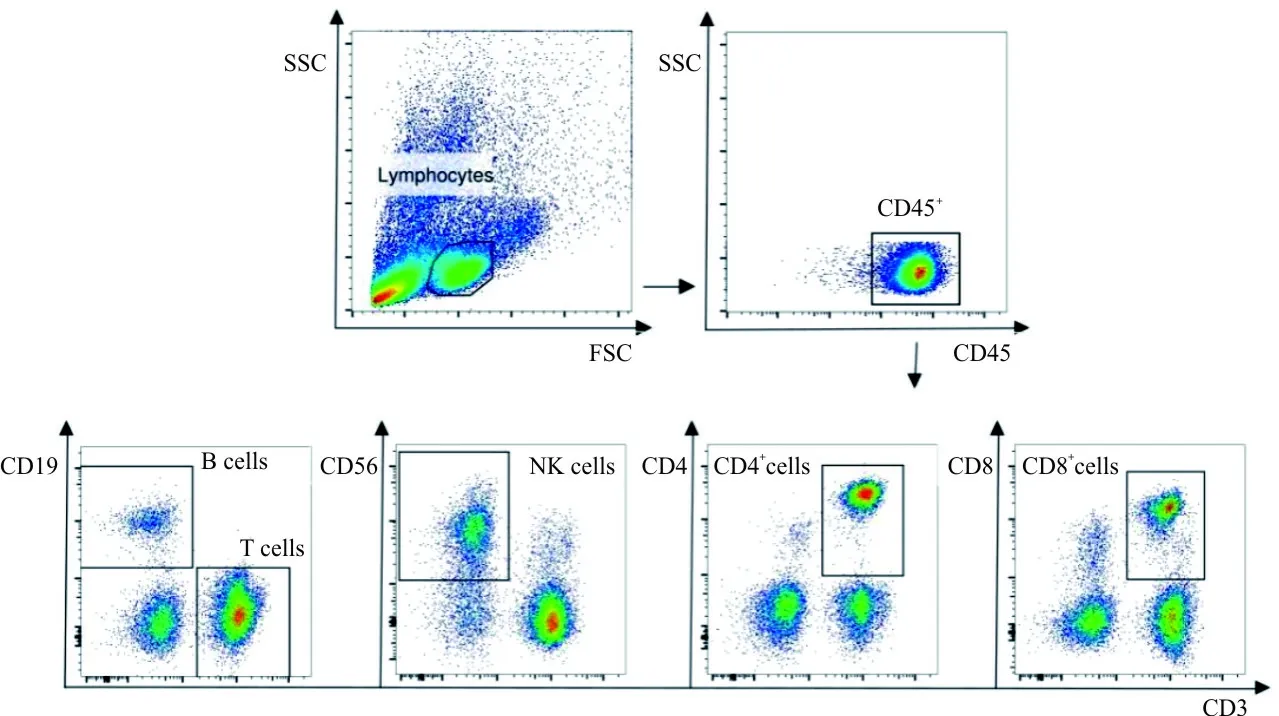
图1 流式细胞术检测人外周血淋巴细胞亚群的圈门策略和典型图

注:A~G,分别固定0、4、8、12、24、48、72 h。

注:A~E,分别为T细胞、CD4+T细胞、CD8+T细胞、NK细胞、B细胞。
2.3PFA浓度对淋巴细胞亚群MFI的影响 见图4。0 h时检测结果显示,4% PFA组CD3、CD8的MFI低于PBS对照组(P<0.05),CD45、CD4的MFI低于PBS对照组(P<0.01);4% PFA组CD3、CD4、CD19的MFI低于1% PFA组(P<0.05),CD45、CD8、CD56的MFI低于1% PFA组(P<0.01)。
固定4 h后,1% PFA组CD4的MFI低于PBS对照组(P<0.05),4% PFA组CD3的MFI低于PBS对照组(P<0.05),4% PFA组CD45、CD4、CD8的MFI低于PBS对照组(P<0.01);与1% PFA组相比,4% PFA组CD3、CD19的MFI低于1% PFA组(P<0.05),CD45、CD4、CD8、CD56低于1% PFA组(P<0.01)。
固定8 h后,1% PFA组CD4的MFI低于PBS对照组(P<0.01),4% PFA组CD19的MFI低于PBS对照组(P<0.05),4% PFA组CD45、CD3、CD4、CD8的MFI低于PBS对照组(P<0.01);与1% PFA组相比,4% PFA组CD3、CD8、CD19和CD56的MFI低于1% PFA组(P<0.05),CD45、CD4的MFI低于1% PFA组(P<0.01)。
固定12 h和24 h后,4% PFA组CD3、CD19、CD56的MFI低于1% PFA组(P<0.05),CD45、CD4、CD8的MFI低于1% PFA组(P<0.01)。固定48 h后,4% PFA组CD3的MFI低于1% PFA组(P<0.05),CD45、CD4、CD8、CD56的MFI低于1% PFA组(P<0.01)。固定72 h后,4% PFA组CD3的MFI低于1% PFA组(P<0.05),CD45、CD4、CD8的MFI低于1% PFA组(P<0.01)。
以上结果提示,PFA浓度对淋巴细胞亚群MFI有影响,PFA固定后MFI下降。固定8 h内,PBS对MFI结果无影响,1% PFA组CD4的MFI下降,4% PFA组CD45、CD3、CD4、CD8的MFI均下降。在72 h的各个观察时间点内,4% PFA组各淋巴细胞亚群的MFI均低于1% PFA组。

注:A~G,分别固定0、4、8、12、24、48、72 h;*,P<0.05;**,P<0.01。
2.4PFA固定时间对淋巴细胞亚群MFI的影响 见图5。固定24 h后的各个时间点,1% PFA组与4% PFA组CD3、CD4、CD8、CD19、CD56和CD45的MFI均下降;尤其CD4的MFI变化较大,1% PFA固定24 h后降低,而4% PFA组在固定4 h后即出现下降趋势。

注:A~F,抗体分别为CD3-APC、CD4-BV421、CD8-PE、CD19-perCP-Cy5.5、CD56-PE-Cy7、CD45-FITC。
3 讨论
临床上常用流式细胞术检测外周血淋巴细胞亚群,以评估患者机体的免疫状态。为避免染色后放置时间过长而导致细胞破碎和抗体荧光淬灭,实际操作中常使用细胞固定剂固定后再上机检测。目前,细胞样本常用的交联剂为PFA,其固定细胞标本不仅可以使检测结果接近细胞表面抗原的真实分布,同时也能延长标本的保存时间。但由于PFA穿透力强,随着甲醛交联蛋白的增加,蛋白质苯环结构上的抗原决定簇的改变有可能降低抗原的敏感性。冯霞等[12]用PFA固定处理人外周血白细胞,流式细胞术检测时发现白细胞表面的P-gp糖蛋白表达降低。孙栋栋等[13]用流式细胞术检测HepG2细胞表面整合素αVβ3,2% PFA固定处理后MFI和阳性细胞率均降低,提示PFA固定可能影响细胞表面抗原抗体的结合。刘云等[14]以小鼠脾淋巴细胞为研究对象,分析2% PFA固定时间对流式细胞术检测小鼠脾淋巴细胞CD3+及CD4+细胞亚群的百分比与MFI的影响,结果发现2% PFA固定24 h后,CD3+、CD4+细胞的MFI降低,但细胞百分比没有明显变化;提示PFA固定时间对抗原表达较强的MFI的影响比其细胞百分比的影响更大。因此,PFA固定浓度、固定时间对抗原结构有无影响尚待进一步研究。
本研究通过对比1%和4%浓度PFA,从0~72 h固定不同时间,FCM检测外周血标本的淋巴细胞亚群百分比及MFI,结果提示在72 h内,PFA浓度及固定时间对外周血淋巴细胞亚群百分比结果没有明显影响,该发现与文献[14]报道一致,进一步证实了对与表达较强的抗原,PFA固定后对抗原表达阳性的细胞百分比影响不大。但PFA固定浓度对淋巴细胞亚群MFI有明显影响,4% PFA固定后淋巴细胞亚群的MFI低于1% PFA固定的样本,且随着固定时间的延长进一步降低。本研究结果提示1% PFA对外周血淋巴细胞CD3、CD4、CD8阳性细胞百分比及MFI的影响较小。
综上所述,流式细胞术检测人外周血淋巴细胞亚群,8 h内检测用PBS进行细胞重悬检测效果最好。细胞染色后若不能立即上机检测,可用1% PFA固定后4 ℃避光保存,建议存放时间不超过12 h。
