miRNA-19a在结肠癌中的表达及对结肠癌细胞增殖活性的影响分析
2020-11-24唐佳月谭淏元
唐佳月 林 勇 谭淏元
结肠癌是世界上最常见的消化道恶性肿瘤之一,发生于结肠部位[1],其发病率高,占胃肠道肿瘤的第3位[2],一旦发生,治愈率低,复发率高,且癌细胞容易发生转移,其病死率也较高,仅次于肺癌和肝癌,在肿瘤中居第3位[3]。至今病因尚未明确,遗传、病史、饮食、年龄、肥胖等因素都有可能导致该病的发生[4],通常男性的发病率高于女性[5]。在过去几十年中,随着人们生活水平的提高,结肠癌发病率也随之上升。因此,通过新的方法治疗结肠癌是十分必要的。微小RNA(miRNA)是真核生物中广泛存在的一种长约21到23个核苷酸的RNA分子[6-7],可在转录水平上调节其他基因的表达[8]。有研究显示[9-10],miRNA与肿瘤的发生发展及其细胞凋亡增殖密切相关,可调节不同的肿瘤过程,如肿瘤的形成、复发及转移。已有研究表明[11-13],miRNA存在于结肠癌中,其中miRNA-17-92家族是miRNA的重要组成部分,同时也是首个被发现的非编码致癌基因家族,该家族包括miRNA-17、miRNA-18a、miRNA-19a、miRNA-19b、miRNA-20a和 miRNA-92a,共6个成员。目前研究表明,miRNA-19a参与多种肿瘤的形成,对多种癌细胞生长起到促进作用,使其凋亡能力降低,可通过调节细胞抑制信号因子抑制肿瘤细胞的增长,在恶性肿瘤的发生发展中发挥了重要的作用[14-15]。本研究通过探讨miRNA-19a在结肠癌中的表达及对结肠癌细胞增殖活性的影响,为今后临床上对结肠癌患者进行诊断和治疗提供参考。现报告如下。
1 材料与方法
1.1 一般资料
选取我院2016 年3月至2017 年3月收治的的结肠癌患者60例作为结肠癌标本,其中结肠癌组织20例,结肠癌旁组织20例,结肠息肉组织20例。在这些患者中男性34例,女性26例,平均年龄(39.75±12.92)岁。所有患者术前皆没有进行针对肿瘤的治疗。术中切除肿瘤后,立即取癌组织与癌旁组织标本(距离肿瘤边缘至少 5cm)。纳入标准:①患者的临床资料完整;②术后病理诊断证实为结肠癌。所有患者对研究内容完全知情,均签署知情同意书。所有样本用液氮冻存。
1.2 材料
结肠癌LoVo细胞购自中国医学科学院,胎牛血清(FBS)、DMEM培养液和混合抗菌药物(青霉素、链霉素)购自Gibco公司,Lipofectamine2000购自美国Invitrogen公司,胰蛋白酶和侵袭小室购自Sigma公司,miRNA-19a模拟物、抑制物购自上海GenePharma公司,人工基质胶购自南方医科大学研究所,CCK8 试剂盒购自上海和元生物公司,RT-PCR试剂盒购自TaKaRa公司碘化丙啶(PI) 试剂盒购自美国BD公司,GAPDH抗体购自Bioworld公司。
1.3 RT-PCR 检测患者结肠癌组织、结肠癌旁组织、结肠息肉组织中miRNA-19a基因的表达
所有组织标本用液氮冻存,从中各取出50 mg,对其进行RT-PCR分析,对其进行提取总RNA并以总RNA的mRNA为模板反转录合成cDNA,在扩增仪上进行RT-PCR。吸取悬浮细胞液,在正反向引物中各加入1 μl。miRNA-19a的引物序:上游序列:5′-CTC TGA CGT TGA ACT GAG CTT TT-3′,下游序列:5′-GCA ATC TGA AAT GCC AAA GTG-3′,扩增目的基因片段长度为126 bp。GAPDH的引物序:上游序列:5′-GGT GGT CTC CTC TGA CTT CAA CA-3′,下游序列:5′-GTT GCT GTA GCC AAA TTC GTT GT-3′,扩增目的基因片段长度为127 bp。将10 μl PCR产物置于2%琼脂糖凝胶电泳,电泳结果用凝胶图像分析系统分析电泳条带吸光度[16],各组实验均重复3次,取平均值。具体步骤严格按照说明书进行操作。
1.4 结肠癌 LoVo 细胞体外培养建立实验模型及分组实验模型
取出冻存于的LoVo细胞,在37 ℃水浴下,轻摇冷冻管,使其充分融化。融化后,放置于无菌操作台中,吸取细胞悬浮液,加入DMEM 培养液,然后加入链霉素和青霉素各100 μg/ml及10%灭活胎牛血清,在37 ℃、5%CO2、湿度饱和条件下进行培养,注意在培养液有变化时更换新鲜培养液[17]。直至胞质回缩、细胞间隙扩大时,加入 DMEM培养液。反复吹打形成单细胞悬液后,在1 000 r/min转速下离心5 min,倒掉上清液。重新接种在新的培养板中,取对数生长期的LoVo细胞为实验细胞,将其铺于6孔板中,即为实验模型[18]。将这些细胞分为转染miRNA-19a模拟物组、转染miRNA-19a抑制物组和空白对照组。具体步骤严格按照说明书进行操作。
1.5 脂质体介导 miRNA-19a转染结肠癌LoVo细胞
取对数生长期的LoVo细胞,在Lipofectamine2000转染试剂下转染等量的miRNA-19a模拟物和miRNA-19a抑制物。转染miRNA-19a模拟物组为5 μl的 miRNA-19a模拟物溶液,加入5 μl的Lipofectamine200转染试剂和2 ml的新鲜培养液,充分混合后室温下转染20 min;转染miRNA-19a抑制物组为5 μl的 miRNA-19a抑制物溶液,加入5 μl的Lipofectamine200转染试剂和2 ml的新鲜培养液,充分混合后室温下转染20 min;空白对照组为2 ml的新鲜培养液静置转染20 min。转染6~8 h后更换新鲜培养液,且均需多次转染,培养1~2 d后即可检测[19]。具体步骤严格按照说明书进行操作。
1.6 检测转染后 miRNA-19a基因的表达
从转染miRNA-19a模拟物或抑制物48 h后的结肠癌LoVo细胞中提取总RNA,并以总RNA的miRNA为模板进行逆转录,在扩增仪上进行RT-PCR,吸取2 μl的悬浮细胞液在正 反向引物中各加入1 μl。miRNA-19a引物序:上游序列:5'-GGA GTT CCT GGA CCA GTA CTT CG-3',下游序列:5'-TTC TTG TGC TTG TGC CAT GTA-3',扩增目的基因片段长度为126 bp;GAPDH引物序:上游序列5'-AGA AGG CTG GGG CTC ATT CAA TG-3',下游序列:5'-AGG GGC CAT CCA CAG TCT CAA TC-3'。扩增目的基因片段长度为127 bp。将10 μl PCR产物置于2%琼脂糖凝胶电泳,电泳结果用凝胶图像分析系统分析电泳条带吸光度[20],各组实验均重复3次,取平均值。具体步骤严格按照说明书进行操作。
1.7 利用 CCK8 试剂盒检测细胞的增殖能力
将各组的细胞的结肠癌LoVo细胞被miRNA-19a转染后,放置于37 ℃条件下含5%CO2的培养箱中,分别测定3组细胞的增殖能力,然后每过12 h给予100 μl/孔的CCK8,在37 ℃、5%CO2的培养箱中培养2 h后,用紫外分光光度计在450 nm波长下对各组的结肠癌LoVo细胞增殖活性进行测量[21],每组实验重复3次,取平均值 。具体步骤严格按照说明书进行操作。
1.8 TUNEL法检测miRNA-19a对细胞增殖周期和细胞凋亡的影响
将各组细胞在2 000 r/min条件下离心5 min,第一次对其加入PBS洗涤2次,之后再离心除去PBS,然后加入1 ml预冷乙醇,在4 ℃的条件下放置一夜,第二天重复操作,即第二次加入含 0.3% Triton 和 50 μg/mlRNaseA的PBS洗涤2次,最后在37 ℃条件下放置30 min后离心,再加入PBS洗涤2次后便可收集。在收集好的细胞中加入700 μl的PI染液,在37 ℃避光条件下染色15 min[22]。取104个细胞用于测定结果,得出细胞增殖周期分布情况。将各组培养好的LoVo细胞接种在6孔板内,采用多聚甲醛固定,然后加入5 μl/片的TUNEL混合液和50 μl的POD转化剂,将各组标本片放置于37℃条件下的湿盒中,在30 min内用PBS冲洗3次,每次5~6 min。然后用中性树胶封片,在光学显微镜下观察,棕黄色的为凋亡细胞核,深蓝色的为未凋亡细胞核[23]。具体步骤严格按照说明书进行操作。
1.9 细胞侵袭小室法检测细胞的体外侵袭力
首先,构建侵袭小室,用5×105个/ml的250 μl细胞悬液,加入铺好基质胶的Boyden 小室的上室,将其置于24孔板中,而下室的每个孔中需加入一定条件下的200 μl培养液,即建立好小室模型[24],随机分组,然后将其置于全培养液中,并在培养液中加入1000 μl10%的FBS,静置2 h后,用胰蛋白酶消化被miRNA-19a模拟物转染的结肠癌LoVo细胞和被 miRNA-19a抑制物转染的结肠癌LoVo细胞,用不含血清的培养液多次洗涤,并用0.1%BSA的全培养基重悬细胞,细胞计数约为2×105个/ml。将小室置于37 ℃条件下含5%CO2培养箱内,1~2 d后取出小室,用工具擦除聚对苯二甲酸乙二醇酯( PET) 膜上表面残留的细胞和基质凝胶,随即用70%甲醇浸泡 PET 膜的下表面,固定30 min,再取出用未结合型苏木精染色10 min。染色后在在高倍光镜下观察,分别对miRNA-19a模拟物转染的结肠癌LoVo细胞和被 miRNA-19a抑制物转染的结肠癌LoVo细胞进行计数,细胞的侵袭力即为计算的平均值[25]。具体步骤严格按照说明书进行操作。
1.10 统计学处理

2 结果
2.1 RT-PCR 检测患者结肠癌组织、结肠癌旁组织、结肠息肉组织中miRNA-19a基因水平比较
患者结肠癌组织中的miRNA-19a水平显著高于结肠癌旁组织和结肠息肉组织,且差异具有统计学意义(P<0.05)。患者结肠旁组织中的miRNA-19a水平显著高于结肠息肉组织,且差异具有统计学意义(P<0.05)。见表1。

表1 患者结肠癌组织、结肠癌旁组织、结肠息肉组织中miRNA-19a基因水平比较
2.2 各组结肠癌LoVo细胞中miRNA-19a基因水平比较
转染miRNA-19a模拟物组miRNA-19a水平显著高于空白对照组和转染miRNA-19a抑制物组,差异具有统计学意义(P<0.05),转染miRNA-19a抑制物组miRNA-19a水平显著低于空白对照组,差异具有统计学意义(P<0.05)。见表2、图 1。

表2 各组结肠癌LoVo细胞中miRNA-19a基因水平比较
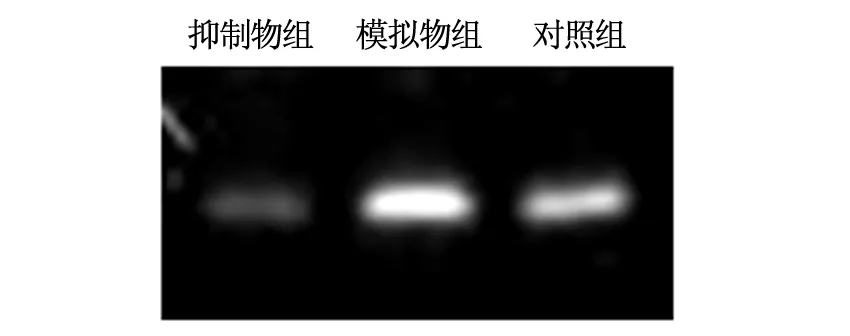
图1 三组miRNA-19a基因的表达
2.3 各组结肠癌LoVo细胞的增殖能力比较
在各组比较中,转染miRNA-19a模拟物组的结肠癌LoVo细胞的增殖能力显著高于空白对照组和转染miRNA-19a抑制物组,差异具有统计学意义(P<0.05),转染miRNA-19a抑制物组的结肠癌LoVo细胞的增殖能力显著低于空白对照组,差异具有统计学意义(P<0.05)。见表3。

表3 各组结肠癌LoVo细胞的增殖能力
2.4 各组结肠癌LoVo细胞的周期分布和凋亡情况比较
三组结肠癌LoVo细胞的增殖情况在G0/G1组间相差不明显,差异不具有统计学意义(P>0.05)。在S期,转染miRNA-19a模拟物组所占比例较其他两组显著升高,差异具有统计学意义(P<0.05),转染miRNA-19a抑制物组和空白对照组比较无明显差异,不具有统计学意义(P>0.05)。在G2/M期,转染miRNA-19a抑制物组所占比例较其他两组显著升高,差异具有统计学意义(P<0.05),转染miRNA-19a模拟物组和空白对照组比较无明显差异,不具有统计学意义(P>0.05)。且转染miRNA-19a模拟物组的结肠癌LoVo细胞的细胞数在S期与G0/G1期、G2/M期比较差异显著,具有统计学意义(P<0.05);其他两组在S期与G0/G1期、G2/M期比较差异不明显,不具有统计学意义(P>0.05)。见表4。
2.5 各组结肠癌LoVo细胞的体外侵袭力比较
转染miRNA-19a模拟物组结肠癌LoVo细胞的体外侵袭力明显高于转染miRNA-19a抑制物组和空白对照组,差异具有统计学意义(P<0.05)。且转染miRNA-19a抑制物组的结肠癌LoVo细胞的体外侵袭力显著低于空白对照组,差异具有统计学意义(P<0.05)。
3 讨论
3.1 RT-PCR 检测患者结肠癌组织、结肠癌旁组织、结肠息肉组织中miRNA-19a基因水平比较分析
患者结肠癌组织中的miRNA-19a水平显著高于结肠癌旁组织和结肠息肉组织,且结肠旁组织中的miRNA-19a水平显著高于结肠息肉组织。由此可知,miRNA-19a在结肠癌患者的癌组织中表达最高,结肠癌旁组织中表达次之,结肠息肉组织中表达最低。因此,可以通过比较miRNA-19a表达水平,来观察结肠组织是否发生病变。

表4 各组结肠癌LoVo细胞数在细胞周期分布情况比较
3.2 各组结肠癌LoVo细胞中miRNA-19a基因水平比较分析
转染miRNA-19a模拟物组miRNA-19a水平显著高于空白对照组和转染miRNA-19a抑制物组,且转染miRNA-19a抑制物组miRNA-19a水平显著低于空白对照组。因此,通过检测各组miRNA-19a基因,可以得知miRNA-19a在结肠癌LoVo细胞中呈现高水平表达。
3.3 各组结肠癌LoVo细胞的增殖能力比较分析
转染miRNA-19a模拟物组的结肠癌LoVo细胞的增殖能力显著高于空白对照组和转染miRNA-19a抑制物组,且转染miRNA-19a抑制物组的结肠癌LoVo细胞的增殖能力显著低于空白对照组。由此可知,miRNA-19a水平与结肠癌LoVo细胞的增殖能力呈正相关关系,即miRNA-19a水平越高,结肠癌LoVo细胞的增殖能力越强。
3.4 各组结肠癌LoVo细胞的周期分布和凋亡情况比较分析
三组结肠癌LoVo细胞的增殖情况在G0/G1组间差异不明显。在S期,转染miRNA-19a模拟物组所占比例较其他两组显著升高,转染miRNA-19a抑制物组和空白对照组比较无明显差异。在G2/M期,转染miRNA-19a抑制物组所占比例较其他两组显著升高,转染miRNA-19a模拟物组和空白对照组比较无明显差异。且转染miRNA-19a模拟物组的结肠癌LoVo细胞的细胞数在S期与G0/G1期、G2/M期比较差异显著,而其他两组在S期与G0/G1期、G2/M期比较差异不明显。由此可知,miRNA-19a水平越高,结肠癌LoVo细胞在S期细胞数增多。
在光学显微镜下观察发现,转染miRNA-19a模拟物组的结肠癌LoVo细胞凋亡情况得到明显改善,细胞凋亡数量较少,凋亡率显著低于转染miRNA-19a抑制物组和空白对照组,而转染miRNA-19a抑制物组的结肠癌LoVo细胞凋亡率显著高于空白对照组。由此可知,miRNA-19a水平与结肠癌LoVo细胞的凋亡能力呈负相关关系,即miRNA-19a水平越高,结肠癌LoVo细胞的凋亡数量越少。
3.5 各组结肠癌LoVo细胞的体外侵袭力比较分析
转染miRNA-19a模拟物组结肠癌LoVo细胞的体外侵袭力明显高于转染miRNA-19a抑制物组和空白对照组,且转染miRNA-19a抑制物组的结肠癌LoVo细胞的体外侵袭力显著低于空白对照组。由此可知miRNA-19a水平与结肠癌LoVo细胞的体外侵袭力呈正相关关系,即miRNA-19a水平越高,结肠癌LoVo细胞的体外侵袭力越强。
