BCA-1通过ErK信号通路促进高糖环境下人脂肪间充质干细胞增殖和迁移
2020-11-21孙石柱王璐璐姚立杰张善强李永涛刘丹阳
孙石柱 王璐璐 姚立杰 张善强 王 冠 李永涛 刘丹阳 沈 雷
齐齐哈尔医学院基础医学院解剖学教研室,黑龙江齐齐哈尔 161006
糖尿病及其并发症已经成为影响社会发展进步的重要慢性疾病[1]。间充质干细胞(mesenchymal stem cells,MSCs)适合糖尿病等造成的多种组织损伤的修复,是公认的细胞治疗领域首选细胞[2]。研究发现,高血糖环境导致MSCs活性降低[3]。脂肪中存在的脂肪间充质干细胞(adipose-derived mesenchymal stem cells,AdMSCs)具有容易获取等特征[4]。如果在高糖环境下促进hAdMSCs增殖或迁移能力的提高,将有利于hAdMSCs在再生医学的应用。
B淋巴细胞化学引诱物-1(B-lymphocyte chemical attractants-1,BCA-1)对肿瘤细胞具有很好的促进增殖作用,还具有抗免疫、招募肿瘤细胞归巢的效果[5]。研究发现,MSCs具有很低的免疫原性,并能逃避宿主免疫系统监视[6],BCA-1可能对MSCs也发挥逃避免疫的作用。研究发现BCA-1可以促进MSCs分化为成骨细胞[7],说明MSCs表面有BCA-1的相应受体。虽然缺氧环境下BCA-1能够促进人骨髓间充质干细胞的增殖或自噬[8],但是在高糖环境下的相关研究还鲜见报道。
本实验在细胞高糖模型下,观察BCA-1刺激的hAdMSCs增殖和迁移的情况,并揭示其作用的分子机制,为hAdMSCs在组织工程或再生医学的进一步应用奠定研究基础。
1 材料与方法
1.1 一般材料
人脂肪间充质干细胞(广州赛业生物科技有限公司);人BCA-1重组蛋白和人VEGF蛋白ELISA试 剂 盒(美 国R&D公 司);PD98059(Cell Signaling公司);细胞增殖试剂盒(CCK8,日本同仁公司);α-MEM培养基、胎牛血清(fetal bovine serum,FBS,美国Thermo Fisher公司);多聚甲醛、结晶紫和葡萄糖(上海生工公司);青-链霉素、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、RIPA细胞裂解液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(上海碧云天生物科技公司);小鼠抗人PI3K抗体、小鼠抗人MAPK抗体、小鼠抗人GAPDH抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠IgG(英国Abcam公司)。Bio-Rad 550酶标仪(Bio-Rad公司);BX50型显微镜(日本Olympus公司)。
1.2 方法
1.2.1 细胞培养和细胞高糖模型 含10%FBS,1μmol/L青霉素和100U/mL链霉素的α-MEM培养基培养hAdMSCs者为hAdMSC基础培养基。hAdMSC基础培养基中含30mmol/L葡萄糖则为hAdMSC高糖培养基。以此培养细胞则为细胞高糖模型[9]。
1.2.2 实验分组 细胞高糖模型下:培养的hAdMSCs为高糖对照组,50μmol/L浓度BCA-1刺激hAdMSCs为高糖BCA-1组,若在hAdMSCs中预先用含100nmol/L的PD98059培养30min,然后再添加50μmol/L BCA-1,则为高糖Erk抑制剂组,正常环境下培养的hAdMSCs为正常对照组。
1.2.3 CCK8实验 按上述hAdMSCs分组情况,将0.9×104/孔 hAdMSCs接 种 于96孔 板,100μL的hAdMSCs高糖培养基培养48h,每孔加入10μL CCK8,37℃,5%CO2培 养4h,使 用Bio-Rad 550酶标仪,在450nm波长测定样品吸光度值(absorbance value,A值)。
1.2.4 Transwell细胞迁移实验 1×104/室hAdMSCs置于Transwell细胞小室内,下层腔室按照实验分组添加不同试剂或无血清培养基,37℃,5%CO2培养12h后,收集下室液体,800s/min离心5min,收集细胞,并计数穿过细胞小室的hAdMSCs数目(计为a);擦 除Transwell细 胞 小 室 内hAdMSCs,4%多聚甲醛溶液固定,0.5%结晶紫染色,Image-Pro Plus 6.0.1软件计算hAdMSCs被结晶紫染色的细胞数目(计为b)。计算hAdMSC迁移率=[(a+b)/1×104]×100%[10]。
1.2.5 ELISA 4.5×106各组hAdMSCs,按照hAdMSC分组情况,37℃,5%CO2,以含1% FBS的hAdMSC高糖培养基继续培养24h,收集各组hAdMSCs细胞上清液,人VEGF-ELISA试剂盒检测VEGF含量。
1.2.6 Western blot实验 按照hAdMSCs分组情况,培养每组5.5×106hAdMSCs,加入RIPA细胞裂解液及1mmol/L PMSF,4℃,12000r/min,离心5min;BCA法测定蛋白浓度。40μg各组蛋白样品,100V电泳90min;300mA转至硝酸纤维素薄膜40min;封闭液中封闭60min;添加小鼠抗人PI3K抗体(1∶550)、小鼠抗人MAPK抗体(1∶700)、小鼠抗人GAPDH抗体(1∶900);4℃孵育12h,使用HRP标记山羊抗小鼠IgG(1∶350),室温孵育60min;洗膜后,增强化学发光剂(enhanced chemiluminescent agent,ECL)等步骤检测蛋白表达条带,Image-Pro Plus 6.0.1软件分析各蛋白条带的相对表达量[11]。
1.3 统计学分析
实验数据采用SPSS 21.0统计学软件进行统计分析。计量资料以()表示,组间比较进行方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 BCA-1促进hAdMSCs增殖
高糖对照组hAdMSCs的A值是正常对照组的0.59倍;相对于高糖对照组,高糖BCA-1组hAdMSCs增殖A值升高1.52倍,差异有高度统计学意义(P<0.01);高糖Erk抑制剂组hAdMSCs的A值是高糖BCA-1组的0.71倍,差异有高度统计学意义(P<0.01),见图1。

图1 CCK-8法检测BCA-1对hAdMSCs增殖的A值
2.2 BCA-1促进hAdMSCs迁移
高糖对照组hAdMSCs迁移率是正常对照组的0.35倍;高糖BCA-1组hAdMSCs迁移率是高糖对照组的1.78倍,差异有统计学意义(P<0.01);高糖Erk抑制剂组hAdMSCs迁移率是高糖BCA-1组0.79倍,差异有高度统计学意义(P<0.01),见图2。
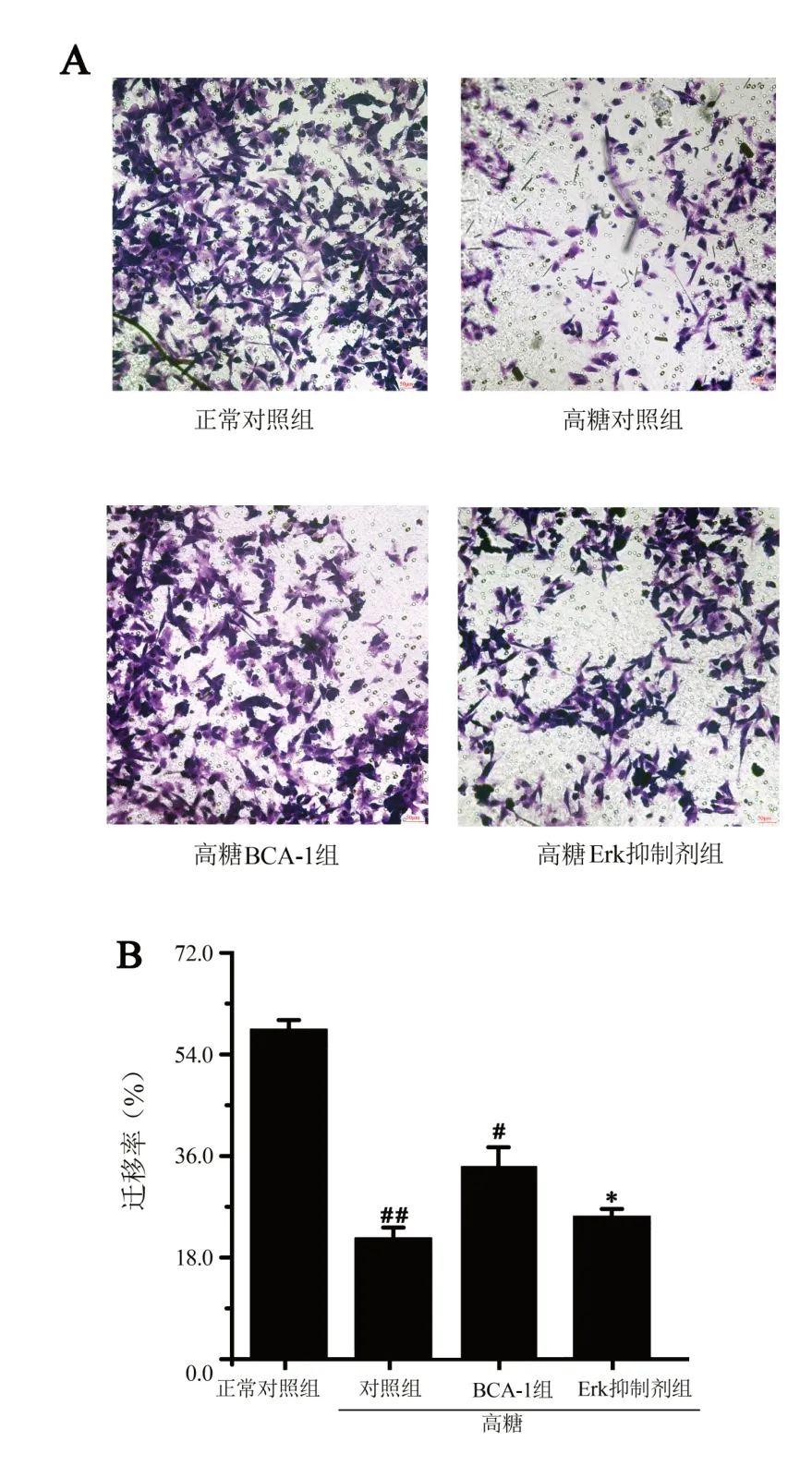
图2 Transwell细胞迁移实验检测BCA-1对hAdMSCs迁移的影响
2.3 BCA-1促进hAdMSCs中PI3K、MAPK蛋白表达
细胞高糖条件下,各组hAdMSCs的PI3K、MAPK蛋白相对表达量的组间比较差异均有高度统计学意义(P<0.01);高糖Erk抑制剂组hAdMSCs的PI3K蛋白和MAPK相对表达量分别是BCA-1组的0.49倍和0.46倍,差异有高度统计学意义(P<0.01),见图3。
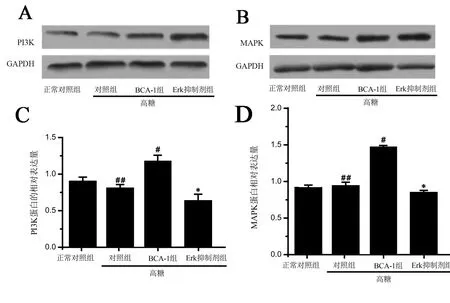
图3 Western blot检测BCA-1对hAdMSC的PI3K、MAPK蛋白表达的影响
2.4 BCA-1促进hAdMSCs表达VEGF蛋白
高糖对照组VEGF蛋白是正常对照组的1.87倍,差异有高度统计学意义(P<0.01)。高糖BCA-1组VEGF蛋白是高糖对照组的2.51倍,差异有高度统计学意义(P<0.01);高糖Erk抑制剂组VEGF蛋白含量是高糖BCA-1组hAdMSCs的0.35倍,差异有高度统计学意义(P<0.01),见表1。
3 讨论
脂肪组织是分布于人体比较广泛的结缔组织。研究发现,脂肪组织含有多分化性能,参与组织再生修复能力的细胞为脂肪间充质干细胞(human adipose-derived mesenchymal stem cells,hAdMSCs)。hAdMSCs获得比较容易,含量丰富,在骨和软骨、心血管损伤修复等领域起到“种子细胞”的作用[4]。高血糖会抑制宿主细胞生物活性,导致MSCs等细胞出现低增殖、迁移能力下降、能量代谢障碍等问题,不利于组织再生修复。如果在高糖环境下提高MSCs增殖或归巢等能力,将对保护MSCs,移植MSCs发挥组织再生功能形成新策略。
表1 BCA-1促进hAdMSCs表达VEGF蛋白(±s,pg/mL,n=24)

表1 BCA-1促进hAdMSCs表达VEGF蛋白(±s,pg/mL,n=24)
注:与正常对照组比较,##P<0.01;与高糖对照组比较,#P<0.01;与高糖BCA-1组比较,*P<0.01
指标 正常对照组 高糖对照组 高糖BCA-1组 高糖Erk抑制剂组VEGF 0.33±0.19 0.62±0.10## 1.57±0.64# 0.61±0.42*
趋化因子是具有调节细胞增殖、分化、促进细胞归巢能力的肽类家族[12]。B淋巴细胞化学引诱物(BCA-1)与基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)的分子结构类似,同属于趋化因子家族中的CXC亚科[13]。BCA-1具有炎症介质作用,又称为趋化因子13(CXCL-13),BCA-1与细胞表面趋化因子受体5(CXCR5)结合,除了对损伤组织周围MSCs等细胞具有招募作用外,还能促进MSCs等干细胞旁分泌VEGF等因子,在伤口愈合中有重要意义[14]。
本实验在细胞水平发现,高糖对照组hAdMSCs增殖A值低于正常对照组,这是由于高浓度葡萄糖会干扰线粒体能量合成或释放,细胞内产生大量活性氧等氧自由基,多余的氧自由基则会干扰细胞内呼吸链,形成恶性循环而导致细胞增殖能力降低[15]。添加50μmol/L的BCA-1后,hAdMSCs增殖A值升高,提示BCA-1可促进细胞增殖,对维持细胞抗高糖性损伤具有积极意义。报道发现,BCA-1能 促 进MSCs成 骨 分 化[16],说 明MSCs膜上有BCA-1的相应受体。因此,本实验没有利用PCR等实验技术观察MSCs表面的BCA-1受体,但是通过BCA-1促进细胞增殖能力的提高,提示BCA-1能够结合hAdMSCs表面的相应受体。
临床观察到慢性关节炎的关节囊滑膜层结缔组织中会显著表达BCA-1蛋白,并发现在高表达的BCA-1周围,白细胞、巨噬细胞等细胞集中分布,说明BCA-1能够招募白细胞、巨噬细胞等免疫性细胞归巢和增殖,造成局部炎症反应[17]。本实验也发现,50μmol/L BCA-1均会导致hAdMSCs迁移率增加,随着BCA-1浓度的增加,hAdMSCs迁移率逐渐升高,说明BCA-1作用于hAdMSCs表面的受体,不仅能促进hAdMSCs分化或增殖,更能够招募hAdMSCs归巢。这与乳腺癌等恶性肿瘤细胞较快生长,易造成局部形成乏氧环境。乏氧环境的肿瘤细胞分泌BCA-1不仅能发挥抑制宿主免疫监视、逃避免疫的作用,更能促进肿瘤细胞增生、迁移的研究结果相一致[18]。BCA-1抑制宿主免疫监视,招募hAdMSCs归巢到肿瘤组织,hAdMSCs是否受到肿瘤微环境的影响分化为血管内皮细胞或肿瘤干细胞,促进肿瘤发生或转移[19],还需要深入探索。
糖尿病患者的高血糖环境会导致小血管、线粒体病变,形成细胞或组织乏氧状态。本实验发现在高糖条件下BCA-1组hAdMSCs增殖活性提高的现象与学者在肿瘤细胞、炎症细胞的研究结果基本一致[19]。添加了Erk抑制剂的各组hAdMSCs增殖能力相应降低,提示细胞外信号调节激酶(extracellular signal regulated kinases,Erk)信号通路可能在BCA-1对hAdMSCs的作用中起到一定作用。PD98059抑制了Erk蛋白后,hAdMSCs细胞增殖能力降低,同时下游MAPK蛋白表达明显降低,这可能是由于BCA-1结合在hAdMSCs表面的CXCR5受体,激活了PI3K蛋白激酶,上调Erk激酶,再活化下游的MAPK蛋白,最后启动VEGF蛋白的分泌。VEGF能够反作用于hAdMSCs,促使细胞抵抗高糖损伤,维护细胞生物活性[20]。研究表明,BCA-1能激活Erk通路,促进乳腺癌MCF-7细胞移植的小鼠肿瘤模型的肿瘤体积增大,乳腺癌细胞增殖和血管新生,加速肿瘤的血管转移[21]。本研究也不排除BCA-1可能还具有激活NF-κB诱导激酶(NF-κB induced kinase,NIK)信号通路等作用[22],与BCA-1有关的相关分子机制还需要借助分子生物学、动物模型等实验进行深入验证。
综上所述,在高糖环境中,BCA-1结合hAdMSCs表面受体,激活细胞内PI3K-Erk-MAPK信号通路,促进hAdMSCs旁分泌VEGF蛋白,发挥了保护hAdMSCs抗高糖损伤的效果。
