TiO2 / 大理石复合光催化剂制备及性能研究
2020-11-10戴煜郭厦蕾陈典卢金山
戴煜, 郭厦蕾, 陈典, 卢金山
(南昌航空大学材料科学与工程学院,江西 南昌 330063)
大理石是一种石灰岩,其颜色花纹丰富,可加工成各种形材、板材用于建筑工程装修[1]。近年来,中国基础建设高速发展,大规模利用大理石原料。在此过程中产生的大量废料造成了一系列环境问题[2]。大理石废料改善砂浆性能,替代石灰石煅烧硅酸盐水泥熟料及用作一种天然廉价的CO2捕获剂等方式能在一定程度上减少浪费,减轻环境负面影响,促进石材加工业可持续发展[3-5]。
光催化技术在处理有机污染方面具有极强优势。半导体材料在外界光源照射下会产生具有强氧化性的自由基。强氧化性自由基将有毒有害有机污染物氧化降解成CO2、水以及其他无毒无害的产物[6]。二氧化钛是一种性能优良的光催化剂,可以降解大多数有机污染物。以TiCl4为原料,用Ag 或氟化物包覆通过溶胶- 凝胶法制备的金红石型TiO2,将所得产物分别对草酸铵结晶紫染液进行紫外光催化,污染物降解率分别达到82.1% 和97.3%[7]。将含有AgNO3、表面活性剂和锐钛矿型TiO2的水溶液混合后加入还原剂NaBH4,超声辅助合成Ag/TiO2粉体,对布洛芬溶液进行超声- 紫外复合光催化,污染物降解率达95%[8]。用钛酸四乙酯和3-氨丙基三甲氧基硅烷制得改性纳米TiO2后,用银包覆改性纳米TiO2,所得复合材料经500 ℃煅烧后对亚甲基蓝溶液进行紫外光催化,污染物降解率达95%[9]。
研究表明,TiO2/ 石墨烯和TiO2/Fe3O4复合材料比表面积大,溶液分散性好及光催化稳定性优良,具有较好光催化效果[10]。但石墨烯和纯Fe3O4价格昂贵,应用受限。大理石矿物废料价格低廉,可替代石墨烯或Fe3O4作为TiO2的载体。印染行业是排放工业废水的大户,废水中包含罗丹明 B、茜素绿(AG)、对硝基苯酚(PNP)、亚甲基蓝等有机颜料[11]。选用亚甲基蓝作为典型有机污染物来研究TiO2/ 大理石复合材料的光催化性能。本文采用醇盐水解法制备TiO2/ 大理石复合材料,保持TiO2/ 石墨烯和TiO2/Fe3O4复合材料优良溶液分散性和光催化稳定性的同时,又提高了实际应用的可能性。为大理石废料回收利用提供了一条新途径,为制备低成本复合光催化剂提供了理论基础。
1 试 验
1.1 原料与试验设备
原料:米黄色大理石粉体(取自大理石板材加工厂)。
试剂:钛酸四正丁酯(分析纯)、氢氧化钠(分析纯)、正硅酸乙酯(化学纯)和乙酸(分析纯)。
试验设备:XQM 行星球磨机,1001A ~ 1E 鼓风干燥箱,JB90-S 型数显电动搅拌机,HJ3 数显恒温磁力搅拌器,KYZ1515x蠕动泵,紫外灯(Philips HPL-N125W/542),200 mL水冷夹层光催化反应器,WFZ-26A 紫外可见分光光度计。
1.2 TiO2 / 大理石包覆粉体的制备
将大理石废料放入球磨罐内,以水为介质,加入氧化锆研磨球,水粉质量比9:1,球/ 粉质量比10:1,用行星球磨机以360 r/min球磨22 h。用40目筛网分离研磨球与球磨样品,之后抽滤清洗,120 ℃干燥2 h 过筛,得到纳米大理石粉体。称取4.5 g球磨后纳米大理石粉体分散于pH=10的120 mL氢氧化钠溶液中,配成悬浮液A;称取1.87 g 正硅酸乙酯溶于30 mL 乙醇中,配成溶液B。溶液B由蠕动泵缓慢滴入磁力搅拌中的溶液A,滴加完成后升温至90 ℃搅拌1 h,经离心、洗涤、干燥及500 ℃煅烧后得到改性大理石粉体。将改性的大理石粉体分散于120 mL 蒸馏水中,配成悬浮液C。称取7.65 g 钛酸四正丁酯溶于30 mL 乙醇中,配成溶液D。溶液D 由蠕动泵缓慢滴入磁力搅拌条件下溶液C 中,滴加完成后升温至90 ℃搅拌2 h,经离心、洗涤、干燥及以不同温度煅烧后得到TiO2/ 大理石复合材料。
1.3 粉体表征与光催化性能测试
利用X 射线衍射仪(XRD,D8 ADVANCE,德国)分析复合材料晶体结构,场发射扫描电子显微镜(FESEM,Quanta 200,美国)观测大理石粉体形貌,透射电子显微镜(TEM,JEM~2010,JEOL)观测复合材料形貌,能谱仪(EDS,INCA 250 X-Max 50,英国)分析复合材料化学组成,傅里叶红外光谱仪分析TiO2晶型。
使用光催化反应器研究复合材料的光催化性能,试验过程中使用1.5 g 复合材料粉体,150 mL亚甲基蓝溶液(93.5 mg/L),在紫外灯照射下进行连续磁力搅拌,每隔一定时间,移取 2 mL 溶液,静置后取上层清液,利用紫外可见分光光度计测定溶液在660 nm 处的吸光度,根据朗伯-比尔定律计算溶液中亚甲基蓝浓度,通过亚甲基蓝降解率随紫外光照时间变化的曲线研究复合材料的光催化性能。
2 结果与讨论
2.1 粉体形貌表征
图1 是球磨大理石粉体FESEM 照片和TiO2/大理石复合材料粉体TEM 照片。见图1(a)。


图1 球磨大理石粉体FESEM 照片(a)和TiO2 / 大理石复合材料粉体TEM 照片(b)Fig .1 The FESEM photo of ball milled marble powder (a) and TEM photo of TiO2/marble composite powder (b)
大理石粉体颗粒呈较规则块状,表面光滑有棱角。从图1(b) 可看出,TiO2/ 大理石复合材料粉体颗粒仍呈块状,与大理石粉体颗粒形貌相似,粒度略微增大,表面覆盖一层均匀致密纳米TiO2颗粒。
TiO2/ 大理石复合材料粉体能谱分析(EDS)结果见表1。
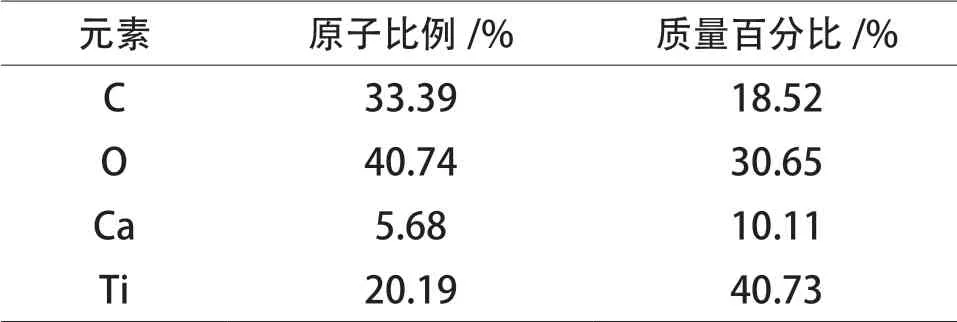
表1 TiO2 / 大理石复合材料粉体EDS 结果Table 1 The EDS results of TiO2/marble composite powder
表1 中,C 元素、O 元素和Ti 元素占比较大,Ca 元素占比相对较小,说明TiO2已包覆于大理石粉体表面。C 元素与Ca 元素原子比例大于 CaCO3理论比例(1:1),表明 C 原子过量,可能是颗粒表面残留着钛酸四正丁酯水解产生的有机基团。TEM 和EDS 结果表明:TiO2/ 大理石复合材料粉体具有核(CaCO3) 壳(TiO2) 结构特征,TiO2均匀致密地包覆在大理石粉体表面。
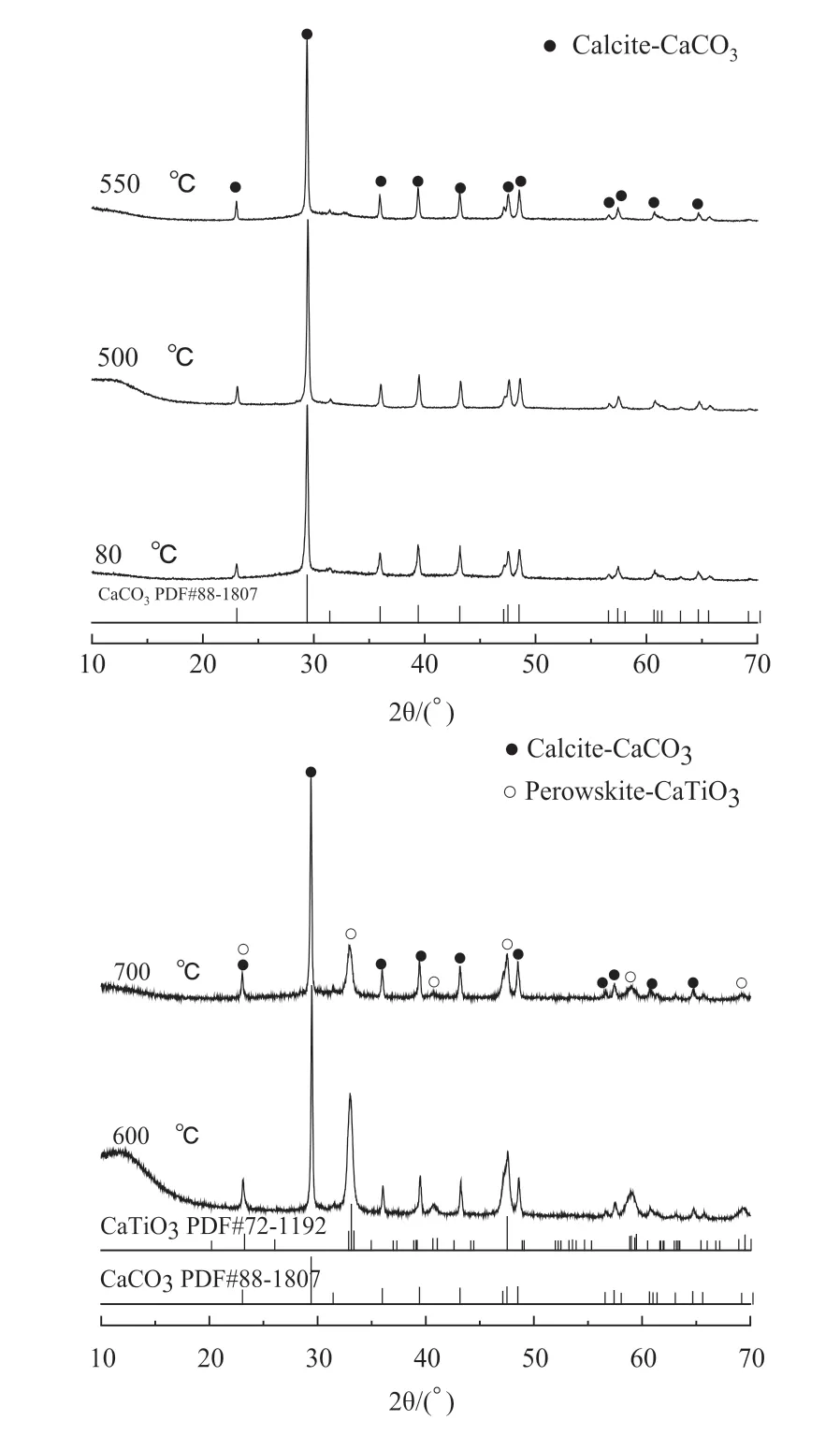
图2 不同温度下煅烧时TiO2 / 大理石复合材料粉体XRD 图谱Fig .2 The XRD results of TiO2/marble composite powder calcined at different temperatures
图2 是经不同温度煅烧所得TiO2/ 大理石复合材料粉体的XRD 图谱。由图2 可知,2 θ =29.4°的特征衍射峰对应于CaCO3(104)晶面,除了特征衍射峰外,在22 θ =23.1°、36°、39.4°、43.2 °、47.5 °、48.5 °、56.6 °、57.4 °、61.4 °和64.7°分别对应CaCO3( 方解石,JCPDS 88-1807) 的 (012)、(006)、(110)、(113)、(202)、(018)、(116)、(211)、(122)、(119) 和(300) 衍射晶面,其衍射峰较强且峰型尖锐,表明TiO2/ 大理石复合材料粉体中CaCO3结晶度较高。
在研究不同煅烧温度对光催化性能影响的过程中,意外发现, 600℃及700℃煅烧的粉体在2 θ =23.3°、33.1°、40.6°、47.5°、59.0°、69.5°出现的衍射峰分别对应CaTiO3(JCPDS 72-1192) 的(101)、(121)、(022)、(202)、(042)、(242) 晶面衍射峰,表明有钙钛矿生成。
由EDS 测试结果及XRD 测试结果(600℃煅烧开始有CaTiO3生成)可知,TiO2确实包覆在大理石表面,但XRD 检测中并未出现TiO2的相应峰。研究表明:105 ℃干燥的纳米TiO2主要为锐钛矿相,衍射强度很弱,结晶性非常差[12]。钛酸四正丁酯水解产生钛酸和丁醇,部分丁醇会吸附在纳米TiO2表面,阻碍纳米TiO2颗粒进一步生长[13]。导致纳米TiO2颗粒尺寸小,表面效应趋于明显,晶体内部有序度非常低。尽管之后经过高温煅烧,但TiO2晶粒长大并趋于有序化的程度有限,且包覆在大理石粉体表面的纳米TiO2颗粒体积含量过低,所以XRD 峰并不明显。
2.2 复合材料粉体结构及光催化性能
2.2.1 热重- 差热(TG-DTG) 分析
利用热重- 差热技术分析TiO2/ 大理石复合材料粉体中残留的有机物及TiO2晶型,结果见图3。
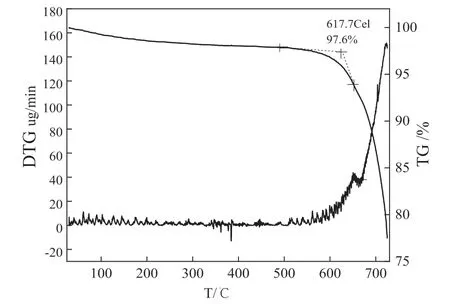
图3 TiO2 / 大理石包覆粉体TG-DTG 曲线Fig .3 The TG-DTG results of TiO2 /marble composite powder
DTG 曲线500 ℃到670 ℃之间的波峰表明:该温度区间内有化学物质发生了改变,TiO2晶型由锐钛矿相逐渐转变为热力学稳定的金红石相[14]。从TG 曲线可以看出,样品经历了两次失重过程,25 ℃到500 ℃的失重主要由物理吸附水的挥发及残留有机物的分解造成,样品于600 ℃到700 ℃经历了明显的失重过程,总失重量约为22.5%,这与大理石中CaCO3热分解有关。大理石与TiO2发生固相反应生成CaTiO3的热力学条件为T>145.95 ℃,从化学反应动力学角度分析,当温度高于370 ℃时,TiO2与CaCO3开始发生固相反应生成CaTiO3,温度为798.35 ℃时,应能强烈进行[15]。已有研究表明,CaCO3从600 ℃开始分解生成CaO,热分解速率随温度上升而迅速增大,在750 ℃时完全分解成氧化钙,对于纳米碳酸钙,热分解温度又有一定程度降低(约50 ℃左右)[16]。1400 ℃下通过固相反应合成钙钛矿是指用常规原料粉体(微米级)[17]。对于纳米粉体原料,尤其是包覆粉体而言,由于颗粒尺寸细小,表面能和化学活性高,原料组分均匀混合,固相反应温度完全可能大幅度降低,600 ℃煅烧样品的XRD 谱图也已表明形成CaTiO3晶相。
2.2.2 傅里叶变换红外光谱
80 ℃干燥和600 ℃煅烧的TiO2/ 大理石复合材料粉体红外光谱见图4。
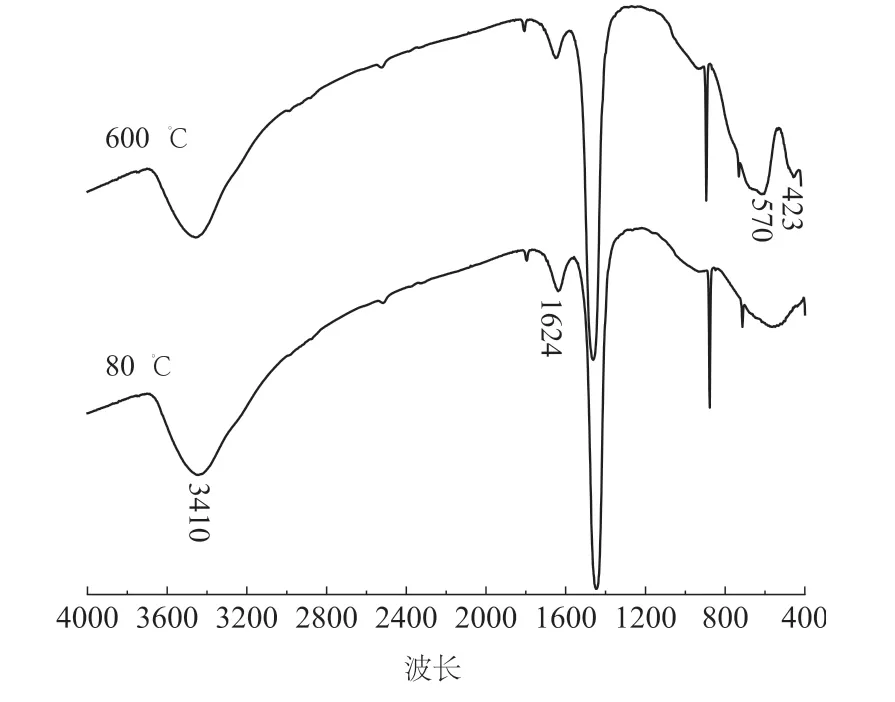
图4 不同温度下TiO2/ 大理石复合材料粉体FT-IR谱图Fig.4 The FT-IR results of TiO2/marble composite powder calcined at different temperatures
粉体中含有大量有机官能团,3410 cm-1对应羟基振动吸收峰, 1624 cm-1对应羧基振动吸收峰,Ti-O键伸缩振动吸收范围在400 ~ 700 cm-1之间[18],570 cm-1对应CaTiO3 吸收峰[19]。423 cm-1对应金红石型 TiO2的 Ti -O 键特征振动带吸收峰[20]。研究表明,450 ℃以下煅烧样品仅形成低结晶度锐钛矿,550 ℃煅烧时出现锐钛矿相和金红石混合相[21]。FT-IR 测试结果表明未煅烧的TiO2/ 大理石复合材料粉体中TiO2为锐钛矿相,而经600 ℃煅烧的TiO2/ 大理石复合材料中部分TiO2已由锐钛矿转变为金红石[22]。
2.3 光催化性能
利用紫外可见分光光度计研究TiO2/ 大理石复合材料光催化性能,测试结果见图5。
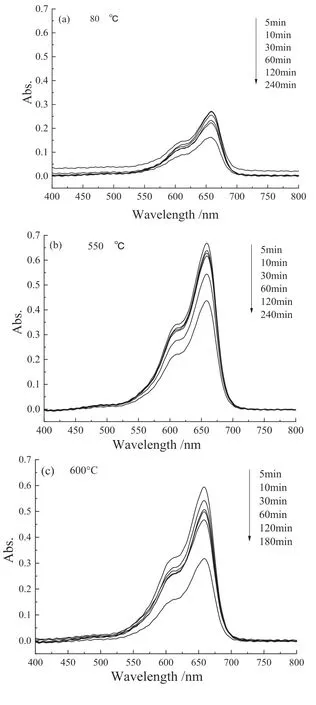
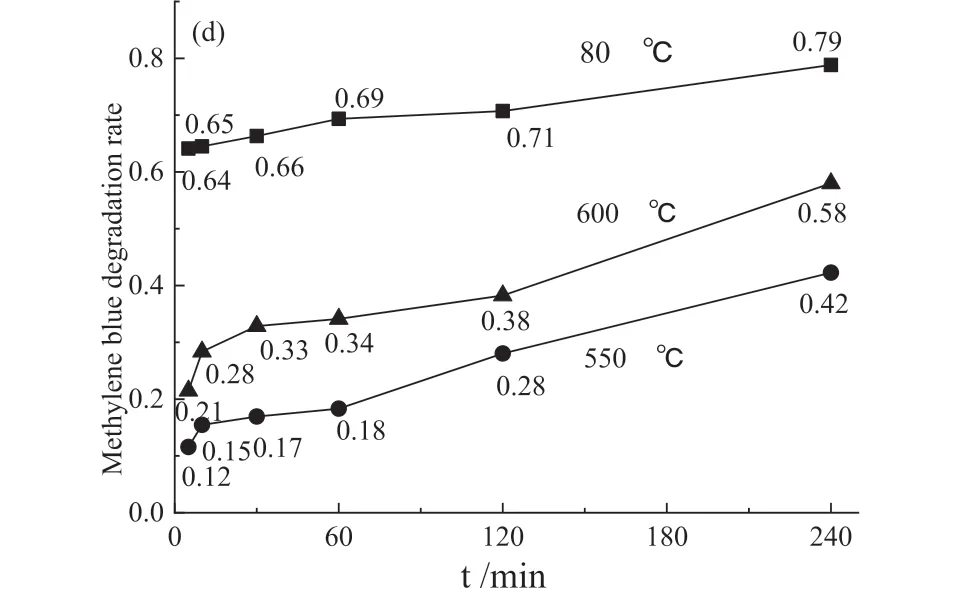
图5 亚甲基蓝溶液的紫外可见吸收光谱(a-c)以及亚甲基蓝降解率变化曲线(d)Fig .5 The UV-visible absorption spectrum of methylene blue solution (a-c) and methylene blue degradation rate(d)
不同温度煅烧的TiO2/ 大理石复合材料紫外光催化降解亚甲基蓝效果随光照时间延长都有不同程度的提高。亚甲基蓝染料分子被紫外光激发,激发的电子注入TiO2导带,染料分子中产生空穴,空穴与水或氢氧根反应生成氢氧自由基;紫外灯照射引发TiO2/ 大理石复合材料中TiO2的电子-空穴对分离,进而氧化降解有机物。染料敏化与光催化共同作用导致染料降解[23]。
钛酸四丁酯水解生成的锐钛矿型TiO2包覆于大理石粉体表面,锐钛矿型TiO2(3.23eV) 禁带宽度大于金红石型TiO2(3.02 eV),锐钛矿型TiO2有更好的光催化性能[24-25]。80 ℃干燥的TiO2/ 大理石复合材料光催化性能最好,催化降解亚甲基蓝染料废水三小时,亚甲基蓝降解率达78.9%(图5 d)。煅烧温度升高,TiO2晶粒长大且晶体结构趋于有序化,锐钛矿会转变为金红石。通常亚稳态锐钛矿在超过600 ℃煅烧后会转变为热力学稳定的金红石[26]。金红石晶型更完整,表面缺陷更少,降低了TiO2/ 大理石复合材料的光催化活性,因此550 ℃和600 ℃煅烧粉体光催化性能都有不同程度下降。紫外光催化降解亚甲基蓝染料废水三小时,亚甲基蓝降解率分别只有42.3% 和58.0%。而600 ℃煅烧的TiO2/ 大理石复合材料生成了少量CaTiO3,CaTiO3(3.4 eV)禁带宽度比锐钛矿相禁带宽度大。CaTiO3是一种具有应用前景的潜在可见光催化剂[27],提升了TiO2/ 大理石复合材料光催化性能,因而600 ℃煅烧粉体光催化性能优于550 ℃煅烧粉体。
3 结 论
采用醇盐水解法制备TiO2/ 大理石复合光催化剂,研究不同温度煅烧后的复合材料光催化性能。结果表明:在TiO2/ 大理石复合材料粉体中,TiO2均匀包覆于大理石粉体表面。80℃干燥制备得到TiO2晶型为锐钛矿的TiO2/大理石复合材料,紫外光催化亚甲基蓝3 小时,亚甲基蓝的降解率达78.9%,为有机污染处理及大理石废料再利用提供了一种有效方法;600 ℃煅烧TiO2/ 大理石复合材料时,TiO2与大理石在界面上发生固相反应,生成了少量CaTiO3,这一意外发现为实现在可见光下光催化降解有机污染物提供了一种新途径。
