个体化假体复合人工骨移植修复兔下颌骨缺损的实验研究
2020-11-06陈俊兰吴带生吴纪楠陈觉尧郑巧仪彭伟
陈俊兰 吴带生 吴纪楠 陈觉尧 郑巧仪 彭伟

【摘要】 目的:观察快速成型(rapid prototyping,RP)技术辅助下制作的个体化假体复合珊瑚羟基磷灰石(coralline hydroxyapatite,CHA)、重组人骨形成蛋白-2(recombinant human bone morphogenetic protein-2,rhBMP-2)修复兔下颌骨缺损的成骨效果。方法:以27只新西兰大白兔为实验对象,随机均分为三组(n=9),全部建立下颌骨连续性缺损模型,并在兔下颌骨缺损区分别植入个体化假体+自体骨(A组)、个体化假体+CHA(B组)及个体化假体+CHA+rhBMP-2(C组)。分别于术后4、12、24周三个时间点处死动物取材,进行大体标本观察、骨密度检测、最大抗压力测试,分别比较各组修复骨缺损的能力。结果:术后24周,三组实验兔外形均对称,骨缺损区均有大量新骨形成。术后12、24周,A、C组新骨密度值及最大抗压能力均明显高于B组,差异均有统计学意义(P<0.05);术后24周时,A组与C组成骨效果大体一致,差异无统计学意义(P>0.05)。結论:RP技术与组织工程技术相结合修复下颌骨缺损,成骨效能肯定,CHA复合rhBMP-2后成骨能力明显增强,为临床应用个体化假体复合人工骨移植修复下颌骨缺损提供可靠的实验依据。
【关键词】 下颌骨缺损 个体化假体 重组人骨形成蛋白-2 珊瑚羟基磷灰石 反求工程 快速成型
[Abstract] Objective: To study the bone-formal effect of individulized prosthesis combined with coralline hydroxyapatite (CHA) and recombinant human bone morphogenetic protein-2 (rhBMP-2) on repairing rabbits mandibular defect using rapid prototyping (RP). Method: Twenty seven New Zealand white rabbits were randomly divided into three groups (n=9), all models of mandibular continuous defect were established, the three groups were treated with different materials: individulized prostheses and autogenous bone (group A), individulized prostheses with CHA (group B) and individulized prostheses with CHA and rhBMP-2 (group C). The animals were killed at 4, 12 and 24 weeks after operation, the gross specimen observation, bone mineral density test and maximum anti pressure test were performed to compare the ability of repairing bone defect in each groups. Result: At 24 weeks after operation, the shape of rabbits in three groups were symmetrical, and a large number of new bone formed in the bone defect area. At 12, 24 weeks after operation, the new bone mineral density and maximum compressive capacity of group A and C were significantly higher than those of group B (P<0.05). At 24 weeks after operation, the effects of group A and group C were similar, there was no statistical significance (P<0.05). Conclusion: The combination of RP technology and tissue engineering technology in the repair of mandibular defects has positive osteogenic efficiency. The osteogenic ability of CHA combined with rhBMP-2 is significantly enhanced, which provides a reliable experimental basis for clinical application of individualized prosthesis combined with artificial bone transplantation to repair mandibular defects.
[Key words] Mandibular defect Individulized prosthesis Recombinant human bone morphogenetic protein-2 Coralline hydroxyapatite Reverse engineering Rapid prototyping
First-authors address: Hospital of Stomatology, Peoples Hospital of Zhongshan City, Zhongshan 528400, China
doi:10.3969/j.issn.1674-4985.2020.24.006
下颌骨与咀嚼、吞咽、发音等功能密切相关。传统的自体骨或人工骨移植的方式并没有从根本上解决问题,如自体骨存活率高,但骨源有限;同种异体骨和异种骨因其抗原性而受限。组织工程学的兴起为解决这一问题提供了新的思路[1]。组织工程学是以体外构建、体内重建的技术方式摆脱了传统植骨模式[2]。由于目前生物材料强度一般较低,且以脆性材料居多,难以承受较大的载荷,因此金属支架的支持成为必然的趋势。目前临床实践中修复颌骨缺损的金属材料常为手工弯制而成,塑型尤为困难,无法精确匹配。近年来,随着影像学技术的不断进步,快速成型(rapid prototyping,RP)技术可较为精确的恢复患者的颌骨外形,精确度好,效率高,备受临床关注[3-4]。
本实验首次设想将成熟的三维重建和RP技术与现有的生物陶瓷材料相结合,达到外形与功能兼备的修复效果,旨在为临床应用提供一条微创、高效、安全的治疗途径。珊瑚羟基磷灰石(coralline hydroxyapatite,CHA)因具有良好的组织相容性、骨引导活性、其理化性能与人体骨相似[5],同时重组人骨形成蛋白-2(recombinant human bone morphogenetic protein-2,rhBMP-2)是具有较强骨诱导作用的多功能细胞因子,能诱导大量新骨生成[6]。因此,本研究通过动物实验模型,观察个体化假体分别复合人工材料修复下颌骨连续性骨缺损的现实可能性,为今后临床应用提供初步实验依据。现报道如下。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 新西兰兔,雌雄不限,体重控制在2.5~3.0 kg,所有实验动物的饲养环境和术后处理均符合伦理审查的标准(合格证号为0061280,实验室设施环境合格证号为0034862)。
1.1.2 个体化假体的制作 随机取1只实验兔,全麻后分层切开皮肤、皮下组织,去净软组织,电锯截骨(图1),造成下颌骨体部长宽为1.5 cm×1.0 cm的实验性箱状骨缺损,建立兔下颌骨连续性缺损动物模型(图2);采用Sensation16螺旋CT(Simens Somation Sensation16)扫描,获得连续断层影像,将扫描结果以DICOM格式输入计算机,采用Mimics 10.0软件进行三维重建,记录数字模型(图3);再根据镜像原理、曲面重构、有限元分析技术得到缺损区植入体的三维数字模型,通过快速成型机制作个体化假体的树脂修复体(图4~7),检查匹配度,最后将树脂模型浇铸成个体化纯钛假体(图8),消毒备用,参考文献[7]。
1.2 实验方法
1.2.1 珊瑚人工骨的准备 将CHA加工成长3 mm、宽2 mm、厚2 mm的长方体,经5%次氯酸钠液浸泡0.5 h,流水冲洗和双蒸水超声清洗各3次后(3 min/次),烘干,备用。
1.2.2 复合珊瑚人工骨的制备 取27 mg rhBMP-2,溶于0.1 L溶度为4 mol/L盐酸胍溶液中,放入1.08 g CHA内,负压真空,对蒸馏水透析,冻干,消毒备用。rhBMP-2和CHA的质量比为1︰40(w︰w)。
1.2.3 实验分组 按术前设计全麻下建立27只实验兔下颌骨连续性缺损实验模型(参照1.1个体化假体制作的建模过程分别制备27个个体化假体),随机均分为三组:对照组(A组:个体化假体+自体骨,n=9)、实验1组(B组:个体化假体+CHA,n=9)与实验2组(C组:个体化假体+CHA+rhBMP-2,n=9)。
1.2.4 术后处理 术后每只实验兔常规抗感染,2次/d,持续4 d。术后以全流、半流质饮食饲养各两周,后常规饮食。术后4、12、24周三个时间点处死实验动物(每个时间点每组随机处死3只),取缺损区标本检测。
1.3 实验观察
1.3.1 一般情况观察 观察三组兔的饮食、伤口愈合情况。
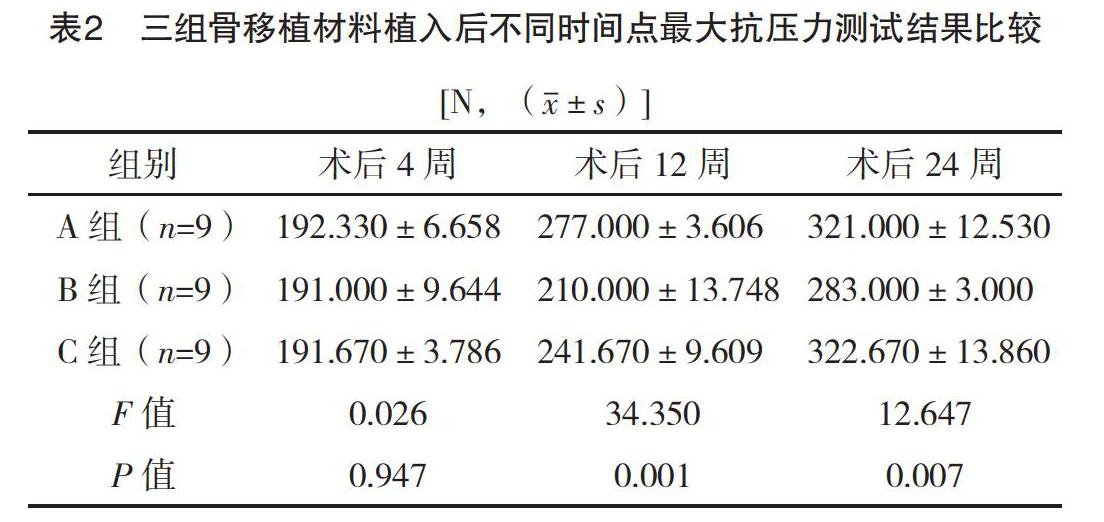
1.3.2 骨密度检测 于术后4、12、24周三个时间点进行大体标本观察后,取材,标本范围在缺损区周缘2 mm,即1.9 cm×1.0 cm线锯截骨,去除个体化假体和周边软组织,观察骨缺损区新骨形成情况,经计算机图像分析,测量骨缺损区的骨密度(代表新骨密度)。将标本置于双能X线快速骨密度仪的扫描台上(XR-46双能X线快速全身骨密度诊断仪,NORLAND公司,美国),记录缺损区新骨密度(g/cm2)。
1.3.3 最大抗压力测试 行骨密度测试后,以标本为中点施加载荷,电脑记录新生骨最大破坏载荷即最大抗压力值(N),代表新骨的抗压强度,具体参考文献[7]。
1.3.4 HE染色观察 光镜下观察缺损区成成纤维细胞、成骨细胞的动态变化,评估各组骨愈合效果。
1.4 統计学处理 采用SPSS 22.0软件对所得数据进行统计分析,计量资料用(x±s)表示,重复测量设计资料的单因素方差分析,组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
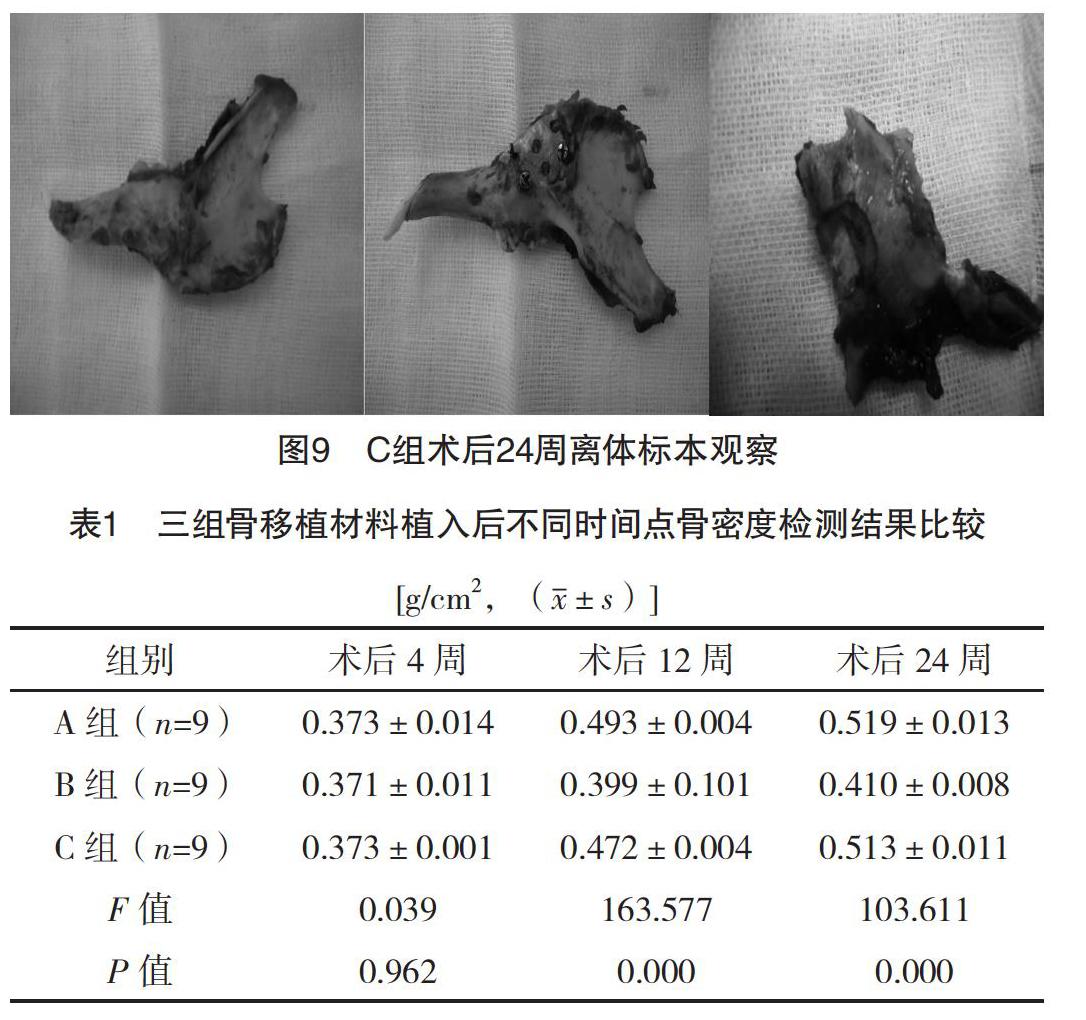
2.1 术后一般情况 所有实验兔饮食及术后愈合良好(图9),所有实验兔均进入结果分析,无丢失。
2.2 骨密度检测 三组标本随时间的延长骨密度逐渐增加,存在明显的时间效应。术后4周:三组骨密度比较,差异无统计学意义(P>0.05);术后12周:三组骨密度比较,差异有统计学意义(P<0.05),A组骨密度高于C组与B组(t=17.24,P=0.008;t=3.89,P=0.000),C组高于B组(t=13.35,P=0.000);术后24周:A组与B组、B组与C组比较,差异均有统计学意义(t=12.77,P=0.000;t=-12.14,P=0.000),A组与C组比较差异无统计学意义(t=0.62,P=0.060)。见表1。
2.3 最大抗压力测试 三组术后标本抗压强度随时间延长均呈上升趋势,存在明显的时间效应。术后4周:三组最大抗压力比较,差异无统计学意义(P>0.05);术后12周:三组最大抗压力比较,差异有统计学意义(P<0.05);术后24周:三组最大抗压力比较,A组高于B组,C组高于B组(t=4.26,P=0.005;t=4.44,P=0.005),A组与C组比较差异无统计学意义(t=-0.18,P=0.86)。见表2。
2.4 HE染色观察 三组骨移植材料与骨断端结合处,随时间的延长,成骨细胞数量有不同程度增多,均有骨小梁出现,但排列分布不均,每组中可见编织骨向板层骨过度,但成骨速度不尽相同,A组、C组成骨效果相对B组明显(图10)。(1)术后4周:三组宿主骨与骨移植材料结合处见大量纤维组织,未见明显骨组织。(2)术后12周:A组骨样组织隐约可见编织骨向板层骨过度;B组大量成纤维细胞增生,可见部分骨小梁;C组明显可见编织骨向板层骨过度。(3)术后24周:A组大量致密骨样组织,可见成熟的板层骨形成;B组编织骨向板层骨过度,未见明显骨陷窝结构;C组可见均匀致密的板层骨、大量骨髓腔形成,已连续性骨愈合。
注:(1)术后4周,图A1、B1、C1三组均见成纤维细胞增生活跃,大量圆形和立方形成骨细胞。(2)术后12周,图A2大量骨小梁形成,编织骨向板层骨过度;图B2骨样组织开始增多,部分骨小梁结构;图C2编织骨向板层骨过度,大量成骨细胞包裹其中。(3)术后24周:图A3成熟的板层骨形成,见哈弗氏系统形成;图B3大量骨小梁形成,编织骨向板层骨过度;图C3均匀致密的板层骨形成,大量骨髓腔形成。
3 讨论
本实验CHA钙磷摩尔比为1.67,与天然骨接近,其中CaO/P2O5含量和CaO/P2O5比值与美国市场interpro-500和interpro-200相近;有学者认为,最有利于成骨细胞渗透的内部通道连接直径要大于40 μm,而孔径在150 μm时,能为骨组织的创建良好环境[8-9]。本实验材料的平均孔径为250 μm,促进了吸收生物因子及血管间的互动,确保骨组织的有效生长。
信号分子(骨生长因子、骨诱导因子)是组织工程骨的三个关键要素之一。国内外学者进行了大量的研究证明BMP和rhBMP均能诱导骨再生,具有修复临界骨缺损、促进骨折愈合的特点,其中rhBMP-2和rhBMP-7具有很高的活性备受关注[10-11]。rhBMP-2能使未分化的间质细胞经过趋化、增殖和分化,可明显促进骨缺损区的骨组织愈合。Lee等[12]实验发现rhBMP-2具有很强的成骨能力,但BMP单纯植入体内,易被蛋白酶水解,丧失一定的活性。因此笔者通过CHA体外复合的方式充分发挥生物材料的引导和诱导机制,加速新骨的形成,原理与上述一致。
新生骨的力学强度是其功能重建的坚实基礎,而骨力学强度可以通过测量BMD和最大抗压力值来判定[13]。本研究结果显示:随时间延长,新骨组织逐渐增多,缺损区骨强度明显提高,且植入C组高于B组,三组标本骨密度、最大抗压强度均随时间延长明显上升。因此本实验CHA、rhBMP-2组织工程材料成骨效果确切。然而目前,生物材料强度一般较低,以脆性材料居多,难以承受较大的载荷,如下颌骨大面积骨缺损的修复,且远期形态难以控制,因此金属支架的支持成为必然的趋势[14-15]。传统的骨科重建植入物很难实现骨缺损的个体化精确修复,此外手工塑形劳动强度大、时间长,不利于感染的控制[16-17]。本实验在三维重建基础上,利用RP技术的镜像原理制作单侧下颌骨缺损的个体化钛支架,高精度、效率及强度,大大简化了手术操作[18-20],为临床颌骨缺损修复方法提供新的途径。
本实验创新采用RP技术制作的个体化假体复合CHA、rhBMP-2修复下颌骨缺损,结合两种修复方式的优势,既可以充分利用组织工程材料有高度仿生、微创安全及生物材料本身的优越性能,又可以克服生物材料难以固定、强度不足、外形欠佳、体积受限等缺点,实现生物性的“骨愈合”,达到外形与功能兼备的实验效果,不失为一种有意义的尝试。本实验中骨密度检测、最大抗压力测试、组织学观察均显示C组成骨效果优于B组,24周时达到了自体骨愈合的“金标准”。说明个体化假体的加强并未影响组织工程骨的修复效果,相反其个体化的设计不仅达到形态上的完美效果,同时其镂空的立体结构,加速内部新生骨的改建,刺激了移植骨材料与宿主骨的整合。
综上所述,个体化钛支架复合CHA/rhBMP-2修复兔下颌骨缺损,实现了生物性的“骨愈合”,两者结合达到了个体化、弹性化、仿生化的修复效果,为今后的临床应用和推广奠定实验基础。
参考文献
[1] Yu T,Pan H,Hu Y,et al.Autologous platelet-rich plasma induces bone formation of tissue-engineered bone with bone marrow mesenchymal stem cells on\beta-tricalcium phosphate ceramics[J].J Orthop Surg Res,2017,12(1):178.
[2] Amir J A,Abbas A,Simin Z,et al.Mandibular rami implant:a new approach in mandibular reconstruction[J].J Oral Maxillofac Surg,2017,75(12):2550-2558.
[3] Ann K,Konstantine M,George L,et al.Reconstruction of mandibular defects with autogenous bone and decellularized bovine bone grafts with freeze-dried bone marrow stem cell paracrine factors[J].Oncology Letters,2017,13(3):1811-1818.
[4] Kumta S,Kumta M,Jain L,et al.A novel 3D template for mandible and maxilla reconstruction:Rapid prototyping using stereolithography[J].Indian J Plast Surg,2015,48(3):263-273.
[5] Prakasam M,Locs J,Salma-Ancane K,et al.Fabrication,properties and applications of dense hydroxyapatite:a review[J].J Funct Biomater,2015,6(4):1099-1140.
[6] Minier K,Toure A,Fusellier M,et al.BMP-2 delivered from a self-crosslinkable CaP/hydrogel construct promotes bone regeneration in a critical-size segmental defect model of non-union in dogs[J].Vet Comp Orthop Traumatol,2014,27(6):411-421.
[7]王忠东,陈俊兰,陈觉尧,等.个体化钛支架复合珊瑚羟基磷灰石和重组人骨形成蛋白2修复兔下颌骨缺损[J/OL].中华口腔医学研究杂志(电子版),2012,6(4):336-364.
[8] Lin X,Hunziker E B,Liu T,et al.Enhanced biocompatibility and improved osteogenesis of coralline hydroxyapatite modified by bone morphogenetic protein 2 incorporated into a biomimetic coating[J].Mater Sci Eng C Mater Biol Appl,2019,96(3):329-336.
[9] Chen Z,Zhang Y,Lin Z,et al.Radiological evaluation of dextran sulfate/recombinant human bone morphogenetic protein 2/chitosan composite microspheres combined with coral hydroxyapatite artificial bone in repairing large segmental bone defects[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2017,31(11):1384-1389.
[10] Zhang H X,Zhang X P,Xiao G Y,et al.In vitro and in vivo evaluation of calcium phosphate composite scaffolds containing BMP-VEGF loaded PLGA microspheres for the treatment of avascular necrosis of the femoral head[J].Mater Sci Eng C Mater Biol Appl,2016,60(10):298-307.
[11]阮蔷,赵刚,郭睿,等.纳米级多孔负载人骨形成蛋白2基因修饰支架对前成骨细胞株.分化的影响[J].中国组织工程研究,2016,20(38):5657-5663.
[12] Lee J H,Baek H R,Lee K M,et al.Effects of ovariectomy and corticosteroid -induced osteoporosis on the osteoinductivity of rhBMP-2 in a segmental long -bone defectmodel[J].Tissue Eng Part A,2015,21(15-16):2262-2271.
[13] Allen B,Migliorati C,Rowland C,et al.Comparison of mandibular cortical thickness and QCT-derived bone mineral density(BMD) in survivors of childhood acute lymphoblastic leukemia:a retrospective study[J].Int J Paediatr Dent,2016,26(5):330-335.
[14] Zhou M,Peng X,Mao C,et al.The Value of SPECt/CT in Monitoring Prefabricated Tissue-Engineered Bone and Orthotopic rhBMP-2 Implants for Mandibular Reconstruction[J].PLoS One,2015,10(9):e0137-167.
[15] David F,Levingstone T J,Schneeweiss W,et al.Enhanced bone healing using collagen-hydroxyapatite scaffold implantation in the treatment of a large multiloculated mandibular aneurysmal bone cyst in a thoroughbred filly[J].J Tissue Eng Regen Med,2015,9(10):1193-1199.
[16] Moura L B,Carvalho P H,Xavier C B,et al.Autogenous non-vascularized bone graft in segmental mandibular reconstruction:a systematic review[J].Int J Oral Maxillofac Surg,2016,45(11):1388-1394.
[17]李陽,曲卫国,裘罡,等.数字化导板在血管化腓骨肌皮瓣修复下颌骨缺损中的临床应用研究[J].中国实用口腔科杂志,2019,12(12):735-738.
[18] Sales P H D H,Cetira Filho E L,Oliveira Neto J Q,et al.Rapid Prototyping as an Auxiliary in Mandibular Reconstructions[J].J Craniofac Surg,2017,28(8):e744-e745.
[19] Lee S W,Kim H G,Ham M J,et al.Custom Implant for Reconstruction of Mandibular Continuity Defect[J].J Oral Maxillofac Surg,2018,76(6):1370-1376.
[20] Lim S H,Kim Y H,Kim M K,et al.Validation of a fibula graft cutting guide for mandibular reconstruction:experiment with rapid prototyping mandible model[J].Comput Assist Surg(Abingdon),2016,21(1):9-17.
(收稿日期:2020-02-05) (本文编辑:程旭然)
