紫铆素通过AMPK通路促进正常人黑素细胞黑素合成的机制研究
2020-11-06黄海艳杜娟张杰邹彦芬彭曦王芳于波邵勇
黄海艳 ,杜娟 ,张杰 ,邹彦芬 ,彭曦 ,王芳 ,于波 ,邵勇
(1.北京大学深圳医院,广东深圳518036;2.北京大学人民医院,北京100044)
白癜风是一种获得性进行性的色素脱失性皮肤病,以局部表皮功能性黑素细胞缺失为主要特征,全世界的发病率大约在0.5%~1%[1]。最新的研究结果发现,紫铆素及其衍生物可以抑制小鼠脾淋巴细胞的免疫功能,促进小鼠B16黑素瘤细胞和正常人黑素细胞黑素合成,但其具体分子机制尚不清楚[2-4]。有研究发现,AMPK通路在调节黑素生成过程中发挥着重要作用[5],因此,本研究将紫铆素作用于正常人黑素PIG1细胞,观察紫铆素对体外黑素合成的影响及其分子机制,为探讨紫铆素对白癜风的治疗作用提供理论依据。
1 材料与方法
1.1 研究对象
1.1.1 试剂 紫铆素(#F4043),α-黑素细胞刺激素(MSH)购自美国Sigma公司;胰岛素、氢化可的松、L-谷氨酰胺、L-Dopa(Sigma,美国);DMEM 培养基(Gibco,美国);乳酸脱氢酶细胞毒性检测试剂盒、BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所;抗 β-actin、MITF、TRP-1、TRP-2、腺苷酸活化蛋白激酶(AMPK)和P-AMPK抗体购自(Abcam,英国);辣根过氧化物酶(HRP)标记的兔二抗和鼠二抗购自美国CST公司;ECL发光液(Millipore,美国);其他试剂均为分析纯(南京化学试剂有限公司);AICAR(#HY-13417)购自上海MCE公司。
1.1.2 仪器 生物安全柜(AC2-4S1型)、CO2培养箱(Celmate型)购自新加坡Esco公司;CKX71倒置荧光显微镜购自日本奥林巴斯公司;BS210S分析天平购自德国Sartorius公司;Varoskan Flash多功能酶标仪购自美国Thermo Fisher公司;Milli-Q纯水仪购自美国Millipore公司;Tanon-5200全自动化学发光/荧光图像分析系统购自上海天能。
1.2 方法
1.2.1 细胞培养 正常人黑素细胞系PIG1细胞,来源于正常人黑素细胞,基本生物学特性与正常人原代培养黑素细胞相似。由美国芝加哥大学Caroline Le Poole博士惠赠[6]。复苏PIG1黑素细胞,加入含人黑素细胞生长添加剂HMGS及5%FBS的M254培养基,孵箱内培养。0.25%胰蛋白酶消化传代,细胞增殖良好,至80%左右融合时进行实验,光镜下细胞呈树突状为生长良好。
1.2.2 分组及给药 实验分组:对照组,α-MSH组(300 nmol/L),紫铆素低(10 nmol/L)、紫铆素中(100 nmol/L)、紫铆素高(1 μmol/L)剂量组,细胞加入药物刺激后完全培养48 h。在检测AMPK通路对黑素合成影响的实验中,先给与1 μM AICAR处理细胞4 h后,再给与各种药物处理48 h。
1.2.3 CCK-8法检测紫铆素对PIG1细胞活力的影响 选择对数生长期的PIG1细胞,胰酶消化,调整细胞密度为0.5×106/mL接种于96孔板,每孔100μL。过夜培养后按2.2加入药物培养48 h,每孔加入10 μL CCK-8孵育2 h后,562 nm检测吸光度。
1.2.4 LDH释放法检测紫铆素对PIG1细胞的毒性选择对数生长期的PIG1细胞,胰酶消化,调整细胞密度为0.5×106/mL接种于24孔板,每孔100 μL。按1.2.2加入药物培养48 h后收集培养基,按照乳酸脱氢酶细胞毒性检测试剂盒说明测定上清液中的LDH活性,在490 nm处测定吸光度。
1.2.5 NaOH裂解法检测PIG1细胞黑素含量 选择对数生长期的PIG1细胞,胰酶消化,调整细胞密度为1.0×106/mL接种于6孔板,按1.2.2加入药物培养48 h后,每孔加入100 μL总蛋白抽提裂解液进行匀浆,加入2倍体积的抽提液混匀。4℃,12 000转/min离心10 min。溶液分上中下3层,上层弃去,中间层蛋白膜用于蛋白定量(BCA)法。下层黑素沉淀加入 350 μL 1 mol/L NaOH(含 10%DMSO),80 ℃裂解2 h,于405 nm处测定OD值,计算黑素相对含量。
1.2.6 L-Dopa氧化法检测人皮肤组织酪氨酸酶(TYR)活力 选择对数生长期的PIG1细胞,胰酶消化,调整细胞密度为0.5×106/mL接种于6孔板,每孔加入100 μL总蛋白抽提裂解液进行匀浆,加入2倍体积的抽提液混匀,4℃,12 000转/min离心10 min。溶液分上中下3层,取中间层蛋白膜用于蛋白定量(BCA)法。计算含10μg总蛋白的裂解液体积,用PBS(0.1 mol/L,pH 6.8)定量至 100 μL,再加入 100 μL 0.01%L-Dopa,37℃避光孵育 30 min,475 nm 处测定OD值。
1.2.7 Western blot法检测黑素相关蛋白的表达 用RIPA裂解液提取细胞总蛋白,BCA法蛋白浓度定量,经SDS-PAGE电泳分离蛋白,将蛋白转移到PVDF膜上,5%脱脂牛奶室温封闭1 h,一抗在4℃孵育过夜,TBST洗涤3次,室温孵育二抗1 h,TBST洗涤3次,ECL化学发光法显影,拍照。
1.2.8 RT-PCR 用Trizol提取总RNA,逆转录合成cDNA,最后进行RT-qPCR检测。以GAPDH为内参计算mRNA相对表达量,引物序列为:
GAPDH 上游引物:5’-TGTGGGCATCAATGGATTTGG-3’,下游引物:5’-ACACCATGTATTCCGGGTCAAT-3’;MITF 上游引物:5’-GCCTGTCTCGGGAAACTTGA-3’,下游引物:5’-ACGCTGTGAGCTCCCTTTTT-3’;TRY 上游引物:5’-CGAGTCGGATCTGGTCATGG-3’,下游引物:5’-GACACAGCAAGCTCACAAGC-3’。
PCR反应体系为10 μL。反应条件:95℃变性60 s,60℃退火 50 s,72℃延伸 60 s,扩增 40个循环,最后72℃延伸10 min。
1.3 统计学处理 所有实验结果采用GraphPad Prism 5统计软件分析,数据采用均数±标准差(±s)表示,组间比较采用单因素方差分析(ONE-WAY ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 紫铆素对PIG1细胞活性的影响 CCK-8检测PIG1细胞活力结果显示,300 nmol/L α-MSH能上调 PIG1细胞活力至(1.89±0.32)倍(P=0.025),100 nmol/L和1 μmol/L紫铆素能上调PIG1细胞活力至(1.45±0.22)倍(P=0.021)和(1.90±0.31)倍(P=0.032),不同浓度紫铆素促进PIG1细胞增殖作用还呈剂量依赖性。与对照组相比,300 nmol/L α-MSH和不同浓度的紫铆素作用48hPIG1细胞释放的LDH差异无统计学意义。结果显示,α-MSH和紫铆素能促进PIG1细胞增殖,且不造成细胞毒性,见图1。
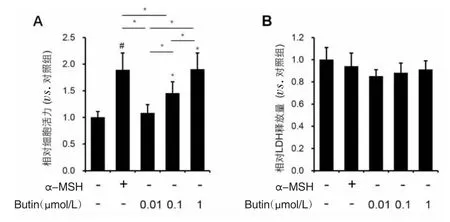
图1 α-MSH和紫铆素对PIG1细胞活力和LDH释放的影响
2.2 紫铆素对PIG1细胞黑素合成及酪氨酸酶活性的影响 与对照组相比,300 nmol/L α-MSH,100 nmol/L和1 μmol/L紫铆素作用48 h后,PIG1细胞黑色素含量分别上调(1.49±0.09)倍(P=0.009),(1.35±0.22)倍(P=0.027)和(1.59±0.11)倍(P=0.031),酪氨酸酶活力分别上调(1.29±0.08)倍(P=0.014),(1.15±0.17)倍(P=0.015)和(1.28±0.13)倍(P=0.015)。见图2。
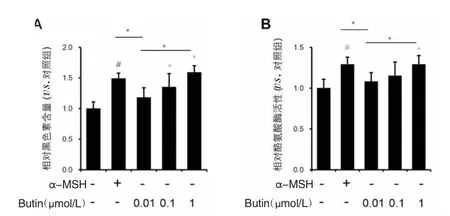
图2 α-MSH和紫铆素对PIG1细胞黑色素含量和酪氨酸酶活性的影响
2.3 紫铆素对PIG1细胞黑素合成相关蛋白和mRNA表达的影响 MITF是黑素合成的关键转录因子,并能调控黑素相关蛋白TRP-1和TRP-2的表达。与对照组相比,α-MSH能显著上调MITF、TRP1和TRP2的蛋白和mRNA表达水平,紫铆素剂量依赖性的促进MITF和TRP-1、TRP-2的蛋白和mRNA表达水平。结果显示,α-MSH通过上调TYR活力及MITF调控的黑素相关蛋白的表达促进细胞黑素合成,见图3。
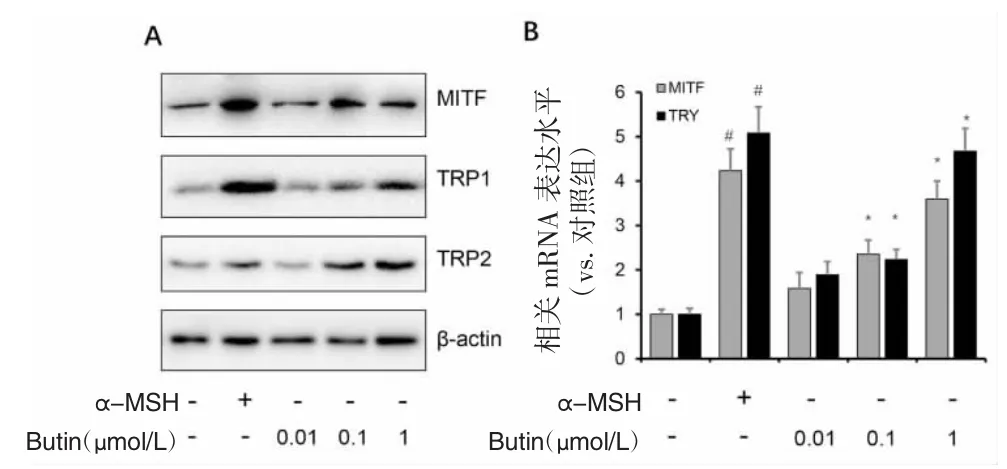
图3 α-MSH和紫铆素对PIG1细胞黑素相关蛋白(MITF、TRP-1、TRP-2)及其 mRNA 表达的影响
2.4 α-MSH和紫铆素抑制PIG1细胞AMPK通路 AMPK是调节黑素生成的重要激酶。结果显示,与对照组相比,300 nmol/L α-MSH和紫铆素能剂量依赖性地抑制AMPK的磷酸化水平,见图4。
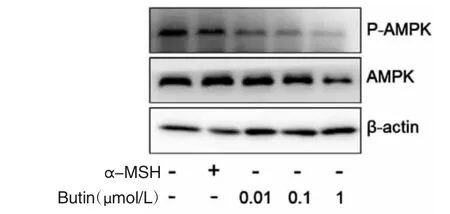
图4 α-MSH和紫铆素对PIG1细胞AMPK通路的影响
2.5 紫铆素通过AMPK通路调节PIG1细胞黑素合成相关蛋白和mRNA表达 AICAR是AMPK通路特异性激动剂,能显著刺激AMPK的磷酸化水平。1 μmol/L AICAR能显著抑制α-MSH和紫铆素对PIG1细胞MITF、TRP1和TRP2蛋白水平的上调作用,并抑制MITF和TRY的mRNA表达水平。结果表明,α-MSH和紫铆素都可通过AMPK通路调节PIG1细胞黑素合成途径。见图5。
2.6 AMPK通路激动剂对PIG1细胞黑素合成及酪氨酸酶活性的影响 结果显示,用AICAR激活PIG1细胞AMPK通路,能够显著抑制α-MSH和紫铆素诱导的PIG1细胞黑素合成增加和酪氨酸酶活性上调作用。结果表明,α-MSH和紫铆素可以通过AMPK通路促进PIG1细胞黑素合成,见图6。
3 讨论
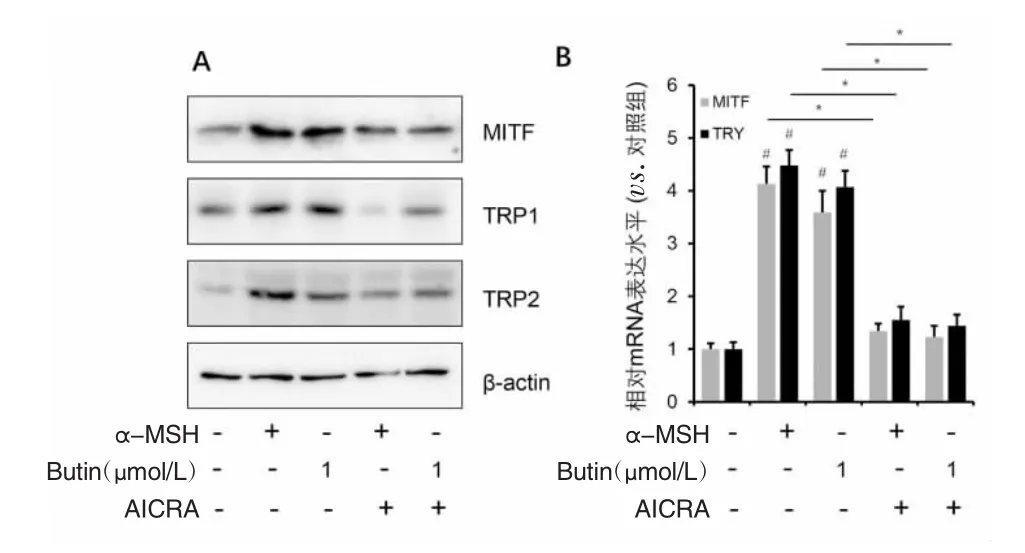
图5 AICAR对PIG1细胞黑素合成相关蛋白及其mRNA表达的影响
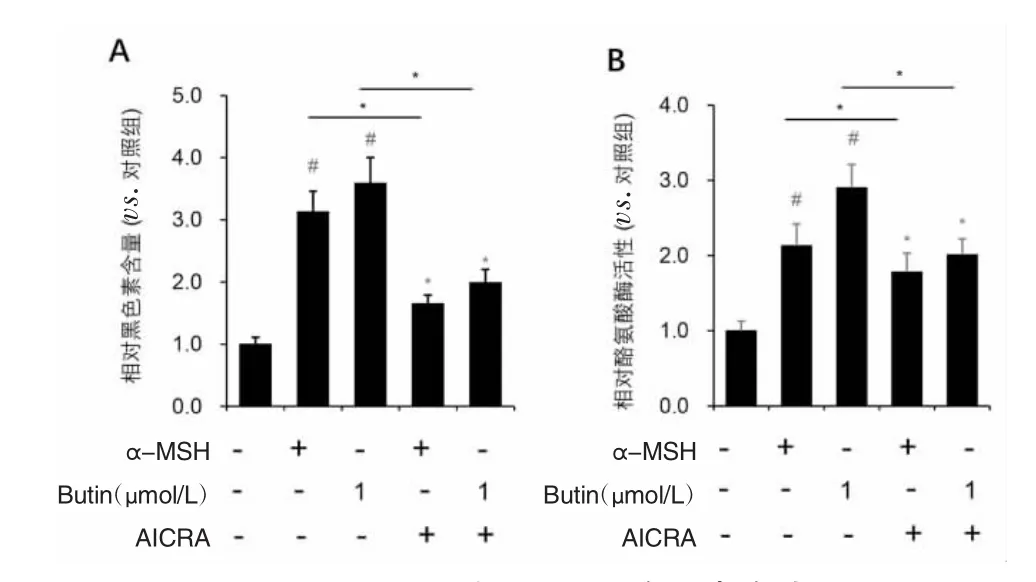
图6 AICAR对PIG1细胞黑素合成及酪氨酸酶活性的影响
白癜风是一种常见的色素脱失性疾病,由于其确切的病因尚未找到,目前还没有一种完全有效的治疗方法。紫铆素是从菊科植物驱虫斑鸠菊(Vernonia Anthelmintica Willd)的成熟果实中提取的一种黄酮类成分,紫铆素及其衍生物有抑制免疫、促进黑色素合成的作用[7-8],然而具体机制仍不清楚。本研究通过培养正常人黑素细胞PIG1,探讨紫铆素对皮肤黑素合成功能的影响及可能的作用机制。
首先,笔者观察了紫铆素对PIG1细胞潜在的毒性作用。300 nM α-MSH及不同剂量的紫铆素作用PIG1细胞后,可促进细胞增殖,但对LDH释放量无显著影响,见图1,这表明该研究剂量下的紫铆素对PIG1有增殖促进作用,且不引起毒性。
为了探讨紫铆素促进PIG1细胞黑素合成的分子机制,笔者检测了紫铆素对黑素合成相关蛋白表达的影响。TYR是黑素合成的限速酶,据文献报道其活性和表达直接影响黑素合成[9-10]。MITF是黑素合成的关键转录因子,并调控黑素相关蛋白TYR、TRP-1、TRP-2的表达,最终影响黑素合成[11]。结果显示,紫铆素剂量依赖性的促进人皮肤组织的TYR活性与黑素含量,见图3,上调黑素相关蛋白TYR、TRP-1、TRP-2及MITF的表达,见图4。
AMP依赖的蛋白激酶(AMPK)是调节生物能量恒定性的重要传感分子,能激活上游激酶LKB1、CaMKKβ和Takl等。AMPK的活性受AMP/ATP比值的调节,可调控能量代谢的分解与合成通路,调节脂肪细胞的代谢和血管功能,促进葡萄糖转运和脂肪酸氧化等[12]。最近的研究发现,AMPK通路在调节黑素合成方面同样发挥着重要作用。脂联素和AICAR可以激活AMPK通路,进而下调正常人和小鼠黑素细胞中的MITF,酪氨酸酶,TRP-1和DCT表达并降低黑素含量[4]。二甲双胍通过激活AMPK通路减少cAMP含量和cAMP反应元件结合蛋白(CREB)磷酸化导致小鼠黑素细胞瘤B16-F10细胞和正常人黑素细胞(NHM)中的黑素含量降低,这种抑制作用与黑素生成、MITF、酪氨酸酶、多巴色素互变异构酶和TRP1等基因的表达降低相关[13]。但是紫铆素是否能够通过影响AMPK活性调节黑素合成尚未有所报道。
与之前的研究结果相一致,α-MSH和紫铆素能够抑制PIG1细胞中AMPK活性,用AMPK特异性激动剂AICAR后,α-MSH和紫铆素促进PIG1细胞黑素合成的作用消失。结果表明,紫铆素促进PIG1细胞黑素合成的机制是通过抑制AMPK信号通路。
本研究探讨驱虫斑鸠菊中紫铆素促进黑素合成的分子机制。紫铆素通过抑制AMPK活性促进表皮黑素细胞的增殖及上调MITF及其调控的黑素合成相关蛋白的表达,从而促进人PIG1细胞的黑素合成。然而,目前紫铆素及其衍生物对色素代谢及色素性皮肤病治疗的具体机制尚未完全阐明,仍需进一步的探究。
