高致病性猪繁殖与呼吸综合征病毒自然感染与人工感染下的组织病理学观察
2020-11-03尹燕博李吉达
夏 阳,武 斌,尹燕博,张 毅,李吉达
(1.遵义医科大学公共卫生学院人畜共患病研究所,贵州遵义 563000;2.青岛农业大学动物医学院 山东青岛 266109;3.石家庄四药有限公司,河北石家庄 050000)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起,是重要猪传染病之一[1]。该病于1987 年首次报道于美国[2-3],其后在加拿大、法国、德国、英国、荷兰、比利时、西班牙、日本、菲律宾、澳大利亚等国家发生[4-6]。1996 年,郭宝清等[7]首次在流产胎儿中分离到PRRSV,从而证实了我国也有PRRS 流行。2006 年,我国大范围暴发了以猪群体温高热不退、皮肤发红、呼吸困难为主要临床症状的猪群疫情,最终确定是由PRRSV 变异株引起的。因其临床发病率及致死率远高于以往,所以该次疫情被定名为高致病性PRRS(HP-PRRS)疫情[8-9]。此次HP-PRRS 疫情导致大量猪只死亡,给国内养猪业造成了巨大经济损失[10]。HP-PRRS 暴发以来,围绕病毒致病力增强的原因及其机制,研究者从病原学角度做了大量工作[11-13]。然而,无论是针对非结构区还是结构蛋白的研究,目前有关HP-PRRSV 致病能力增强的原因及其机制仍未有明确的解释。伴随着国内灭活疫苗及减毒疫苗的成功研制及应用,HP-PRRS 疫情得到有效控制。然而由于过于忌惮HP-PRRS 的危害,疫苗尤其是减毒疫苗,存在滥用情况,使得国内已经很难找到PRRS 阴性猪场。研究[14-15]显示,自2006 年HP-PRRS 暴发以来,国内PRRS 分离株多属于高致病性病毒(HP-PRRSV)的分支,且同源性极高。这些分离株是否有的来自于疫苗毒不得而知,但田间PRRSV 可能正面临着新一轮的选择压力。因此,要想从根本上解除PRRS 的威胁,对于PRRSV 致病机制的研究刻不容缓。
目前,对于HP-PRRSV的病理学研究报道很多,但大都针对临床发病病例,而对于人工感染的HPPRRS 病例病理学研究鲜有报道,因而对于宿主各组织的病理性损伤,很难从致病机理方面做出准确判断。基于此,本研究拟对HP-PRRSV 自然感染发病组和人工感染发病组进行病理组织学比较观察,以期为PRRSV 的致病机理研究提供理论依据。
1 材料与方法
1.1 材料
PRRSV JXA1 株(TCID50为10-5.67),购自中国动物疫病预防控制中心;自然发病组病料,采自全国各地发病猪场;人工感染发病组病料,采自JXA1 株试验组;15 头PRRSV 抗体、抗原双阴性1 月龄仔猪,购自山东省青岛市某猪场。
1.2 方法
1.2.1 实验动物分组与饲养 采集全国各地发病并已鉴定为HP-PRRSV 感染的病猪,标记为自然发病组;随机挑选PRRSV 抗体、抗原双阴性1 月龄仔猪10 头,颈部肌内注射PRRSV 细胞毒(TCID50为10-5.67)2 mL;将5头1 月龄仔猪设立为阴性对照组,颈部肌内注射灭菌生理盐水2 mL。所有仔猪均在SPF 动物房中饲养,攻毒试验组与阴性对照组分别在安检区与效检区喂养,日常饮水、饲料一致。
1.2.2 大体病例解剖学观察 剖检病死猪(包括自然感染和人工感染),观察病变并拍照,分别摘取肺、淋巴结、脾、脑、心脏、肾、膀胱、肝、胃、肠、气管、喉头等,肉眼观察各组织器官病变。
1.2.3 病理组织学观察 快速采集肺、淋巴结、扁桃体、脾、脑、心脏、肾、肝、肠、气管、心血管等病料,用10%福尔马林固定后,制作常规石蜡切片,HE 染色,然后进行病理组织学检查,在显微镜下观察病变并拍照。
2 结果
2.1 自然感染发病猪病理剖检
自然感染发病猪临床上主要表现为精神沉郁、嗜睡、高热、耳尖发绀(图1-A、1-B)。发病猪解剖后大体病理学变化(图中红色箭头所示)主要表现为:肺部水肿,弥漫性出血(图1-C);肠黏膜面出血,部分病例见“扣状肿”(图1-D);肝脏表面常见灰白色坏死灶(图1-E);全身淋巴结出血严重(图1-F);部分病例胃底部黏膜见片状出血(图1-G);绝大多数病例心基部见喷洒样出血点(图1-H);脾脏不同程度肿大(图1-I);气管喉头黏膜面出血(图1-J);常见“僵猪”腹部脏器粘连(图1-K);肾脏不同程度水肿,揭开被膜,见针尖大小出血点(图1-L)。
2.2 人工感染发病猪病理剖检
人工感染发病猪临床症状及病理剖检(图中红色箭头所示)主要表现为:高热、嗜睡(图2-a),犬坐、腹式呼吸(图2-b),肺组织间质水肿、出血(图2-c),脾脏肿大(图2-d),扁桃体出血(图2-e),肝脏肿胀(图2-f),肠系膜淋巴结肿大、出血(图2-g),气管黏膜出血(图2-h),脑部水肿(图2-i),肾脏肿大、变形(图2-j)。
2.3 自然感染发病猪病理组织学观察
自然感染发病猪病理组织学变化如下(红色箭头指示主要病变):肺泡相互融合、“气球样”变,肺间质增宽,间质内见大量单核细胞(图3-A);肺泡壁出血,血浆析出,肺泡内见透明膜形成,肺小动脉充血(图3-B);气管黏膜下水肿(图3-C);肾小管出血,上皮细胞见水泡样变形(图3-D);肝细胞见水泡变形、颗粒变性、脂肪变性,肝血窦充血,肝细胞坏死,局部形成坏死灶(图3-E、3-F);脾脏见淋巴小结增生、脾小梁结缔组织坏死、玻璃样变性(图3-G、3-H);肠绒毛断裂、脱落(图3-I);肠集合淋巴小结增生(图3-J);脑组织见小胶质细胞增多和“管套”现象(图3-K)。
2.4 人工感染发病猪病理组织学观察

图1 自然感染发病猪临床症状及大体病理解剖学变化
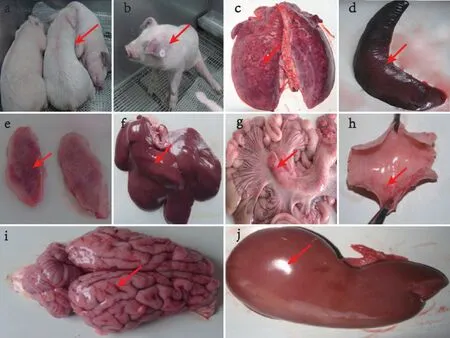
图2 人工感染发病猪临床症状及大体病理解剖学变化
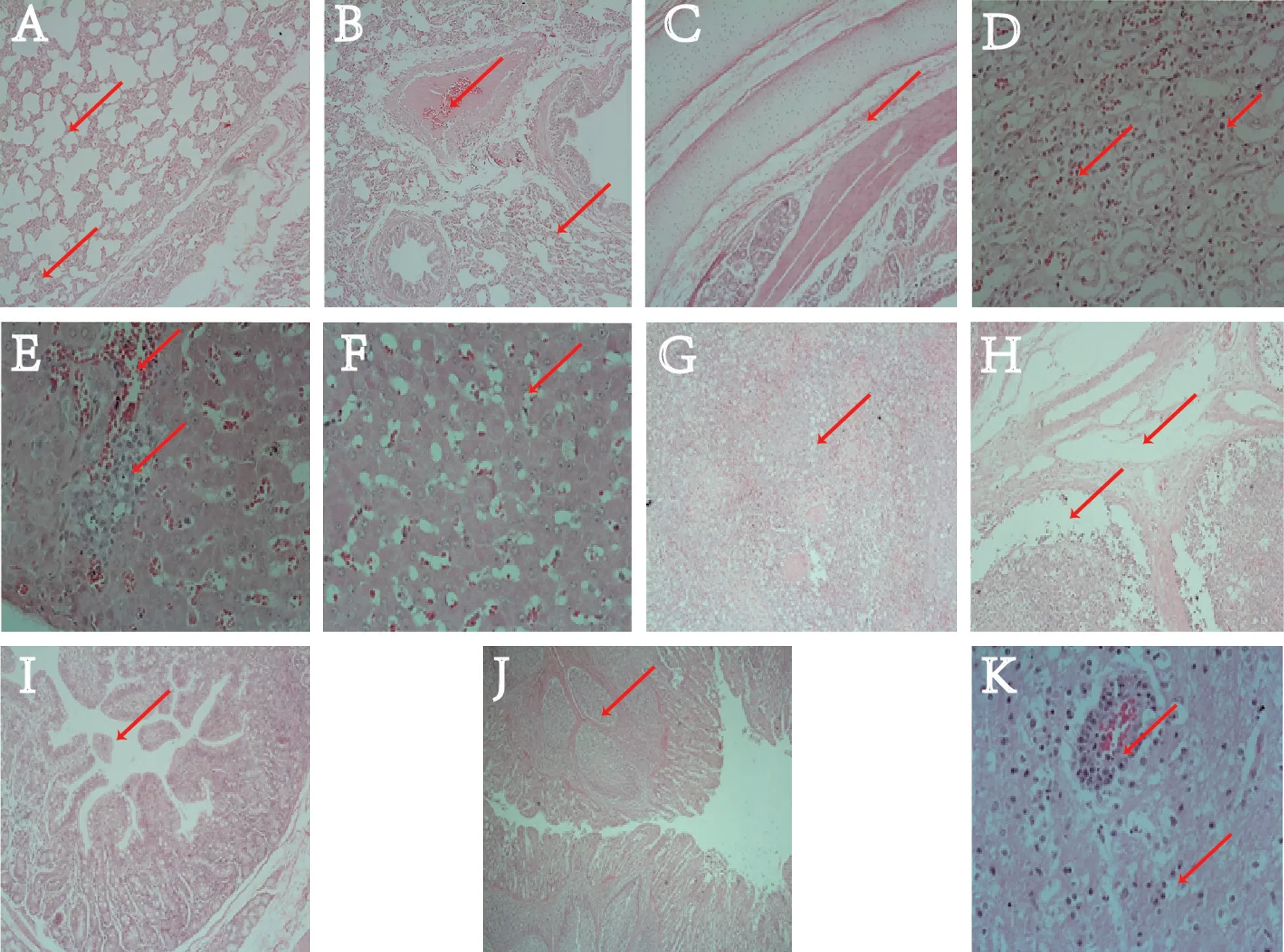
图3 自然感染发病猪病理组织学观察结果
人工感染发病猪病理组织学变化(红色箭头指示主要病变)如下:肺泡相互融合、“气球样”变,肺泡壁增厚、肺间质增宽,肺泡壁出血、血浆析出,肺泡内见透明膜形成,血管周围间隙增宽,有水肿液析出(图4-a);动脉血管内皮细胞坏死、脱落(图4-b);肾脏小静脉周围间隙增宽(图4-c);肝中央静脉淤血,蛋白样析出(图4-d);肝细胞见脂肪变性(图4-e);肾小球明显肿胀,肾小囊腔变窄(图4-f);肾小管周围见炎性细胞浸润(图4-g);脑神经元细胞大量坏死,呈现“筛网状”变化(图4-h);小胶质细胞局灶性增多,出现嗜神经元现象(图4-i、4-j);脑血管周围炎性细胞浸润,“管套”现象明显(图4-k);脾淋巴小结增生,小梁结构紊乱,脾脏结缔组织增生(图4-l—图4-q);气管黏膜层炎性细胞浸润、水肿(图4-r);心肌纤维水肿,肥大细胞浸润(图4-s);扁桃体出血,隐窝内细胞坏死(图4-t、4-u)。
3 讨论
3.1 PRRSV 及HP-PRRSV 病理学研究
受毒株[17-18]、免疫状态[19]以及管理因素影响[20],猪群感染PRRSV 后,临床表现复杂。早期临床症状见结膜炎、精神沉郁、嗜睡、食欲减退,通常持续几天至两周左右;中后期则表现为呼吸困难,体温居高不下,肢体末端开始淤血,并伴有神经症状。赵德明等[21]对感染PRRSV 的仔猪进行病理组织学研究发现:大体病理学变化主要表现为肌肉灰白色变化、浅表血管轻度淤血;病理组织学变化则表现为典型的间质性肺炎,包括肺水肿、间质增宽及炎性细胞浸润。2006 年,我国大范围内暴发了以体温高热不退、皮肤发红、呼吸困难为主要临床症状的PRRS 疫情。研究[8,22-23]发现,该病是PRRSV 变异株(JXA1 株)引起的,且该毒株业内公认是HP-PRRSV。随后该病引起业内广泛关注,大量研究见之于刊。其中病理学方面的研究大多针对临床自然发病病例,而对于人工感染方面鲜有报道。查阅相关文献,只有刘佩红等[24]针对HP-PRRSV 感染后的肺脏病理组织学变化进行了报道。由于宿主各组织的病理性损伤很难从致病机理方面做出准确判断,因此本研究对HP-PRRSV 自然感染发病组和人工感染发病组进行病理组织学比较观察,可为PRRSV 的致病机理研究提供理论依据。
3.2 人工感染和自然感染的病理学变化
本研究通过对自然和人工感染HP-PRRSV 病例进行比较病理学观察发现:(1)从病变的严重程度看,自然环境中的临床病例要高于单纯的HPPRRSV 感染。以淋巴组织为例,自然条件下病变几乎遍布所有淋巴结,而人工感染情况下病变明显者仅见于肺门淋巴结、肠系膜淋巴结以及下颌淋巴结。(2)从症状种类来看,自然环境中的临床病例往往是多种疾病典型症状同时出现,如“扣状肿”“麻雀肾”(猪瘟的典型临床表现),肝脏部位灰白色坏死灶(副伤寒症状之一);相比之下,人工感染情况下,肠道及肾脏的病变就没有那么明显。此外,继发感染尤其是继发细菌感染现象在自然发病的临床病例中极为常见。(3)肺部病理学变化对于PRRS 以及HP-PRRS 诊断具有指证意义。自然和人工感染病例在肺脏上均表现为严重的间质性肺炎。不同的是,自然发病病例在混合感染猪流感病毒时,肺脏表面会出现弥散性出血点,而人工感染情况下尚未见到。本研究中的自然病例病理学变化与刘思当等[25]的报道一致。基于以上研究发现及现有报道,本研究认为单纯的HP-PRRSV 感染所引起的病理变化主要表现为:以肺水肿、肺间质增宽、炎性细胞浸润为主要表观的严重间质性肺炎症状,下颌、肺门及肠系膜淋巴结出血,其中肺部病变对该病的诊断具有指证意义。
3.3 病理变化对HP-PRRSV 致病机制的推导

图4 人工感染发病猪病理组织学检查结果
肺脏作为PRRSV 的原发性器管,在病毒感染过程中首当其冲,其中肺泡巨噬细胞(pulmonarg alvcolar macrophages,PAMs)为病毒攻击的首要靶细胞。本研究发现,发病动物免疫器官(淋巴结与脾脏尤为明显)以及血液循环系统的变化,对于HP-PRRSV 致病机制的推演具有线索意义。大体病理学及病理组织学变化观察结果均显示,淋巴结与脾脏病变明显。基于现有的研究证据,推测PRRSV 与PAMs 细胞表面受体结合以后,以胞吞方式进入细胞,伴随着病毒的大量复制、PAMs 坏死、崩解,病毒粒子经淋巴循环到达以淋巴结和脾脏为主的外周免疫器官,并引起免疫器官损伤(淋巴结出血、脾脏结构紊乱)。在这种情况下,机体免疫力大大降低,这增加了自然条件下继发其他病原感染的概率。该结论也同样出现在Liu 等[16]的报道中。本研究发现,绝大多数脏器部位的血管表现出一致的病理变化:血管间隙因水肿液的析出而增宽并伴随炎性细胞浸润。与此同时,剖检过程中发现,病死动物右心衰竭非常普遍。基于以上发现推测,HP-PRRSV 对循环系统形成了攻击(PRRSV能够引起病毒血症已被广泛证实),其攻击的靶细胞很可能是血管内皮细胞(血管内皮细胞脱落,图4-c),动脉炎由此发生,血管内呈高压状态。伴随着肺动脉高压的加剧,肺循化受阻,右心室代偿性肥大,其他脏器牵连受损,其中以脑和肾脏病变表现最为明显。
