同源血浆及血清中蓝舌病病毒抗体ELISA 检测结果比较
2020-11-03
(云南省畜牧兽医科学院,云南省热带亚热带动物病毒病重点实验室,云南昆明 650224)
蓝舌病(bluetongue,BT)是发生于部分反刍动物的一种虫媒传播疫病,因病情严重动物的舌头严重损伤并呈深蓝色而得名。其病原体是蓝舌病病毒(bluetongue virus,BTV),属于呼肠孤病毒科环状病毒属[1]。BTV主要感染牛、羊、鹿等反刍动物,其中绵羊最易感。
自19 世纪首次在南非发现BT 以来,除南极洲以外的各大洲均发生过大规模BT 疫情,对畜牧经济造成了重大损失[2-3]。目前已知的BTV 血清型共有27 种,其中在我国境内发现的血清型共14 种[4]。虽然我国至今未发生大规模BT 疫情,但是自1979 年在云南省师宗县发现国内首例疫情以来,对BT 的监控及防治研究成为国内动物病防治的工作之一。
酶联免疫吸附试验(enzyme-linked immune sorbent assay,ELISA)、血清中和试验(serum neutralization test,SNT)、聚合酶链式反应技术(polymerase chain reaction,PCR)及病毒分离技术是检测诊断及分析动物病毒传染病的主要方法。ELISA、PCR、病毒分离也是目前最常用的BT 监测及流行病学调查方法。
通常情况下,血清样品可以用于上述各种检测及试验。但BTV 具有吸附红细胞特性[1,5],因此无论是PCR 检测病毒核酸还是从血液中分离BTV,均需要全血样品而非血清样品[6-8]。因此,在调查动物BTV 感染情况时,通常需要同时采集抗凝血样品和血清样品,前者用于PCR 检测及病毒分离,后者用于ELISA 检测病毒抗体或抗原。虽然ELISA 试验通常用于检测血清样品,但少数情况下也使用血浆样品[9-13]。因此,本试验旨在对比BTV 易感动物同源血浆及血清的ELISA 检测结果,以期分析血浆样品替代血清样品进行ELISA检测的可行性,从而减少样品采集工作量及样品数量,方便对养殖场牛、羊等动物的BTV 检测工作。
1 材料与方法
1.1 主要试剂及材料
1.1.1 主要试剂 BTV 的羊抗血清及兔抗血清:本实验室制备并保存[14];HRP 标记的羊抗兔二抗:65-6120,Invitrogen 公 司;PBST:0.01 mol/L PBS(B040100-0005,上海生工)加入0.05%的Tween-20(A600560,BIO BASIC INC);封闭液:含5%特级马血清(S9050,Solarbio)及0.01%硫柳汞(A600610,BIO BASIC INC)的PBST;抗体稀释液:含1%脱脂奶粉(完达山)及0.01%硫柳汞的PBST;TMB:LZ0823B50102,BIO BASIC INC 公司;反应终止液:0.625 mol/L H2SO4(7664-93-9,天津渤海化工集团供销有限公司);Bovine BLU-VP7 Ab ELISA 试剂盒:BG27653,美国TSZ公司。
1.1.2 试验动物 动物全血及血清于2019 年8 月7 日采自云南省德宏州芒市的一家肉牛养殖场。试验所用30 对全血-血清样品随机采自状态良好的30 头牛。
1.2 动物血样采集及制备
每只动物采集2 管4~5 mL 的全血样品。其中一支真空采血管含有EDTA 抗凝剂,收集全血样品;另外一支采血管不含抗凝剂,所采血样用于血清制备。抗凝血样品直接静置存放于4 ℃冷库,48 h 后各吸取约500 μL 上清液,即为血浆样品。非抗凝血样品在室温静置2 h 后离心(2 000 r/min,5 min),收集上清液,即为血清样品(本研究所用血清均为清澈的浅黄色血清)。血浆和血清样品均在4 ℃保存备用。
1.3 ELISA 试验
1.3.1 C-ELISA 检测BTV 抗体 应用本实验室制备的竞争ELISA(competitive ELISA,C-ELISA)检测试剂盒[14]测定血浆及血清中的BTV 抗体,方法简述如下:向高吸附ELISA 板加入50 μL/孔1:1 000 稀释的BTV 多克隆羊抗血清(用pH9.6 碳酸缓冲液稀释),4 ℃过夜;PBST 洗板后,加入50 μL/孔的BTV 抗原,37 ℃孵育1 h;洗板后加入200 μL/孔封闭液,37 ℃孵育1 h;甩去封闭液的ELISA 板在通风柜吹干后(约2 h)用干净包装袋真空封装,4 ℃保存。取两块抗原固定板,一块用于检测血浆样品,另外一块用于检测血清样品。每块ELISA 板检测待测样品30 份、阴性对照样品1 份、阳性对照样品1 份,各3 孔重复。向ELISA板加入40 μL/孔的抗体稀释液,再分别加入12 μL/孔的待检样品、阴性血清、阳性血清;随后加入50 μL/孔一抗(即100 倍稀释的抗BTV 的兔抗血清储存液);37℃培养箱孵育1 h。用PBST 洗板3 次,加入50 μL/孔1 000 倍稀释的酶标二抗,37 ℃培养箱中孵育30 min。随后用PBST 洗板5 次,拍干后加入50 μL/孔TMB 显色剂,37 ℃避光孵育10 min。加50 μL/孔反应终止液终止反应,用酶标仪读取450 nm 吸光度(OD)。OD 值结果换算为抑制率(present inhabitation,PI),PI=(阴性对照OD-样品OD)/阴性对照平均OD;PI ≥40%判定为阳性[14]。受检样品的PI值取3个平行结果的平均值,当标准差(SD)≥2%时将偏差最大的PI 值去掉并重新计算平均值。ΔPI,即PIP-PIS,为血浆样品(P)平均PI 值减去同源血清样品(S)平均PI 值的结果。
1.3.2 ELISA 试剂盒检测BTV 的VP7 抗体 取2 块预包被的ELISA 板,分别用于血浆样品及血清样品检测。每板包括30 份待测样品(3 孔重复)、1 份阳性对照血清(因孔数限制,取2 孔重复)、1 份阴性对照血清(3 孔重复)及1 孔空白对照。试验按照试剂盒说明操作。空白对照孔不加样品及HRP 偶联试剂,其余步骤同待测样品。向待测孔加入40 μL/孔稀释液后再分别加入10 μL/孔待测样品,向阳性对照孔及阴性对照孔分别加入50 μL/孔试剂盒提供的阳性及阴性标准液,37 ℃孵育30 min;加入150 μL/孔洗液洗板,放置30 s 后甩干,共进行5次;加入50 μL/孔HRP 偶联试剂,37 ℃孵育30 min后洗板5 次,拍干ELISA 板;先后加入50 μL/孔试剂A 和50 μL/孔试剂B,37 ℃避光孵育15 min;加入50 μL/孔反应终止液。使用酶标仪读取OD值。按照说明书标准:当阳性对照OD ≥1 及阴性对照OD ≤0.2 时结果有效;阈值=阴性对照平均OD+0.15;当样品平均OD ≥阈值即判定为VP7 抗体阳性,否则为阴性。受检样品的OD 值取3 孔重复读数的平均值,当标准差(SD)≥0.05 时将偏差最大的一个读数去掉并重新计算平均值。ODPODS为血浆样品(P)平均OD 值减去同源血清样品(S)平均OD 值的结果。
2 结果
2.1 C-ELISA 检测同源血浆及血清BTV 抗体
首先用实验室自制的C-ELISA 试剂盒检测样品中BTV 总抗体。30 份血浆及30 份同源血清各用1 块ELISA 板检测,每个样设3 孔重复。第一次试验所得抑制率(PI)及抑制率差值(ΔPI)结果(表1、图1)显示:整体上看,血浆样品的抑制率高于或等于同源血清样品的抑制率;有6 对样品的ΔPI 明显过高(ΔPI ≥10%),另外9 对样品的ΔPI 较大(ΔPI ≥5%),其余样品没有明显差异。该结果表明,对于同源血浆及血清样品的检测,虽然阳性/阴性结果的判定100%一致,但是对于具体数据而言,有20%样品存在显著差异,另外30%样品有较大差异。
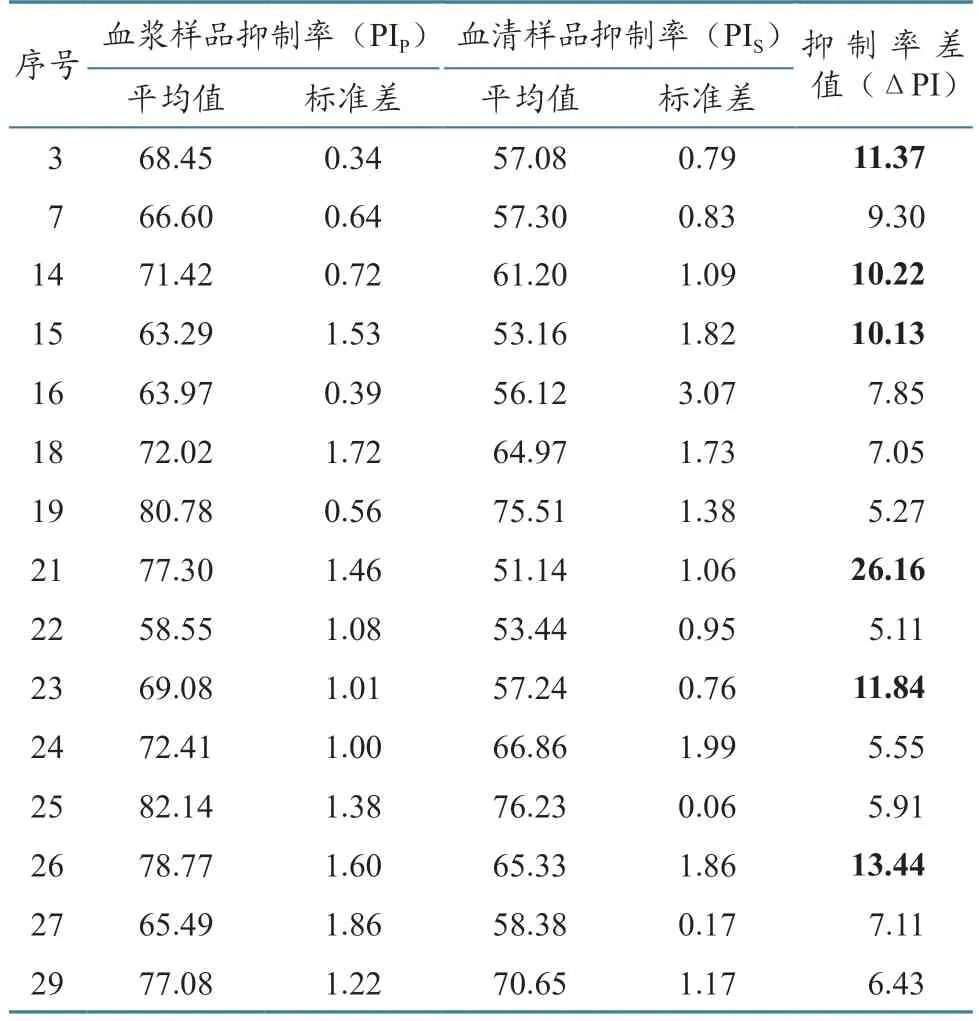
表1 15 对血浆-血清样品的BTV C-ELISA 抑制率差值 %
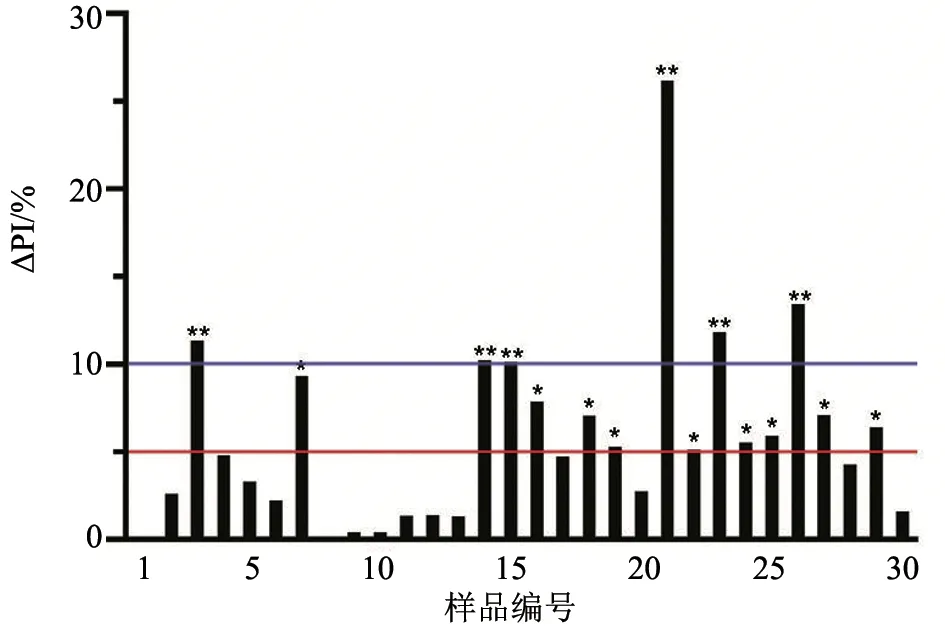
图1 30 对同源血浆及血清样品的抑制率差值(ΔPI)
与清澈的浅黄色血清样品相比,抗凝血样品中有不同程度的溶血现象,因此可能造成血浆样品的品质差异,进而造成试验误差。但经过审查发现,血浆样品的颜色深浅(即溶血程度)与ΔPI 没有必然联系(图2),例如ΔPI >10%的3 号和14号样品,其颜色与ΔPI <5%的4 号和5 号样品相近。ΔPI 与血浆样品的颜色深度没有递增或递减关系。

图2 部分血浆样品
考虑到血浆中或多或少的细胞碎片成分可能影响检测结果,对ΔPI ≥10% 的血浆样品离心(1 500 r/min,1 min),收集上清液,再次进行BTV C-ELISA 检测。为尽量避免操作误差,每加2 份(6 孔)血浆样品后即刻加入2 份(6 孔)同源的血清样品。结果(图3)显示:21 号样品的ΔPI 依旧很高,但是其他样品的ΔPI 明显缩小。综合两次C-ELISA 检测结果,在30 对样品中,有1 对样品(占比3.3%)PI 差值明显,3 对样品(占比10%)PI 差值较大,其余样品(占比87%)无明显差异(ΔPI 在±5%以内)。
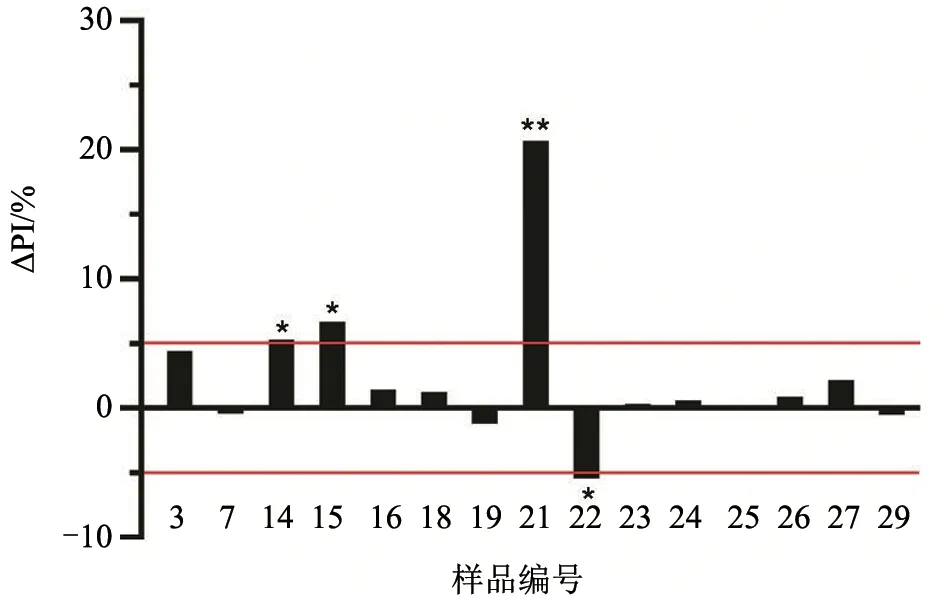
图3 15 对同源血浆及血清样品复检结果的抑制率差值(ΔPI)
2.2 ELISA 检测同源血浆及血清BTV VP7 抗体
参照第二次C-ELISA 的加样方法,用ELISA试剂盒检测上述样品的BTV VP7 抗体。结果(表2 及图4)显示:13 号及27 号样品的ΔOD 偏差明显(|ΔOD|>0.1),8 号及12 号样品ΔOD 偏差较大(|ΔOD|≥0.05),其余样品ΔOD 不明显;即同源血浆及血清样品的OD 值一致率为87%(26/30)。按照试剂盒阳性判定标准,27 号血浆及13 号血清为VP7 抗体阳性,其他均为阴性,结果一致率为93%(28/30)。

表2 4 对血浆-血清样品的BTV VP7 ELISA 读数差值
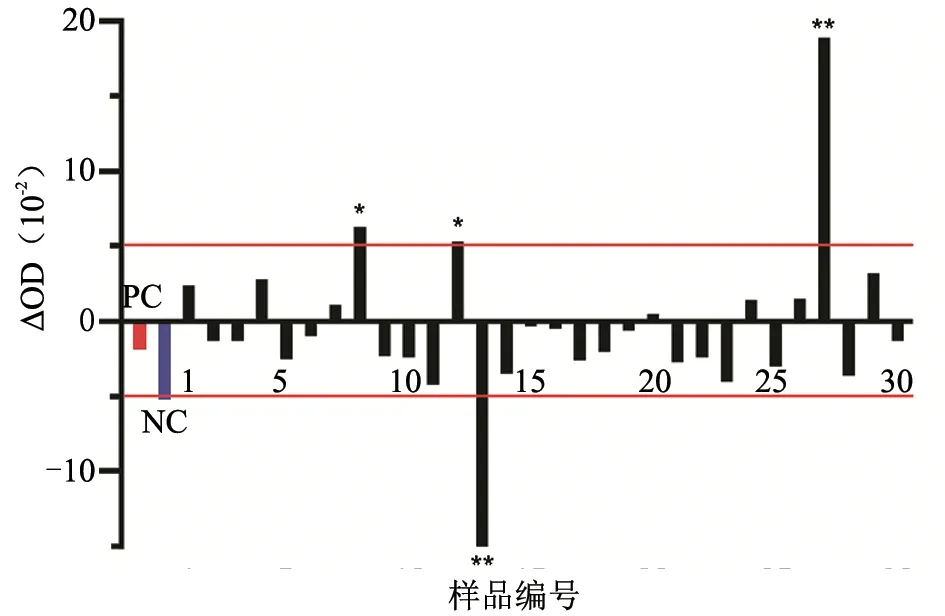
图4 ELISA 检测同源血浆及血清样品BTV VP7 抗体的OD 差值(ΔOD)
3 讨论
在检测血液样品中特定成分时,因检测项目不同而需要不同的血液样品,即全血、血浆、血清[9]。各种ELISA 检测中,血清是最常用的受检样品,少数情况也使用血浆样品[9,11,15]。血浆与血清成分的主要差异在于血浆中含有纤维蛋白原、凝血因子、血红蛋白(溶血时释放到血浆中)及人工添加的抗凝剂(本研究中的抗凝剂为EDTA-K2)[9]。血浆中成分较为复杂,尤其是粗制血浆还可能含有血细胞或血细胞碎片,其中某些成分可能干扰ELISA检测;而血清在制备过程中要经历凝血,有可能造成抗体的损失。
基于简化BTV 检测工作的目的,本研究对牛同源血浆和血清的ELISA 检测结果进行了比较分析。综合结果说明:(1)C-ELISA 检测BTV 总抗体的阳性判定一致率为100%,数值高度一致(|ΔPI|<5%)的比率为87%;(2)ELISA 试剂盒检测BTV VP7 抗体的阳性判定一致率为93%,数值高度一致(|ΔOD|<0.05)的比率为87%;(3)溶血对检测结果的差异没有必然联系,而离心去除血浆中的沉淀物及严格的实验操作可以明显降低检测误差。
本研究中的牛同源血浆及血清的抗体水平相当,即C-ELISA 检测BTV 总抗体的|ΔPI|<5%,ELISA 试剂盒检 测VP7 抗体的|ΔOD| <0.05;结果的差异程度与ELISA 检测的板间和平行孔间的实验误差相当。与之一致的是,贾波等[11]对人同源血浆及血清4 种病原体的抗体或抗原指标进行ELISA 检测,说明血浆的抗体水平略低于血清样品,但这主要归因于抗凝剂对血浆的稀释作用(全血中含1/5 体积的抗凝剂)。在BTV 总抗体检测中,出现1 对反差明显的样品(21 号样品),可能是同源血浆与血清偶然出现的差异,也可能是样品采集失误或罕见的实验误差造成,因为在第二次C-ELISA 检测中,21 号血浆样品有2 个偏高结果(87.77%、85.58%)和1 个偏低结果(65.60%),如果被判定为异常数据的那个数据(65.60%)才是真实结果的话,那么ΔPI 的结果将为-0.38%(21号血清PI=65.98%)。在BTV VP7 抗体检测中,差异特别明显的两对样品为13 号(血浆阴性、血清阳性)和27 号(血浆阳性、血清阴性),也存在类似于21 号样品的数据选择问题;而且同一个阴性对照样品(NC)在2 块ELISA 板上的ΔOD也达到了0.052 3,说明板间本身存在较大的试验误差。
综上所述,对于ELISA 检测动物血样BTV 抗体的试验,血浆样品可替代血清样品,溶血程度即血浆颜色不影响检测结果,但是粗制血浆中的不可溶杂质可能影响检测结果,因此需要使用离心除杂后的血浆样品。此外,当样品检测结果介于阳性和阴性的临界点时可能出现不同结果;然而即使是血清样品,试验操作本身的误差也可能造成临界点样品的误判。而对于同样具有红细胞吸附特性的其他病毒——流行性鹿出血热病毒(epizootic hemorrhagic disease virus,EHDV)[1,16]的研究,所涉及的血液样本采集也可省略血清制备。此外,在野外采集动物血样用于疫病检测不方便及时制备血清的情况下,亦可采集抗凝全血代替血清,随后在实验室离心全血后收集血浆用于ELISA 检测。
